Adjuvante Therapie bei lokalisiertem RCC
Autoren:
Dr. Arman Alimohammadi
Priv.-Doz. Dr. David D’Andrea
Prof. Dr. Dmitry Enikeev
Prim. Univ.-Prof. Dr. Shahrokh F. Shariat
Universitätsklinik für Urologie
Medizinische Universität Wien
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Patienten mit einem „High risk“-Nierenzellkarzinom (RCC) haben ein erhöhtes Risiko, ein Rezidiv zu erleiden und daran zu sterben. Pembrolizumab ist der erste Checkpoint-Inhibitor, der im adjuvanten Setting nach Nephrektomie bei Patienten mit „High risk“-RCC zu einem signifikant verlängerten krankheitsfreien Überleben (DFS) führt.1
Keypoints
-
Pembrolizumab ist der einzige Immuncheckpoint-Inhibitor, der als adjuvante Therapie nach radikaler oder Teilnephrektomie für Patienten mit hohem Rezidivrisiko von FDA und EMA zugelassen ist.
-
Pembrolizumab erzielt eine signifikante Verlängerung des krankheitsfreies Überlebens.
-
Pembrolizumab konnte bisher keine signifikante Verlängerung des Gesamtüberlebens zeigen.
-
Der Tyrosinkinaseinhibitor Sunitinib ist von der FDA als adjuvante Therapie zugelassen.
-
Aufgrund des fehlenden Vorteils im Gesamtüberleben ist Sunitinib als adjuvante Therapie von der EMA nicht zugelassen.
Die Nierenteilresektion oder auch die radikale Nephrektomie stellen die Standardbehandlung des lokalisierten Nierenzellkarzinoms dar. Trotzdem kommt es bei einer Vielzahl der Patienten mit einem „High risk“-RCC nach der Operation zu einem Rezidiv. Die meisten dieser Patienten haben Fernmetastasen, was zu einer erheblichen Verkürzung der Lebenserwartung führt. Risikofaktoren wie das Krankheitsstadium, die Größe, der nukleäre Grad und der regionale Lymphknotenbefall des resezierten Tumors sind mit einer erhöhten Wahrscheinlichkeit eines Wiederauftretens der Erkrankung sowie mit einem verkürzten rezidiv- und metastasenfreien Überleben verbunden. Die EAU (European Association of Urology) bietet die folgenden Prognosemodelle für das lokalisierte Nierenzellkarzinom an: Leibovich-Score-Modell 2003 und 2018, University of California Integrated Staging System, VENUSS-Score-Modell und Grant-Score-Modell.
Immuncheckpoint-Inhibitoren
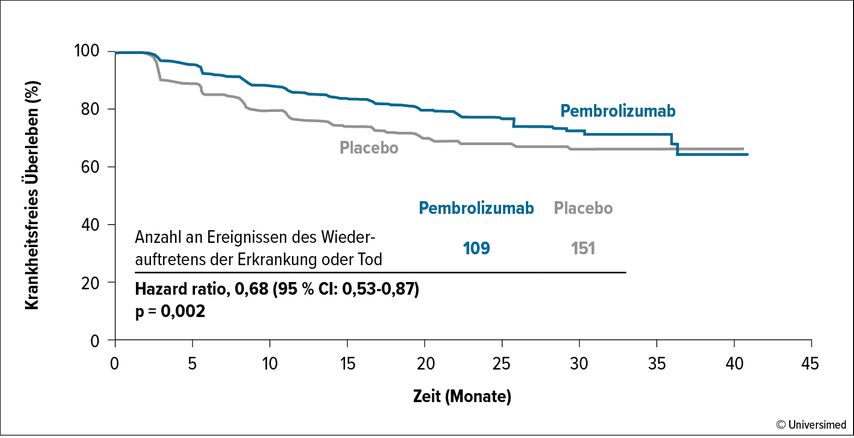
Die EMA (European Medical Agency) hat mit Pembrolizumab die erste Immuntherapie in Europa für die adjuvante Therapie beim Nierenzellkarzinom zugelassen. Der PD-1-Inhibitor kann somit im adjuvanten Setting bei Nierenzellkarzinompatienten, die nach einer Nephrektomie oder nach einer Nephrektomie und Resektion metastasierter Läsionen ein erhöhtes Rezidivrisiko haben, eingesetzt werden. Pembrolizumab ist der erste Checkpoint-Inhibitor, der im adjuvanten Setting nach Nephrektomie bei Patienten mit „High risk“-RCC zu einem signifikant verlängerten krankheitsfreien Überleben führt. Die doppelblinde, multizentrische, randomisierte KEYNOTE-564-Studie ist die erste positive Phase-III-Studie zur adjuvanten Immuntherapie bei Patienten mit Nierenzellkarzinom.1 In der Studie wurden 994 Patienten nach Nephrektomie mit „Intermediate-high“- oder „High risk“-RCC (definiert als pT2, Grad 4; oder sarkomatoider Subtyp, N0 M0; oder pT3, N0 M0; oder pT4, N0 M0; oder N+ M0; oder M1 NED [„no evidence of disease“]) eingeschlossen und erhielten entweder Pembrolizumab (n=496) oder Placebo (n=498). Pembrolizumab wurde bis zu einem Jahr verabreicht. Die Patienten erhielten in beiden Studienarmen im Median 17 Zyklen Pembrolizumab oder Placebo. In der Interimsanalyse wurde der primäre Endpunkt DFS erreicht (HR: 0,68, 95% CI: 0,53–0,87, p=0,001). Nach 24 Monaten lag das geschätzte DFS bei 77,3% unter Pembrolizumab und bei 68,1% unter Placebo (Abb. 1). Mit einer medianen Nachbeobachtungszeit von 24,1 Monaten wurde in der Gesamtpopulation eine Verringerung des Sterberisikos unter Pembrolizumab im Vergleich zu Placebo um 32% beobachtet (HR: 0,68; 95% CI: 0,53–0,87; p=0,002).
Abb. 1: KEYNOTE-564: Kaplan-Meier-Kurve zu krankheitsfreiem Überleben unter Pembrolizumab vs. Placebo (nach Choueiri TK et al. 2021)1
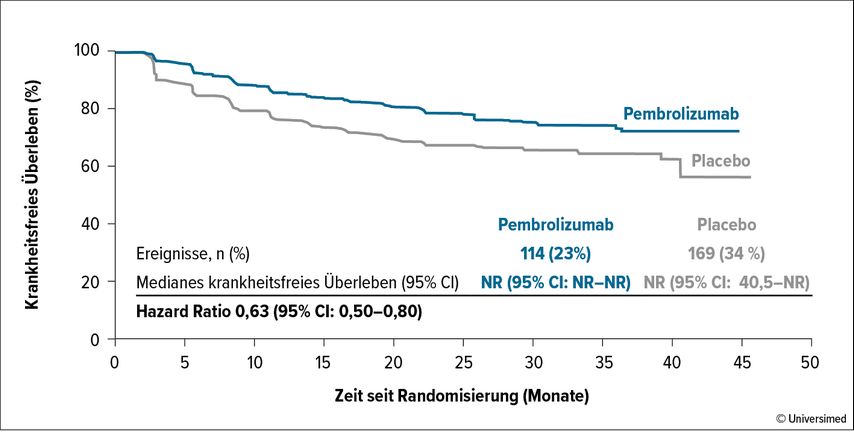
In der aktualisierten Analyse mit einem medianen Follow-up von 30 Monaten wurde eine signifikant längere Krankheitsfreiheit im Pembrolizumab-Arm im Vergleich zur Kontrollgruppe beobachtet (HR: 0,63 95% CI: 0,50-0,80, Abb. 2).2
Abb. 2: KEYNOTE-564: Signifikant längere Krankheitsfreiheit unter Pembrolizumab vs. Placebo (nach Powles T et al. 2022)2
In der Untergruppenanalyse zeigte sich ein Nutzen von Pembrolizumab bezüglich des Rezidivrisikos bei Patienten mit mittelhohem Rezidivrisiko (HR: 0,68, 95% CI: 0,52–0,89) und hohem Rezidivrisiko (HR 0,60, 95% CI: 0,33–1,10). Ein noch größerer Benefit der adjuvanten Therapie zeigte sich bei Patienten mit sarkomatoider Variante (HR: 0,54, 95% CI: 0,29–1,00) und der größte Nutzen wurde bei Patienten mit M1-NED-Status beobachtet (HR: 0,28, 95% CI: 0,12–0,66). Obwohl nach 30 Monaten ein Vorteil mit Pembrolizumab im Vergleich zu Placebo beim Gesamtüberleben beobachtet wurde (95,7% vs. 91,4%), wurde das geforderte Signifikanzniveau von 0,000095 noch nicht erreicht.
Die Auswertung der „Quality of Life“(QoL)-Daten ergab, dass Pembrolizumab im Vergleich zu Placebo zu keiner klinisch relevanten Reduktion der QoL führte. Diese Daten unterstützen weiterhin den Nutzen und die Verträglichkeit von Pembrolizumab im adjuvanten Setting in dieser Patientenpopulation. Studien mit anderen Immuntherapien im adjuvanten Setting, einschließlich Nivolumab, Atezolizumab und der Kombination von Nivolumab + Ipilimumab, zeigten nicht den erwarteten Nutzen.
Tyrosinkinase-Inhibitoren
In den USA ist Sunitinib als einziger Tyrosinkinaseinhibitor im adjuvanten Setting zugelassen. In der Zulassungsstudie (S-TRAC) wurden von 2007 bis 2011 insgesamt 615 Patienten mit klarzelligem „High risk“-RCC im Stadium III (T3 oder T4 und/oder N1) in die Phase-III-Studie aufgenommen. Die Patienten erhielten für maximal 1 Jahr entweder Sunitinib (4-wöchige Gabe, dann 2 Wochen nicht) oder Placebo. Das DFS war bei Patienten unter Sunitinib signifikant länger als in der Placebogruppe (6,8 vs. 5,6 Jahre; HR: 0,76; p=0,03). Das mediane Gesamtüberleben ist noch nicht erreicht.
In einer weiteren dreifach randomisierten Phase-III-Studie (ECOG ACRIN E2805) wurde Sunitinib mit Sorafenib und Placebo verglichen. Zwischen 2006 und 2010 wurden insgesamt 1943 Patienten eingeschlossen. Es zeigte sich kein Vorteil im DFS, weder für Sunitinib (Sunitinib vs. Placebo HR: 1,02; 97,5% CI: 0,85–1,23; p=0,8038) noch für Sorafenib (Sorafenib vs. Placebo HR: 0,97; 97,5% CI: 0,80–1,17; p=0,7184).
In der Phase-III-Studie SORCE wurde ebenfalls die Wirksamkeit von Sorafenib untersucht. Im Studienarm A erhielten die Patienten für 3 Jahre Placebo, im Studienarm B 1 Jahr Sorafenib, gefolgt von 2 Jahren Placebo, und im Studienarm C 3 Jahre Sorafenib. Auch hier zeigte sich kein Vorteil von Sorafenib im DFS gegenüber Placebo, weder bei Patienten, die 1 Jahr mit Sorafenib behandelt wurden (HR: 0,94; 95% CI: 0,77–1,14; p=0,509), noch bei Patienten, die 3 Jahre lang behandelt wurden (HR: 1,01; 95% CI: 0,82–1,23; p=0,946).
In der ATLAS-Studie wurde die Wirksamkeit von Axitinib vs. Placebo im adjuvanten Setting bei Patienten nach Nephrektomie untersucht.6 Es zeigte sich kein signifikanter Unterschied im DFS (HR: 0,870; 95% CI: 0,660–1,147; p=0,3211). In der Subgruppenanalyse der „Highest risk“-Subpopulation (pT3, FG ≥3 oder pT4 und/oder N+, jegliches T, jegliches FG) zeigte sich zwar eine Tendenz, jedoch kein signifikanter Vorteil für das DFS (HR: 0,735; 95% CI: 0,525–1,028; p=0,0704).
Zusammenfassung
Die adjuvante Gabe des Immuncheckpoint-Inhibitors Pembrolizumab verlängert das rezidivfreie Überleben bei Patienten mit Nierenzellkarzinom und hohem Rezidivrisiko nach radikaler oder teilweiser Nephrektomie. Auch die adjuvante Gabe von Sunitinib zeigt eine Verlängerung des rezidivfreien Überlebens, aber Langzeitdaten zeigen keinen signifikanten Einfluss auf das Gesamtüberleben. Aus diesem Grund ist Sunitinib als adjuvante Therapie durch die EMA nicht zugelassen.
Literatur:
1 Choueiri TK et al.: Adjuvant Pembrolizumab after nephrectomy in renal-cell carcinoma. N Engl J Med 2021; 385(8): 683-94 2 Powles T et al.: Pembrolizumab versus placebo as post-nephrectomy adjuvant therapy for clear cell renal cell carcinoma (KEYNOTE-564): 30-month follow-up analysis of a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2022; 23(9): 1133-44 3 Ravaud A: Adjuvant Sunitinib in renal-cell carcinoma. N Engl J Med 2017; 376(9): 893 4 Haas NB et al.: Adjuvant Sunitinib or Sorafenib for high-risk, non-metastatic renal-cell carcinoma (ECOG-ACRIN E2805): A double-blind, placebo-controlled, randomised, phase 3 trial. Lancet 2016; 387(10032): 2008-16 5 Eisen T et al.: Adjuvant Sorafenib for renal cell carcinoma at intermediate or high risk of relapse: Results from the SORCE randomized phase III intergroup trial. J Clin Oncol 2020; 38(34): 4064-75 6 Gross-Goupil M et al.: Axitinib versus placebo as an adjuvant treatment of renal cell carcinoma: Results from the phase III, randomized ATLAS trial. Ann Oncol 2018; 29(12): 2371-8
Das könnte Sie auch interessieren:
Der Infektstein als therapeutische Herausforderung
Rund 10% aller Harnsteine sind sogenannte Infektsteine. Die therapeutische Herausforderung besteht im schnellen Steinwachstum, in der Rezidivneigung und einer Obstruktion der Harnwege. ...
Psychische und körperliche Auswirkungen verschobener elektiver Operationen
Pflege- und Personalmangel führten in Österreichs Urologie zu deutlichen Einschränkungen in der elektiven operativen Versorgung. Eine Studie der Medizinischen Universität Graz zeigt, ...
Perioperative Therapie mit Enfortumab Vedotin + Pembrolizumab bei Cisplatin-ungeeigneten Patienten mit MIBC
Die Phase-III-Studie KEYNOTE-905/EV-303 schließt eine entscheidende und seit Langem offene Versorgungslücke bei muskelinvasivem Blasenkarzinom: Für Cisplatin-ungeeignete Patient:innen ...