Neue Therapieansätze für Arthrose
Bericht:
Dr. Felicitas Witte
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Dass Zellen altern, könnte eine entscheidende Rolle bei der Entstehung von Arthrose spielen. Welche Mechanismen dahinterstecken und welche Ansätze sich für neue Therapien ergeben, berichtete Dr. Richard Loeser aus North Carolina auf dem letztjährigen EULAR.
Lange Zeit ging man davon aus, dass alle Zellen unsterblich sind. Dieses Dogma wurde durch zwei US-Amerikaner in den 1960er-Jahren widerlegt. Der Gerontologe Prof. Leonard Hayflick und der Genetiker Prof. Paul Moorhead fanden heraus, dass menschliche Zellen nach circa 50 Teilungen die Vermehrung einstellen. Sie gehen in einen genetisch vorprogrammierten Ruhezustand über, der zelluläre Seneszenz genannt wird. Für bestimmte Zellen – unter anderem Tumorzellen – gilt dies nicht, sie können sich unbegrenzt teilen.
Dr. Richard Loeser, Direktor des Thurston Arthritis Research Center der University of North Carolina, berichtete in seinem Vortrag über die zelluläre Seneszenz bei muskuloskelettalen Erkrankungen mit Schwerpunkt Arthrose. Dabei handelt es sich um die häufigste altersassoziierte muskuloskelettale Erkrankung. Die Risikofaktoren für eine Arthrose können systemischer Natur sein – wie zum Beispiel Alter, Genetik, Geschlecht oder Übergewicht – beziehungsweise mit lokalen Ursachen wie Fehlstellungen, Gelenksausprägung, Gelenksverletzungen etc. verbunden sein. „Bei den meisten Patienten resultiert die Arthrose aus einer Kombination mehrerer Risikofaktoren“, sagte Loeser. Diese Erkrankung betrifft das gesamte Gelenk, alle Gewebe sind mehr oder weniger betroffen und die Quelle diverser inflammatorischer Mediatoren: Zytokine, Chemokine, Wachstumsfaktoren und Matrix-Metalloproteinasen (MMP). MMP sind in den Abbau von Gelenkgewebe involviert. „Ich fand es faszinierend zu sehen, wie die Liste an proinflammatorischen Mediatoren in den letzten 30 Jahren meiner Forschung angewachsen ist“, sagte Loeser. 2021 fasste er diese mit Kollegen aus Harvard in einer Übersichtsarbeit im JAMA zusammen.1 So kommen in der Synovialflüssigkeit vor allem Interleukin 6, monozytenchemotaktisches Protein-induziertes Protein 1, vaskulärer endothelialer Wachstumsfaktor, IP-10 („interferon γ-induced protein“) und MIG („monokine induced by interferon γ“) in hohen Konzentrationen vor. Die proinflammatorischen Mediatoren sind für die Destruktion und Umstrukturierung des Gelenkes verantwortlich, indem sie die Produktion von Gewebe-degradierenden Enzymen inklusive der MMPs stimulieren. Die anabolen Faktoren, die katabole Prozesse aufhalten und die Produktion der Matrix und die Reparatur des geschädigten Gelenkgewebes anregen, werden durch die proinflammatorischen Mediatoren quasi „geflutet“. Dieses Ungleichgewicht resultiert in einem mangelnden Reparaturmechanismus des Gewebes. Bestimmte Wachstumsfaktoren – unter anderem TGF-β („transforming growth factor β“) und BMP-2 („bone morphogenetic protein 2“) – fördern die Bildung von Osteophyten und tragen zur subchondralen Sklerose bei.
Zellseneszenz als Risikofaktor für Arthrose
Das Endstadium einer Arthrose sieht immer ähnlich aus, egal welche Risikofaktoren involviert sind. Wahrscheinlich entwickeln sich die Veränderungen aber auf unterschiedlichen Wegen, je nachdem, welche zugrunde liegenden Mechanismen beteiligt sind. Bei einigen dieser Wege spielt die Zellseneszenz eine Rolle, und das nicht nur beim Risikofaktor Alter, sondern auch beim Risikofaktor Übergewicht. Im Fettgewebe finden Entzündungsvorgänge statt, die mit der Akkumulation von seneszenten Präadipozyten einhergehen. Bei Gelenkverletzungen wurden ebenfalls seneszente Zellen gefunden. Die meisten Daten dazu stammen aus der Forschung in Mausmodellen. Es gibt also verschiedene Mechanismen, die zur Zellseneszenz führen können und nicht zwingend altersassoziiert sein müssen.
Arthrose ist primär eine Erkrankung des Alters. Junge Menschen leiden seltener daran, und mit zunehmendem Lebensalter steigt die Wahrscheinlichkeit dafür an.2 Ab dem Alter von 55 Jahren scheint die Prävalenz sprunghaft anzusteigen. „Hier kommt ein weiterer Risikofaktor hinzu, nämlich Adipositas“, sagte Loeser. Adipöse Menschen erkranken häufiger an einer Arthrose als Personen vergleichbaren Alters ohne Adipositas. Es seien hierzu viele Studien mit Mäusen durchgeführt worden, meinte Loeser, das Problem sei aber, dass in diesen Studien sehr junge Mäuse eingesetzt wurden. Eine reife, erwachsene Maus ist typischerweise drei bis sechs Monate alt, was dem Alter eines Menschen zwischen 20 und 30 entspricht.3 Solche Mäuse sind noch nicht von Seneszenz betroffen. „In vielen der präklinischen Studien zu Arthrose wurde die Krankheit chirurgisch induziert und die Studien wurden mit Teenager-Mäusen durchgeführt. Das muss man immer im Hinterkopf haben, wenn man solche Studien interpretiert.“ Die Ergebnisse von Studien mit Teenager-Mäusen lassen sich nicht ohne Weiteres auf klinische Studien mit erwachsenen Menschen übertragen.
2012 fand Loeser mit seinem Team heraus, dass sich die Genexpression in Gelenkgeweben im Laufe der Entwicklung einer Arthrose unterscheidet.4 Er hatte die Genexpression von 12 Wochen alten Mäusen mit jener von einjährigen Mäusen verglichen. Getestet wurde die Genexpression noch mit Microarrays, es war vor der Zeit der Gensequenzierung. Die Arthrose wurde chirurgisch induziert, indem der mediale Meniskus destabilisiert wurde – ein gängiges Modell für die Arthroseforschung mit Mäusen. Diese Methode wird „destabilization of the medial meniscus“ (DMM) genannt. Ältere Mäuse erlitten einen größeren Schaden im Gelenk. Bei den operierten Mäusen zeigten 55 Gene ein ähnliches Expressionsmuster wie bei den Mäusen mit Sham-Operation. 439 Gene zeigten bei den älteren Mäusen ein anderes Expressionsmuster als bei jüngeren, der größte Teil der Gene wurde höher exprimiert. Diese Gene spielten eine Rolle bei der Struktur der Muskeln, der Entwicklung und der Immunantwort. Mäuse, die mit einer Sham-Operation behandelt wurden, zeigten einen altersabhängigen Rückgang der Expression von Genen, die im Matrixaufbau involviert sind, und eine Zunahme der Expression von Genen, die bei der Immunabwehr eine Rolle spielen. „Wenn man bei der Arthrose ein spezielles Gen untersucht, bekommt man womöglich ein völlig anderes Ergebnis, wenn man es bei einer jungen oder bei einer älteren Maus analysiert, und das beim gleichen DMM-Arthrosemodell. Wenn man Studien zu Arthrose macht, hat das Alter der Modelltiere einen großen Einfluss auf die Ergebnisse“, betonte Loeser.
Zellseneszenz als natürliche Antwort auf Stressoren
Es gibt einige typische Merkmale des Alterns und ihre Verbindung zur Arthrose, was wiederholt in Studien gezeigt wurde. Loeser hat kürzlich diese Charakteristika und die zugrunde liegende Evidenz gemeinsam mit seinem Kollegen Dr. Brian Diekman in einer informativen Übersichtsarbeit zusammengefasst.5 Ursprünglich waren es neun typische Merkmale, im Jahr 2022 wurden sie auf 13 erweitert.
Im Laufe des Alterungsprozesses kommt es zu charakteristischen Veränderungen, die zur zellulären Seneszenz führen und in Arthrose resultieren können. Diese erstbeschriebenen neun Merkmale sind: genomische Instabilität, Telomer-Abnutzung, mitochondriale Dysfunktion, deaktivierte Makroautophagie, Verlust der Proteostase (Aufrechterhaltung der Zellgesundheit, indem Produktion, Faltung, Transport und Abbau von Proteinen geregelt werden), Dysbiose, epigenetische Veränderungen, Stammzellerschöpfung und dysregulierte Nährstoff-Signale. Diese Kennzeichen seien nicht bloß korrelativ mit einer Arthrose verbunden, schreiben Diekman und Loeser in ihrem Review, sondern seien fundamentale Veränderungen, die die Wahrscheinlichkeit erhöhen, dass sich eine Arthrose entwickelt und dass sie dann voranschreitet. Die Kennzeichen stehen untereinander in Verbindung, und die Zellseneszenz und der sogenannte „senescence-associated secretory phenotype“ (SASP) dienen als zentraler Mediator, der dann über weitere Mechanismen wie chronische Entzündung und veränderte interzelluläre Kommunikation die Arthrose auslöst.
Zellseneszenz ist eine natürliche Antwort auf Stressoren wie Dysfunktion der Telomere, Schaden an der DNA, Aktivierung von Onkogenen und persistierenden Zellstress inklusive oxidativen Stresses. Zellseneszenz ist charakterisiert dadurch, dass die Zellproliferation angehalten wird und dass der SASP induziert wird. Der SASP enthält eine Reihe proinflammatorischer Zytokine und Matrix-degradierender Enzyme, die sich bei Arthrose in den betroffenen Gelenken nachweisen lassen und die direkt zur Pathogenese der Erkrankung beitragen. Zellseneszenz hat diverse Aufgaben im Körper: Sie spielt eine Rolle bei der Entwicklung der Gewebe während der Embryogenese, für die Reparatur von Gewebe während der Wundheilung und unterdrückt die Tumorentstehung, indem die Vermehrung beschädigter Zellen verhindert wird. Zellen mit DNA-Schaden, die sich zu Krebs entwickeln könnten, werden seneszent. Problematisch wird es, wenn sich zu viele seneszente Zellen ansammeln. Dies lässt sich bei diversen Krankheiten beobachten, die mit dem Alter verbunden sind, wie Atherosklerose, Sarkopenie, Makuladegeneration, Osteoporose, Arthrose und rheumatoide Arthritis. Die seneszenten Zellen haben hochregulierte Signalwege, die ihr Überleben sichern. Das ist unter anderem der Phosphatidylinositol-3-Kinase(PI3K)/AKT-Signalweg, p53-assoziierte Pfade.6 „Seneszente Zellen sind schwieriger zu töten als nicht seneszente Zellen“, schloss Loeser. Und genau hier setzen neue Wirkstoffe an: Die sogenannten Senolytika sollen gezielt seneszente Zellen töten, und zwar indem sie spezifisch „Überlebens-Proteine“ blockieren, die in den seneszenten Zellen hochreguliert sind.
Zellseneszenz als neues Therapieziel
Die SenNet Biomarkers Working Group unter Leitung von Prof. Nicola Neretti (Brown University, USA) hat erstmals zentrale Signalwege und Marker seneszenter Zellen zusammengefasst und Empfehlungen zur Detektion in unterschiedlichen Geweben formuliert. Diese Arbeit wurde im Dezember 2023 in Nature Reviews Molecular Cell Biology veröffentlicht. Seneszente Zellen sind gekennzeichnet durch fehlende Proliferation und Hochregulierung antiapoptotischer Signalwege. Sie sezernieren eine Vielzahl von Chemokinen, Zytokinen, Wachstumsfaktoren und Proteasen, die als der oben erwähnte SASP zusammengefasst werden. Charakteristische Kennzeichen von zellulärer Seneszenz sind darüber hinaus Veränderungen in der Chromatin-Architektur, metabolische Anpassungen, Akkumulation von beschädigten Makromolekülen und genetische Instabilität. Einzelne Merkmale reichen nicht aus, um Zellen als seneszent zu definieren. Sie können auch in Zellen in anderen Situationen nachgewiesen werden. Eine Rolle spielt zudem die Gewebeart. Es braucht also das Vorhandensein von mehreren Kennzeichen. Loeser fasste die neun Kennzeichen der Zellseneszenz aus dem Review der SenNet Biomarkers Working Group zusammen: erstens Stopp des Zellzyklus. Marker hierfür sind unter anderem p53, p21, p16, MKI67 und RB, aber diese sind nicht spezifisch für seneszente Zellen; sie kommen auch in anderen Situationen mit Stopp des Zellzyklus vor. Zweitens DNA-Schaden – Marker hierfür sind γH2AX und Verlust von Lamin B1. Drittens Veränderungen im Zellkern, etwa an den Histonen. Viertens Hochregulierung antiapoptotischer Signalwege, fünftens Aktivierung von SASP und sechstens Zunahme des Inhaltes der Lysosomen – Letztere werde häufig als Marker für Seneszenz verwendet, und zwar durch Bestimmung von β-gal, berichtete Loeser. „Das ist aber nicht sehr verlässlich, vor allem nicht in Zellkulturen.“ Kennzeichen sieben sind metabolische Anpassungen, etwa in den Mitochondrien, achtens Hochregulierung bestimmter Oberflächenmarker der Zellen und neuntens Veränderungen in der Zellmorphologie; sie werden größer und „eiförmiger“. β-gal wurde auch als Marker seneszenter Zellen bei Arthrose eingesetzt. Vor allem in den früheren Arbeiten sei aber die Anzahl seneszenter Zellen im Knorpel überschätzt worden, so Loeser, und die hohen Prozentangaben konnten nie reproduziert werden. Der Anteil seneszenter Zellen lege etwa bei 5–10%. Wenige seneszente Zellen würden aber ausreichen, um Faktoren zu produzieren, die altersabhängige Krankheiten verursachen. Mit seiner Arbeitsgruppe hatte Loeser 2018 den Marker p16 bei Arthrose untersucht.7Sie fanden heraus, dass p16 ein Biomarker für das Altern der Chondrozyten ist, aber dass es nicht die Arthrose verursacht. Arthrose entsteht wahrscheinlich durch die SASP-Faktoren, die durch die seneszenten Zellen im Gelenk hergestellt werden.
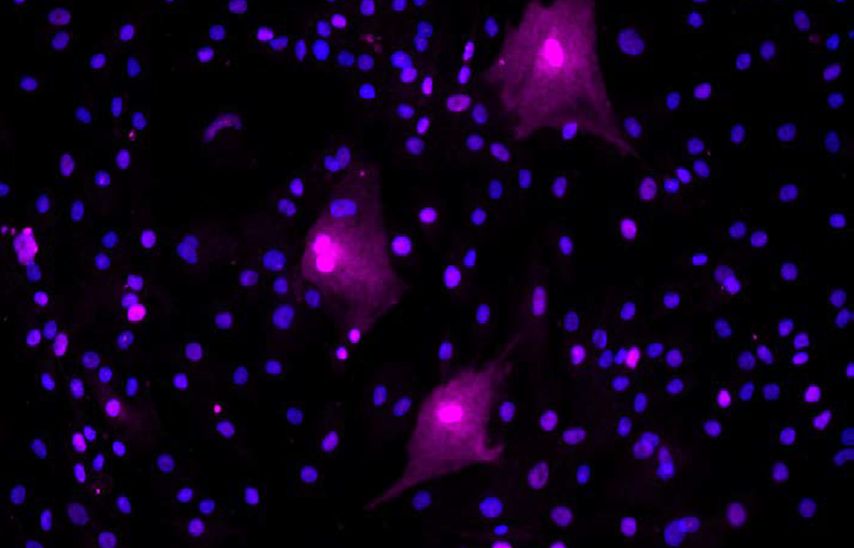
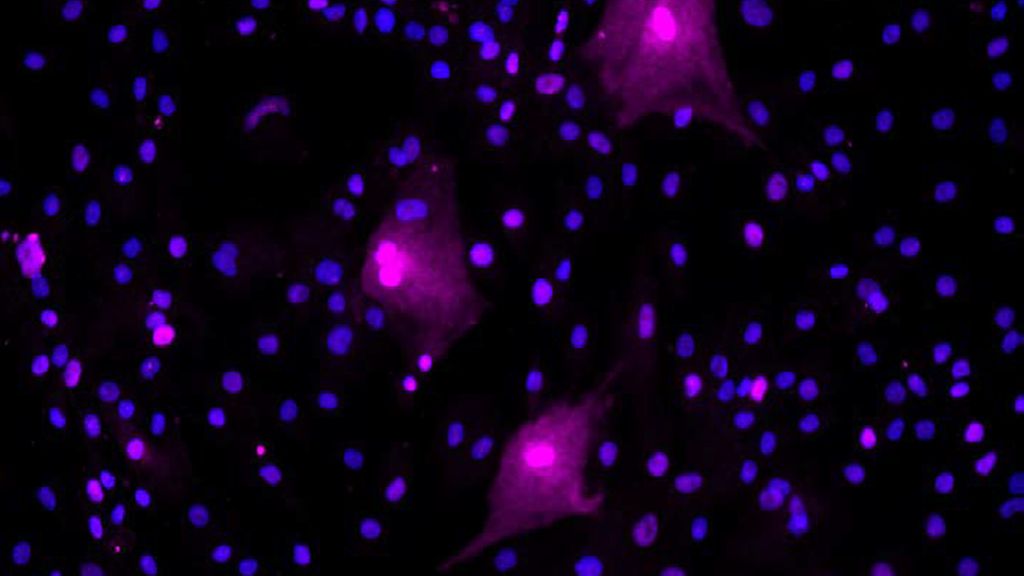
Ein chinesisches Team untersuchte seneszente Zellen in der Synovia von Arthrosepatienten anhand verschiedener Marker.8 Auch sie fanden erhöhte Spiegel von p16 bei Patienten mit Arthrose im Vergleich zu Kontrollpatienten. In der Immunhistochemie zeigte sich aber eine Doppel-Färbung mit Vimentin, was ein Marker für Fibroblasten-ähnliche Synoviazellen ist. „Viele der p16-positiven Zellen waren seneszente, synoviale Fibroblasten“, sagte Loeser (Abb. 1). Auch im Knochengewebe lassen sich bestimmte Marker für Zellseneszenz nachweisen, was eine Rolle spielt im Zusammenhang mit altersbedingten Knochenkrankheiten wie Osteoporose. Fett – so eingangs erwähnt im Zusammenhang mit Adipositas als Risikofaktor für Arthrose – ist ebenfalls ein Ort seneszenter Zellen, was erklären kann, warum adipöse Menschen ein erhöhtes Risiko h1en. Im Fettgewebe finden sich seneszente Zellen vor allem unter den Präadipozyten. Diese produzieren eine Vielzahl von Chemokinen und Zytokinen, die zur Entzündung im Fettgewebe beitragen.
Abb. 1: Seneszente synoviale Fibroblasten aus menschlicher arthrotischer Synovia. Die Fibroblasten wurden mit einem Antikörper gegen p16 immungefärbt, um seneszente Zellen zu detektieren. Diese erscheinen hier in der Immunfluoreszenz pink. Mit DAPI wurden die Zellkerne gefärbt, die sich blau darstellen. Die pinken, seneszenten Zellen zeigen das typische „Spiegelei“-Aussehen. Das Foto wurde zur Verfügung gestellt vom Labor von R. Loeser, Thurston Arthritis Research Center, The University of North Carolina
Senolytika: Zukunft der Arthrosetherapie?
Zellseneszenz, so lässt sich aus der bisherigen Forschung schließen, scheint eine entscheidende Rolle bei der Entwicklung einer Arthrose zu spielen. Senolytika könnten hier eingreifen, indem sie den selektiven Zelltod fördern und verhindern, dass seneszente Zellen akkumulieren. Senolytika inhibieren typischerweise Proteine, die in den seneszenten Zellen hochreguliert sind. Sterben die seneszenten Zellen, wird die Produktion von Faktoren aus dem SASP gestoppt und damit werden die Signalwege blockiert, die maßgeblich zur Arthrose beitragen. Es gibt einige Ansätze mit Senolytika, die zum Teil schon in klinischen Studien getestet werden. Das ist beispielsweise UBX0101, das die Interaktion zwischen p53 und MDM2 blockiert und damit p53 erlaubt, die Apoptose zu induzieren. Oder Fisetin, ein Flavonoid, das mit den Zellüberlebens-Signalwegen interferiert. Weitere Senolytika greifen an BCL-2-Proteinen, PI3K oder BCR-ABL an. Sogenannte Senomorphika gehen gezielt Faktoren an, die der SASP produziert. Getestet werden etwa Antikörper gegen IL-1, IL-6-Rezeptor, IL-17 oder TNF. In Tieren zeigte sich bei diesen Substanzen zum Teil eine Reduktion der Arthrose und von Schmerzen, valide Ergebnisse beim Menschen stehen aber noch aus. Nachlesen lassen sich diese neuen Ansätze in zwei weiteren Reviews von Loesers Arbeitsgruppe.9,10
Loesers Fazit: „Arthrose ist ein komplexes heterogenes Krankheitsbild. Es ist eine Vielzahl von inflammatorischen Mediatoren und Matrix-degradierenden Enzymen involviert und es gibt vermutlich verschiedene Endotypen, die man berücksichtigen muss.“ Die altersbedingten Veränderungen manifestieren sich sowohl systemisch als auch lokal. Der SASP und die von ihm ausgeschütteten Faktoren scheinen eine Schlüsselrolle zu spielen. „Wie wir das gezielt angehen, müssen wir lernen, und die Frage ist: Was ist unser Ziel? Wann beginnen wir die Therapie, wann stoppen wir sie und woher wissen wir, ob sie wirkt oder nicht? Wir haben noch viel zu erforschen, aber die bisherigen Ergebnisse zeigen großes Potenzial für die künftige Behandlung der Arthrose.“
Quelle:
„Inflammaging and cellular senescence in rheumatic and musculoskeletal diseases“, Vortrag von Richard Loeser im Rahmen der Sitzung „Basic and Translational Science“ anlässlich des EULAR 2024
Literatur:
1 Katz JN et al.: JAMA 2021; 325(6): 568-78 2 Losina E et al.: Arthritis Care Res (Hoboken) 2013; 65(5): 703-11 3 Flurkey K et al.: In: American College of Laboratory Animal Medicine. Second Edition. Academic Press, 2007. 637-72 4 Loeser RF et al.: Arthritis Rheum 2012; 64(3): 705-17 5Diekman BO, Loeser RF: Osteoarthritis Cartilage 2024; 32(4): 365-71 6 Suryadevara V et al.: Nat Rev Mol Cell Biol 2024; 25(12): 1001-23 7 Diekman BO et al.: Aging Cell 2018; 17(4): e12771 8 Chen X et al.: Ann Rheum Dis 2022; 81: 85-97 9 Coryell PR et al.: Nat Rev Rheumatol 2021; 17(1): 47-57 10 Astrike-Davis EM et al.: Curr Opin Pharmacol 2022; 64: 102213
Das könnte Sie auch interessieren:
Fertilität und Schwangerschaft bei entzündlicher Arthritis
Auf der 13. International Conference on Reproduction, Pregnancy and Rheumatic Diseases (RheumaPreg 2025) in Wien präsentierte Prof. Dr. Radboud Dolhain (Rotterdam, NL) aktuelle ...
So beeinflusst die Menopause rheumatische Erkrankungen
Die Menopause stellt für Patientinnen mit rheumatischen Erkrankungen eine besondere Herausforderung dar. Durch den Östrogenmangel kommt es nicht nur zu typischen Wechseljahresbeschwerden ...
Therapieauswahl nach pulmonalem Inflammations- und Fibrosemuster
Da Fibrose und Entzündung in unterschiedlichem Ausmaß zu Lungenbeteiligungen bei rheumatologischen Erkrankungen beitragen, werden im klinischen Alltag Methoden gebraucht, um beide ...