Neue Ansätze bei rheumatoider Arthritis
Bericht:
Ines Schulz-Hanke
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
SGLT2-Inhibitoren sind mittlerweile nicht nur für Typ-2-Diabetes, sondernauch für weitere Entitäten zugelassen und zeigen gute Nebeneffekte auf die Leber sowie bei Adipositas. In diesem Rahmen können auch Menschen mit rheumatologischen Erkrankungen von ihnen profitieren.
Die individuelle Patientensituation und die Komorbiditäten in der Rheumatologie seien komplex, erklärte Dr. Oana Patricia Zaharia, Düsseldorf, bei ihrem Vortrag am letztjährigen Kongress der DGRh. Entsprechend müsse man den potenziellen Nutzen, den SGLT2-Inhibitoren hier haben könnten, für die Organe einzeln betrachten. Wo rheumatologische Patientinnen und Patienten konkret von ihnen profitieren können, zeigte Zaharia für Nieren, Herz und Leber sowie für Adipositas.
Benefit bei Lupus und Lupusnephritis
In den Nieren ist die Aktivität der SGLT2-Inhibitoren in den proximalen Tubuli zu sehen. Hier werden Glukose- und Natriumexkretion gesteigert, wodurch es zu einer vermehrten Diurese kommt. Der intraglomeruläre Druck sinkt, auch das RAAS (Renin-Angiotensin-Aldosteron-System) wird dadurch beeinflusst, und es kommt zu positiven Effekten auf die Herzaktion.1 Aufgrund dieser positiven Effekte in der Niere sei spekuliert worden, ob sich SGLT2-Inhibitoren auch auf die Nierenbeteiligung bei rheumatologischen Erkrankungen günstig auswirken, erklärte Zaharia. Wie eine aktuelle Übersichtsarbeit gezeigt hat, verbessern SGLT2-Inhibitoren die Proteinausscheidung bei Lupusnephritis signifikant, obwohl die berücksichtigten Studien mit kleinen Fallzahlen gearbeitet haben. In manchen Studien konnte sogar die Prednisolon-Dosis reduziert werden, z.B. bei Lupus und Lupusnephritis mit stabiler GFR.2 In weiteren Studien und Metaanalysen haben sich durch die Gabe von SGLT2-Inhibitoren das Risiko für Lupusnephritis, Herzinsuffizienz, Dialyse und Nierentransplantation sowie die Gesamtmortalität bei Patientinnen und Patienten mit systemischem Lupus erythematodes (SLE) und Typ-2-Diabetes reduzieren lassen.3 Dies bedeute letzten Endes, dass es – auch wenn die Zulassung nicht speziell auf die rheumatologische Erkrankung ausgelegt sei – einen potenziellen Benefit für Patienten mit Lupusnephritis gebe, schloss Zaharia.
Herzinsuffizienz: mehr Mut zur Verschreibung
Auf das Herz wirken sich SGLT2-Inhibitoren sowohl direkt als auch indirekt aus. Durch die Steigerung der Diurese werden das Volumen und damit die Herzbelastung reduziert. Zudem wird die Erythropoetin-Freisetzung gesteigert, was auch die Anämie bei der chronischen Erkrankung potenziell dämpfen kann. Darüber hinaus steigern SGLT2-Inhibitoren die Ketone, die als Energiesubstrat für die Herzaktion dienen können, und der Blutdruck sinkt. Auf molekularer Ebene hat dies auch mit den Natrium-Wasserstoff-Austauschern (NHE) 1 und 3 zu tun, die den oxidativen Stress redu-zieren.1
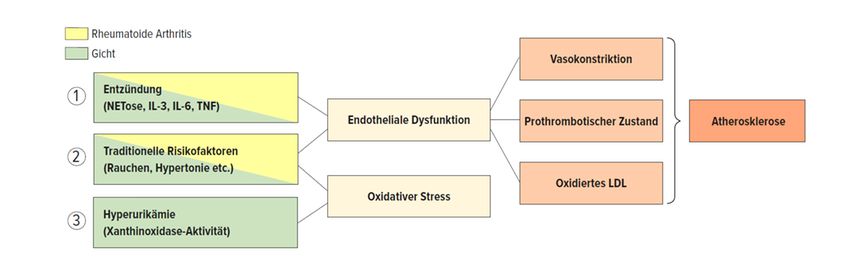
Rheumatologische und Herzerkrankungen haben verschiedene pathogenetische Mechanismen gemein. Man müsse also fragen, welche davon dazu führten, dass Menschen mit rheumatologischen Erkrankungen kardiale Komplikationen entwickeln. Einer der wichtigsten davon sei die Inflammation, außerdem spielten Komorbiditäten wie Hypertonie, oxidativer Stress und endotheliale Dysfunktion eine Rolle, so Zaharia weiter. Man habe daher vermutet, dass Patientinnen und Patienten mit einem erhöhten Risiko für Herzinsuffizienz von SGLT2-Inhibitoren profitieren könnten. Tatsächlich ist in den vergangenen 10 Jahren eine Reihe von Studien durchgeführt worden, die einen Nutzen für SGLT2-Inhibitoren belegt haben: Insgesamt ließ sich systematisch und klassenübergreifend zeigen, dass unter der Gabe von SGLT2-Inhibitoren bei Patientinnen und Patienten mit und ohne Typ-2-Diabetes positive Effekte auf Nieren- und Herzgesundheit zu erwarten sind. Aus den Einschlusskriterien der Studien lasse sich ableiten, dass SGLT2-Inhibitoren auch eingesetzt werden dürfen, wenn die geschätzte glomeruläre Filtrationsrate (eGFR) niedrig sei, und zwar unabhängig davon, ob ein Typ-2-Diabetes vorliege oder nicht, erklärte Zaharia.5
Zur Therapie einer Herzinsuffizienz mit reduzierter Ejektionsfraktion (HFrEF) stehen also nicht mehr nur ACE/AT1-Inhibitoren (seit 2017 ARNI), Betablocker und Aldosteron-Antagonisten zur Verfügung. Die SGLT2-Inhibitoren ergänzen diese „drei Musketiere“ zu den „fantastic four“. Seit 2021 sollten leitliniengerecht SGLT2-Inhibitoren bei HFrEF eingesetzt werden. Für die Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF) ist allerdings lange keine Medikation mit belegter Wirksamkeit zur Verfügung gestanden. Seit 2022 sind die SGLT2-Inhibitoren hier als einzige Medikamentenklasse zugelassen.
Zaharia ermutigte dazu, bei der Verschreibung der SGLT2-Inhibitoren weniger zurückhaltend zu sein. Sie stellte fest, dass viele Patientinnen und Patienten Antihypertensiva oder Statine erhalten, obwohl deren „number needed to treat“ (NNT) deutlich höher ist als die der SGLT2-Inhibitoren. Besonders Empagliflozin zeichnet sich durch eine niedrige NNT für die Reduktion der Mortalität aus.
Abb. 1: Rheumatologische und Herzerkrankungen haben verschiedene pathogenetische Mechanismen gemein. Mod. nach Hansildaar R et al.4
Die Leber kriegt ihr Fett weg
Die mit metabolischer Dysfunktion assoziierte steatotische Lebererkrankung (MASDL; früher: nicht alkoholische Fettlebererkrankung, NAFLD) sei nicht nur in der Diabetologie relevant, sondern auch bei rheumatologischen Erkrankungen, wie aus Assoziationsstudien abzuleiten sei, ging Zaharia zur nächsten Entität weiter. Vor wenigen Jahren habe sie selbst in einer multizentrischen Studie zeigen können, dass unter einer Empagliflozin-Therapie über 6 Monate der Leberfettgehalt gegenüber Placebo sinkt.6 Dies hängt auch mit der Gewichtsreduktion zusammen (3% vs. 0%), dennoch war der Effekt unabhängig vom HbA1c-Wert, es stand also nicht die glykämische Kontrolle im Vordergrund. Daraufhin überprüfte Zaharias Arbeitsgruppe weitere Faktoren überprüft. Verantwortlich waren nicht – wie zunächst vermutet – Insulinresistenz und Insulinsensitivität, für die sich keine markanten Unterschiede vor und nach Behandlung hatten feststellen lassen. Tatsächlich steigert die Einnahme von SGLT2-Inhibitoren die Harnsäureexkretion und reduziert Entzündung und oxidativen Stress. Zusammengenommen führte dies dazu, dass die Lipidoxidation stieg und die Lipogenese sank – und somit auch die Steatose.7, 8
Dass die SGLT2-Inhibitoren klassenübergreifend die Harnsäureexkretion günstig beeinflussen und somit in der Prävention von Gichtanfällen eine Rolle spielen können, hat sich in mehreren Studien und Metaanalysen bestätigt. Für diese Indikation seien die SGLT2-Inhibitoren zwar nicht explizit zugelassen, doch könne dies ein schöner Nebeneffekt sein, so Zaharia.9 In anderen Studien sind SGLT2-Inhibitoren auch im Vergleich zu GLP-1-Rezeptor-Agonisten untersucht worden. Diese werden angesichts der herrschenden Adipositas-Pandemie häufig verschrieben, weil sie das Gewicht reduzieren. Man müsse also abwägen, wem man welche Medikamentenklasse verschreibe, folgerte die Referentin.
Adipositas: Evidenz hat hier weniger Gewicht
Die Zusammenhänge zwischen Typ-2-Diabetes, Adipositas und Gelenkerkrankungen sind komplex. Als beeinflussende Faktoren nannte Zaharia Hyperglykämie, Polyneuropathie sowie die ektope Lipiddeposition in Muskeln und Leber. Außerdem bestehen bei Diabetes und Gelenkerkrankungen oxidativer Stress und eine subklinische Inflammation. Zudem führt Adipositas zu physischer Inaktivität und Mobilitätseinschränkung. Die Inflammation befördert muskuläre Atrophie oder sogar Sarkopenie zusätzlich.10 In einer Assoziationsstudie ließ sich zeigen, dass Typ-2-Diabetes den Verlauf von Gelenkerkrankungen verschlechtert und zu einer deutlich stärker eingeschränkten Gelenkmobilität beiträgt. Daher wurde untersucht, ob sich anhand eines spezifischen microRNA-Profils vorhersagen lässt, welche Patientinnen und Patienten Gelenkerkrankungen entwickeln und in welchem Ausmaß. Dies war jedoch nicht möglich. In der Studie wurden zwar bestimmte Osteoarthritis-assoziierte microRNAs bei Typ-2-Diabetes stärker exprimiert als bei normaler Glukosetoleranz. Insgesamt wurden diese microRNAs jedoch bei Betroffenen mit Osteoarthritis schwächer exprimiert als bei jenen ohne. Dies bedeutet, dass Typ-2-Diabetes die Veränderungen in Arthritis-assoziierten microRNA-Profilen maskieren kann. Es gibt deshalb derzeit keine validen prognostischen Marker für Menschen, die gleichzeitig an Typ-2-Diabetes und einer rheumatologischen Erkrankung leiden.10 Bei dieser Patient:innengruppe könne man jedoch auf bewährte Maßnahmen zurückgreifen, nämlich: Senkung der Glykämie und Erreichen des Normalgewichts, so Zaharias Empfehlung. Auch hierfür sind die SGLT2- Inhibitoren geeignet. Zwar ist hier die Gewichtsreduktion mit durchschnittlich 3% vs. 15% geringer als unter GLP-1-Rezeptor-Agonisten. Die Senkung des HbA1c-Wertes ist jedoch unter beiden Wirkstoffklassen vergleichbar, weshalb man positive Effekte hinsichtlich der rheumatologischen und der diabetologischen Erkrankung erwarten kann.11, 12
Quelle:
„SGLT2-Inhibitoren: Nutzen über die Diabetologie hinaus. Benefit auch bei rheumatologischen Erkrankungen?“, Vortrag von Dr. Oana Patricia Zaharia, Düsseldorf, im Rahmen der Session „Neue Arzneimittel/Indikationen am Horizont. – Was muss ich in der Rheumatologie wissen über …“, anlässlich des DGRh-Kongresses 2024
Literatur:
1 Braunwald E: N Engl J Med 2022; 386: 2024-34 2 Chakrabarti K et al.: Curr Opin Rheumatol 2024; 36: 351-9 3 Yen FS et al.: JAMA Netw Open 2024; doi:10.1001/jamanetworkopen 2024; 16578 4 Hansildaar R et al.: Lancet Rheumatol 2020; doi: 10.1016/S2665-9913(20)30221-6 5 Davies M et al.: Cardiovasc Diabetol 2022; doi: 10.1186/s12933-022-01575-9 6 Kahl S et al.: Diabetes Care 2020; 43(2): 298-305 7 Baldwin W et al.: Diabetes 2011; 60: 1258-69 8 Stern J et al.: Cell Metab 2016; doi: 10.1016/ j.cmet. 2016.04.011 9 Somagutta MKR et al.: Discoveries 2022; doi: 10.15190/d.2022.11 10 Zaharia OP et al.: J Clin Endocrinol Metabol 2021; 106: 1062-73 11 Nauck MA et al.: Diabetes Care 2011; 34: 2015-22 12 Gurgle HE et al.: Vascular Health and Risk Management 2016; 12: 239-49
Das könnte Sie auch interessieren:
Neue Therapieansätze für Arthrose
Dass Zellen altern, könnte eine entscheidende Rolle bei der Entstehung von Arthrose spielen. Welche Mechanismen dahinterstecken und welche Ansätze sich für neue Therapien ergeben, ...
Fertilität und Schwangerschaft bei entzündlicher Arthritis
Auf der 13. International Conference on Reproduction, Pregnancy and Rheumatic Diseases (RheumaPreg 2025) in Wien präsentierte Prof. Dr. Radboud Dolhain (Rotterdam, NL) aktuelle ...
So beeinflusst die Menopause rheumatische Erkrankungen
Die Menopause stellt für Patientinnen mit rheumatischen Erkrankungen eine besondere Herausforderung dar. Durch den Östrogenmangel kommt es nicht nur zu typischen Wechseljahresbeschwerden ...