Le suivi thérapeutique des médicaments en neuropsycho- pharmacologie: de la théorie à la routine clinique
Auteurs:
Prof. Dr méd. Georgios Schoretsanitis, PhD1–4
Dr méd. Maxim Kuzin5
1 Unit of Pharmacogenetics and Clinical Psychopharmacology, Centre de neurosciences psychiatriques, Centre hospitalier universitaire vaudois (CHUV), Université de Lausanne
2 Psychiatrische Universitätsklinik Zürich
3 The Zucker Hillside Hospital, Department of Psychiatry Research, Northwell Health, Glen Oaks, New York, USA
4 Department of Psychiatry, Zucker School of Medicine at Hofstra/Northwell, Hempstead, NY, USA
5 Oberberg Fachklinik Rhein-Jura, Privatklinik für Psychiatrie, Psychosomatik und Psychotherapie
Bad Säckingen
Auteur correspondant:
Prof. Dr méd. Georgios Schoretsanitis, PhD
E-mail: george.schor@gmail.com
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Le suivi thérapeutique des médicaments relie la pharmacocinétique appliquée à la pratique clinique et constitue ainsi un outil précieux de la médecine de précision. L’absorption, la distribution, la métabolisation et l’excrétion sont des phases essentielles de la pharmacocinétique, d’une grande importance clinique, et déterminantes pour l’évolution des concentrations des substances actives. Un dosage adapté à chaque individu améliore non seulement l’efficacité du traitement psychopharmacologique, mais augmente également la sécurité médicamenteuse.
Keypoints
-
Le TDM n’est pas un luxe, mais un outil clinique précieux; il constitue un standard, en particulier pour les psychotropes à fenêtre thérapeutique étroite (par ex. lithium, clozapine).
-
Pensez au TDM face à toute situation clinique complexe: polypharmacie, troubles de la fonction rénale ou hépatique, réponse thérapeutique incertaine ou suspicion de problèmes d’adhérence.
-
Dans le contexte clinique, une évaluation fondée du traitement psychopharmacologique nécessite l’intégration de deux approches centrales: le TDM et l’évaluation psychopathologique longitudinale.
Suivi thérapeutique des médicaments
Le suivi thérapeutique des médicaments (therapeutic drug monitoring, TDM )s’intéresse à la mesure des substances médicamenteuses dans les fluides corporels, le plus souvent dans le plasma sanguin ou le sérum. La précision de la mesure des concentrations est influencée par différents facteurs, tels que le moment du prélèvement sanguin et de l’administration, l’état d’équilibre (steady state) ou la demi-vie du médicament. Les concentrations mesurées permettent une adaptation individualisée de la dose quotidienne, afin d’obtenir un effet thérapeutique optimal. Ainsi, le TDM est un précurseur de la médecine personnalisée, dont fait également partie la pharmacogénétique. En outre, le TDM est solidement ancré dans de nombreuses lignes directrices, par exemple dans la ligne directrice nationale de soins pour la dépression unipolaire1 ou la ligne directrice S3 sur la schizophrénie.2 Actuellement, jusqu’à 50% des patient·es ne répondent pas suffisamment aux psychotropes3; le TDM peut alors apporter une aide déterminante.
Concept de la «zone thérapeutique de référence»
L’objectif de la thérapie psychopharmacologique guidée par le TDM est d’atteindre, pour chaque médicament, la zone thérapeutique de référence individuelle. Dans cette zone, les patient·es présentent la probabilité la plus élevée de bénéficier du traitement psychopharmacologique et, idéalement, de se rapprocher de la rémission complète des symptômes. Pour chaque médicament, il existe une zone thérapeutique de référence basée sur des données populationnelles, servant d’outil d’orientation pour l’adaptation individuelle des doses. Nettement en dessous de la limite inférieure définie de la zone thérapeutique de référence (subthérapeutique), une réponse thérapeutique au traitement psychopharmacologique initié est improbable. Des concentrations supérieures à la limite supérieure définie, ou des taux suprathérapeutiques, sont associés à une probabilité accrue d’effets indésirables, une amélioration clinique supplémentaire étant peu probable. L’intervalle de référence toxique correspond à des concentrations supérieures au double de la limite supérieure de la zone thérapeutique de référence, à l’exception de certains médicaments présentant un profil de sécurité moins favorable, pour lesquels cet intervalle de référence toxique est plus bas, comme par exemple la clozapine. Lorsque cet intervalle est atteint, une réduction de la dose doit être envisagée, en particulier en cas d’apparition d’effets indésirables.
La zone thérapeutique de référence sert d’outil d’orientation dans le contexte clinique et ne s’applique pas de manière illimitée à tous·tes les patient·es. Dans le contexte clinique, une évaluation fondée nécessite l’intégration d’au moins deux approches, à savoir le TDM et l’évaluation longitudinale de la psychopathologie. Il est également possible que certain·es patient·es présentent une réponse thérapeutique optimale en dehors de la zone thérapeutique de référence.4 La corrélation avec l’effet clinique permet de déduire un profil de TDM individualisé pour le traitement psychopharmacologique.
Les lignes directrices consensuelles relatives au TDM en neuropsychopharmacologie existent depuis plus de vingt ans.4-6 Jusqu’à il y a quelques années, l’algorithme de définition de la zone thérapeutique de référence n’était pas établi. L’approche systématique tenant compte des lignes directrices PRISMA («preferred reporting items for systematic reviews and meta-analyses») a été publiée en 20217 et a déjà été appliquée dans de nouvelles publications sur les zones thérapeutiques de référence, notamment pour l’escitalopram8 et l’aripiprazole.9
Le rôle de la pharmacocinétique: exemples pratiques
La pharmacocinétique décrit les processus par lesquels l’organisme interagit avec une substance médicamenteuse10, de l’administration jusqu’à l’élimination. Les phases de cette interaction sont regroupées sous l’abréviation (L)ADME, correspondant à l’absorption, la distribution, la métabolisation et l’excrétion. La libération, également appelée relargage (dynamique de libération constante vs. non constante), est souvent considérée comme l’étape initiale de la pharmacocinétique. À des fins de clarté, les premières phases (L, A et D) sont regroupées sous le terme «d’afflux», et les deux dernières phases (M et E) sous celui d’«efflux».
L’hétérogénéité interindividuelle marquée de ces quatre processus est influencée par divers facteurs. Ceux-ci incluent notamment l’âge, le sexe, les comorbidités, la grossesse, le génotype pharmacocinétique, l’adhérence, les interactions médicamenteuses, les habitudes alimentaires et la consommation de tabac.4
Il peut donc être nécessaire, au cours du traitement, d’adapter la médication psychopharmacologique existante, par exemple en cas d’interactions médicamenteuses. Le risque d’interactions médicamenteuses augmente avec le nombre de médicaments prescrits. La prise en charge de patient·es en situation de polypharmacie, définie le plus souvent comme la prise simultanée d’au moins cinq médicaments différents, représente fréquemment un défi dans les soins cliniques.11
Absorption
Pourquoi la prise avec le repas est déterminante
Après la libération, l’absorption a lieu, débutant le plus souvent dans le tractus gastro-intestinal. Pour les comprimés orodispersibles disponibles (par ex. olanzapine, lorazépam), l’absorption s’effectue déjà au niveau de la muqueuse buccale. La vitesse et l’étendue de l’absorption d’une substance active sont déterminées par la biodisponibilité. Celle-ci correspond au pourcentage de substance non modifiée atteignant la circulation systémique et varie entre 5% et 100%.4 La biodisponibilité peut être influencée par différents facteurs, tels que des consignes spécifiques de prise avec les repas ou par conditions anatomiques modifiées.
Dans le cas de la lurasidone, un antipsychotique atypique, il est par exemple recommandé de la prendre avec un repas (au moins 350 kcal)12 afin d’augmenter significativement sa faible biodisponibilité de 9 à 19%.13 L’augmentation de la biodisponibilité orale lors de la prise concomitante d’aliments est attribuable à différents facteurs, notamment un ralentissement de la vidange gastrique, une diminution de la clairance hépatique, des modifications du pH gastrique ainsi qu’une augmentation du flux biliaire.14
Pourquoi le traitement psychopharmacologique des patient·es bariatriques peut représenter un défi
Des modifications de la physiologie ou de l’anatomie du tractus gastro-intestinal, par exemple après une chirurgie bariatrique, peuvent influencer de manière significative la biodisponibilité des médicaments, ces effets étant souvent imprévisibles. Malgré leur importance clinique, les données concernant le TDM après une chirurgie bariatrique demeurent limitées.15-17 En phase postopératoire, des fluctuations importantes des concentrations plasmatiques peuvent survenir. Ainsi, une diminution marquée des concentrations plasmatiques a été décrite pour l’aripiprazole18, tandis qu’une augmentation significative a été documentée pour le lithium.19 Ces observations soulignent l’importance d’une pharmacovigilance rigoureuse durant la phase postopératoire. Les données actuellement disponibles concernent uniquement certaines substances et ne peuvent pas être extrapolées à d’autres, y compris au sein d’une même classe thérapeutique. Un aperçu détaillé de la pertinence clinique du TDM après une chirurgie bariatrique a été présenté dans le numéro 03/2025 de Leading Opinions Neurologie & Psychiatrie.20
Distribution: lipophilie et liaison aux protéines dans la pratique clinique quotidienne
La distribution correspond à la répartition des psychotropes dans différents tissus de l’organisme. Deux facteurs principaux interviennent: la lipophilie de la substance active et ses propriétés de liaison aux protéines.
La lipophilie d’une substance active décrit sa capacité à être absorbée par des structures riches en lipides. Les propriétés de liaison aux protéines déterminent quant à elles la proportion de substance active présente sous forme libre et donc pharmacologiquement active. Sous forme liée (le plus souvent à l’albumine), les substances actives sont pharmacologiquement inactives et transportées vers leur site d’action. L’affinité résultante du médicament pour les structures tissulaires détermine sa distribution dans l’organisme. Pour les substances lipophiles, il ne s’agit pas seulement d’une répartition uniforme dans les compartiments ou volumes de distribution (tissu adipeux, foie, etc.), mais également d’une accumulation dans certaines structures tissulaires. Le sang est souvent considéré comme le compartiment central. Au cours du processus de distribution, la concentration libre de la substance active dans le plasma s’équilibre avec les concentrations libres dans les autres compartiments.21 Le volume de distribution est un autre paramètre pharmacocinétique décrivant l’étendue de la distribution d’une substance médicamenteuse dans le corps humain. La majorité des psychotropes présentent des volumes de distribution élevés et sont donc principalement fixés dans les tissus. Ainsi, seule une fraction de la dose administrée est présente dans le plasma sous forme libre ou liée.21
Les modifications des compartiments et les variations du statut des protéines plasmatiques peuvent influencer de manière significative l’effet et la disponibilité des psychotropes (voir Rapport de cas: modifications cliniquement pertinentes des concentrations sériques de clozapine après une réduction mammaire).22
Métabolisation: fonction hépatique et interactions médicamenteuses
La grande majorité des psychotropes est métabolisée au niveau hépatique. Les exceptions comprennent notamment les benzamides substitués (sulpiride et amisulpride), le lithium et la mémantine. La métabolisation comprend des réactions de phaseI et de phaseII.
Lors des réactions de phaseI, le médicament subit une modification structurelle par fonctionnalisation chimique. Cette phase est dominée par les mécanismes de biotransformation, conduisant, via le système du cytochrome P-450 (CYP), à la formation de métabolites actifs ou inactifs. Au cours des réactions de phaseII, les métabolites issus de la phaseI sont transformés par conjugaison avec des substances endogènes (acide glucuronique activé, glycine, etc.).21 La phaseI constitue une condition préalable à la phaseII, laquelle est suivie par l’élimination.
Jusqu’à présent, 57 gènes fonctionnels du système P-450 ont été identifiés et classés, sur la base de la structure primaire (séquence d’acides aminés), en 18 familles de gènes CYP (CYP1, CYP2, CYP3, etc.) et 43 sous-familles (CYP1A, CYP2A, CYP2B, etc.). Les interactions médicamenteuses au niveau du CYP peuvent soit augmenter (induction), soit diminuer (inhibition) le métabolisme. Cela peut entraîner une inefficacité du traitement ou la survenue d’effets indésirables, voire d’intoxications. Le TDM permet d’identifier les interactions médicamenteuses potentielles; les adaptations nécessaires au sein d’un traitement psychopharmacologique en cours peuvent ainsi être réalisées rapidement et de manière ciblée (voir Rapport de cas: des interactions médicamenteuses peuvent conduire à des concentrations sériques indétectables de quétiapine en présence de carbamazépine).23
Excrétion: adaptations du traitement en cas d’insuffisance rénale
L’excrétion des psychotropes, sous forme inchangée ou sous forme de métabolites, s’effectue principalement par voie rénale, l’excrétion biliaire jouant un rôle secondaire. L’excrétion rénale constitue l’étape finale du processus d’élimination, initié au niveau hépatique (augmentation de l’hydrophilie, réactions de phaseII).
Le déclin de la fonction rénale lié à l’âge est connu de longue date.24 Les substances actives peuvent ainsi s’accumuler dans l’organisme, ce qui augmente considérablement le risque d’effets indésirables et peut même conduire à des intoxications. Le taux de filtration glomérulaire ainsi que le débit sanguin rénal diminuent progressivement, l’ampleur de ces modifications variant d’une personne à l’autre. La posologie quotidienne doit être adaptée en fonction de la fonction rénale, par exemple pour le lithium, la venlafaxine et la rispéridone. Pour le lithium, il existe également des recommandations détaillées pour le pilotage du traitement pharmacologique.25, 26 En cas de traitement de substitution rénale (dialyse), les données disponibles restent très limitées, notamment concernant les avantages et les inconvénients relatifs des traitements antidépresseurs.27
Indications du TDM
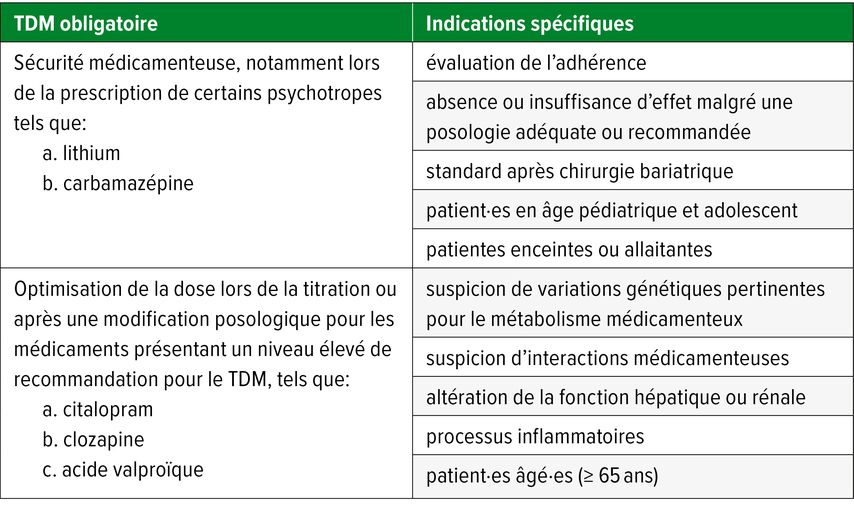
Sur la base de la ligne directrice consensuelle actuelle relative au suivi thérapeutique des médicaments en neuropsychopharmacologie, on distingue un TDM obligatoire et des indications spécifiques à son utilisation.4 Le TDM est considéré comme obligatoire pour le traitement d’un nombre restreint de psychotropes, tels que le lithium ou la carbamazépine, qui présentent une marge thérapeutique étroite. Le TDM est également obligatoire pour l’optimisation posologique lors de la titration ou après une modification de dose pour les médicaments disposant de preuves solides quant à la pertinence du TDM ou d’un niveau élevé de recommandation en faveur du TDM. Dans le cadre d’indications spécifiques, le recours au TDM permet de répondre à de nombreuses questions cliniques, telles que la prévention des rechutes en cas de prise médicamenteuse incertaine ou l’optimisation de la psychopharmacothérapie chez les patientes enceintes ou allaitantes. Le tableau 1 donne un aperçu des principales situations cliniques concernées.
Conclusion
La complexité de la pharmacothérapie, associée à la polypharmacie, fait partie intégrante de la pratique clinique depuis plusieurs années dans une population vieillissante. Le TDM est un outil de médecine de précision établi et fondé sur des preuves, offrant la possibilité d’un traitement pharmacologique individualisé. Lorsqu’il est utilisé et interprété de manière appropriée, il aide les clinicien·nes à répondre à des questions spécifiques et à optimiser les stratégies thérapeutiques de façon ciblée. Chaque phase de la pharmacocinétique revêt une importance clinique majeure et peut influencer de manière déterminante le succès du traitement, le risque d’effets indésirables ainsi que l’éventualité d’un échec thérapeutique. Une compréhension approfondie de ces processus permet d’établir un lien étroit entre la pharmacocinétique appliquée et la pratique clinique.
Rapport de cas: modifications cliniquement pertinentes des concentrations sériques de clozapine après une réduction mammaire22
Une patiente de 57 ans présentant une schizophrénie résiduelle avait un poids stable au cours des dernières années (Indice de masse corporelle [IMC] de 38,75kg/m2). Le traitement comprenait la clozapine (325mg/jour), l’aripiprazole (15mg/jour), la paroxétine (40mg/jour) et la pirenzépine (100mg/jour) et était bien toléré, à l’exception d’une hypersalivation. En raison d’une hypertrophie mammaire bilatérale associée à des troubles orthopédiques, la patiente a subi une réduction mammaire. Au total, 6450 g de tissu mammaire ont été retirés, entraînant une diminution significative de l’IMC (IMC postopératoire: 36,33kg/m2).
Au cours de l’évolution postopératoire, la patiente s’est plainte de fatigue et de troubles de la concentration; des concentrations sériques élevées de clozapine et de norclozapine ont été mesurées. La posologie quotidienne de clozapine a donc été réduite à 300mg, puis à 250mg. Néanmoins, lors des contrôles ultérieurs sur une période de six mois, les concentrations élevées de clozapine et de norclozapine ont persisté (1192,0ng/ml et 530,0ng/ml; plage thérapeutique de référence pour la clozapine: 350-600ng/ml).
Commentaire:
La clozapine, antipsychotique atypique, est une substance fortement lipophile présentant une liaison aux protéines supérieure à 97%.28 La réduction du volume de distribution de la clozapine liée à la diminution du tissu adipeux constitue un modèle explicatif plausible des observations cliniques rapportées. Les médecins doivent être conscient·es des modifications pharmacocinétiques survenant après des interventions de réduction pondérale.
Rapport de cas: des interactions médicamenteuses peuvent conduire à des concentrations sériques indétectables de quétiapine en présence de carbamazépine23
Une femme de 44 ans atteinte d’un trouble schizo-affectif a été hospitalisée en raison d’une aggravation de ses symptômes psychotiques. Elle recevait 8mg/jour de rispéridone, 600mg de carbamazépine comme stabilisateur de l’humeur et 10mg de zolpidem.
Le traitement psychopharmacologique a été modifié: la rispéridone a été arrêtée et remplacée par la quétiapine. Sept jours après l’atteinte de la dose cible de quétiapine (700mg/jour), aucune concentration sérique de quétiapine n’a été détectée lors de deux mesures. La prise médicamenteuse était pourtant effectuée sous la surveillance constante du personnel soignant. La rispéridone, la carbamazépine et le zolpidem ont alors été arrêtés, et un traitement par lithium a été instauré, sans modification de la posologie quotidienne de la quétiapine. Sous ce nouveau traitement, une augmentation significative des concentrations de quétiapine a été observée. Au cours des semaines suivantes, l’état clinique de la patiente s’est nettement amélioré, permettant sa sortie de l’hôpital.
Commentaire:
La quétiapine est un antipsychotique atypique dont le métabolisme hépatique principal s’effectue via l’enzyme CYP3A4. La carbamazépine, antiépileptique et stabilisateur de l’humeur, est un puissant inducteur du CYP3A4. La prescription concomitante de carbamazépine et de quétiapine peut, via l’induction du CYP3A4, entraîner un échec thérapeutique, même à des doses quotidiennes élevées de quétiapine.
Conflit d’intérêts
Georgios Schoretsanitis a perçu, depuis 2020/2021, des honoraires pour des activités de conférencier et de conseil de la part de Dexcel Firma, HLS Therapeutics, Lundbeck, OM Suisse, Saladax et Thermo Fisher Scientific. Maxim Kuzin a perçu des honoraires de déplacement de Sunovion Pharmaceutical (Bâle, Suisse) et d’Otsuka Pharmaceutical (Glattbrugg, Suisse). Il a en outre perçu des honoraires pour sa participation à un speaker board de Lundbeck (Zurich, Suisse).
Littérature:
1 Bundesärztekammer (BÄK) et al.: Nationale Versorgungs-Leitlinie Unipolare Depression – Langfassung, Version 3.2.2022, dernière consultation le 22.9.2025 2 DGPPN e. V. (Hrsg.) für die Leitungsgruppe: S3-Leitlinie Schizophrenie. Kurzfassung, 2019, Version 1.0, dernière modification le 15.3.2019 3 O‘Donoghue B et al.: Response rates to sequential trials of antipsychotic medications according to algorithms or treatment guidelines in psychotic disorders. A systematic review and meta-analysis. Schizophr Res 2024; 268: 193-204 4 Hiemke C et al.: Consensus guidelines for therapeutic drug monitoring in neuropsychopharmacology: Update 2017. Pharmacopsychiatry 2018; 51 (1-02): 9-62 5 Hiemke C et al.: AGNP Consensus guidelines for therapeutic drug monitoring in psychiatry: Update 2011. Pharmacopsychiatry 2011; 44(6): 195-235 6 Baumann P et al.: The AGNP-TDM expert group consensus guidelines: therapeutic drug monitoring in psychiatry. Pharmacopsychiatry 2004; 37(6): 243-65 7 Hart XM et al.: Therapeutic reference ranges for psychotropic drugs: a protocol for systematic reviews. Front Psychiatry 2021; 12: 787043 8 Eichentopf L et al.: Systematic review and meta-analysis on the therapeutic reference range for escitalopram: Blood concentrations, clinical effects and serotonin transporter occupancy. Front Psychiatry 2022; 13: 972141 9 Hart XM et al.: Therapeutic reference range for aripiprazole in schizophrenia revised: a systematic review and metaanalysis. Psychopharmacology (Berl) 2022; 239(11): 3377-91 10 Grogan S, Preuss CV: Pharmacokinetics. In StatPearls: Treasure Island (FL): StatPearls Publishing; 2025 11 Wolff J et al.: Polypharmacy and the risk of drug-drug interactions and potentially inappropriate medications in hospital psychiatry. Pharmacoepidemiol Drug Saf 2021; 30(9): 1258-68 12 Food and Drug Administration (FDA): Full prescribing information Latuda (lurasidone hydrochloride). 2010, situation au 01/2025 13 Caccia S et al.: Critical appraisal of lurasidone in the management of schizophrenia. Neuropsychiatr Dis Treat 2012; 8: 155-68 14 Miao Y et al.: Enhanced oral bioavailability of lurasidone by self-nanoemulsifying drug delivery system in fasted state. Drug Dev Ind Pharm 2016; 42(8): 1234-40 15 Brown CS et al.: Antiseizure medication use in gastric bypass patients and other post-surgical malabsorptive states. Epilepsy Behav Rep 2021; 16: 100439 16 Wallerstedt SM et al.: Serum concentrations of antidepressants, antipsychotics, and antiepileptics over the bariatric surgery procedure. Eur J Clin Pharmacol 2021; 77(12): 1875-85 17 Porat Det al.: Managing the unpredictable: mechanistic analysis and clinical recommendations for lamotrigine treatment after bariatric surgery. J Clin Med 2021; 10(23): 5627 18 Kuzin M et al.: Switching from aripiprazole tablets to oral suspension in a patient with Roux-en-Y Gastric Bypass: a case report. J Clin Psychopharmacol 2023; 43(3): 300-2 19 Ayub S et al.: Lithium toxicity following Roux-en-Y gastric bypass: mini review and illustrative case. Ment Health Clin 2022; 12(3): 214-8 20 Kuzin M et al.: Bariatrische Chirurgie und Psychopharmakologie: Welchen Beitrag kann therapeutisches Drug-Monitoring leisten? Leading Opinions Neurologie & Psychiatrie 2025; 3: 53-6 21 Riederer P, Laux G: Grundlagen der Neuro-Psychopharmakologie. Ein Therapiehandbuch. Wien, New York: Springer; 2010 22 Schoretsanitis G et al.: Clinically relevant changes in clozapine serum concentrations after breast reduction surgery. Aust N Z J Psychiatry 2017; 51(10): 1059-60 23 Nickl-Jockschat T et al.: Drug interaction can lead to undetectable serum concentrations of quetiapine in the presence of carbamazepine. Clin Neuropharmacol 2009; 32(1): 55 24 Guppy M et al.: Rate of decline in kidney function with age: a systematic review. BMJ Open 2024; 14(11): e089783 25 Tondo L et al.: Clinical use of lithium salts: guide for users and prescribers. Int J Bipolar Disord 2019: 7(1): 16 26 Malhi GS et al.: The use of lithium for the treatment of bipolar disorder: recommendations from clinical practice guidelines. J Affect Disord 2017; 217: 266-80 27 Palmer SC et al.: Antidepressants for treating depression in adults with end-stage kidney disease treated with dialysis. Cochrane Database Syst Rev 2016; 2016(5): CD004541 28 Food and Drug Administration (FDA). Prescribing information Clozaril. Situation au 2/2020
Das könnte Sie auch interessieren:
Psychiatrie de transition – santé mentale à l’adolescence
La psychiatrie de transition est un champ encore récent qui se concentre sur le traitement et l’accompagnement des adolescent·es et des jeunes adultes âgé·es d’environ 14 à 25 ans. Son ...
Troubles anxieux péripartum – plus fréquents qu’on ne le pense, souvent négligés
Environ une femme sur 5 est touchée par un trouble anxieux pendant la grossesse ou le post-partum, avec des répercussions importantes sur le bien-être psychique, la gestion du quotidien ...
Expériences issues du projet «PsyYoung» – le BEATS aux UPK de Bâle
La prévention, le dépistage et l’intervention précoces des maladies psychotiques revêtent une importance particulière. En Suisse, il existe plusieurs centres bien établis dédiés au ...