Traitement innovant des tumeurs hépatiques primitives et secondaires
Auteurs:
Dr méd. Christoph Kümmerli1
PD Dr méd. Philip C. Müller1
Prof. Dr méd. Philipp Dutkowski1
Prof. Dr méd. Dieter Köberle2
Médecin-chef de clinique Dr méd. Ernesto Olcina Aguado2
Prof. Dr méd. Adrian T. Billeter, PhD1
Prof. Dr méd. Beat P. Müller1
1 Viszeralchirurgie, Clarunis Universitäres Bauchzentrum Basel, Universitätsspital und St. Claraspital Basel
2 Onkologie, St. Claraspital, Basel, Schweiz
Correspondance:
E-mail: beat.mueller@clarunis.ch
La chimiothérapie intra-artérielle constitue une extension efficace de l’éventail des traitements des tumeurs malignes hépatiques primitives et secondaires avancées. La chimiothérapie locale permet une administration à haute dose avec peu d’effets systémiques. Les tumeurs hépatiques primitives inopérables et les métastases peuvent ainsi être partiellement traitées de manière curative. Les résultats obtenus permettent un contrôle local, voire une réduction de la masse tumorale, de sorte qu’une résection curative devient possible.
Keypoints
-
La chimiothérapie intra-artérielle est un instrument du traitement multimodal des tumeurs hépatiques primitives et secondaires. Elle permet d’administrer une chimiothérapie à haute dose tout en limitant les effets systémiques.
-
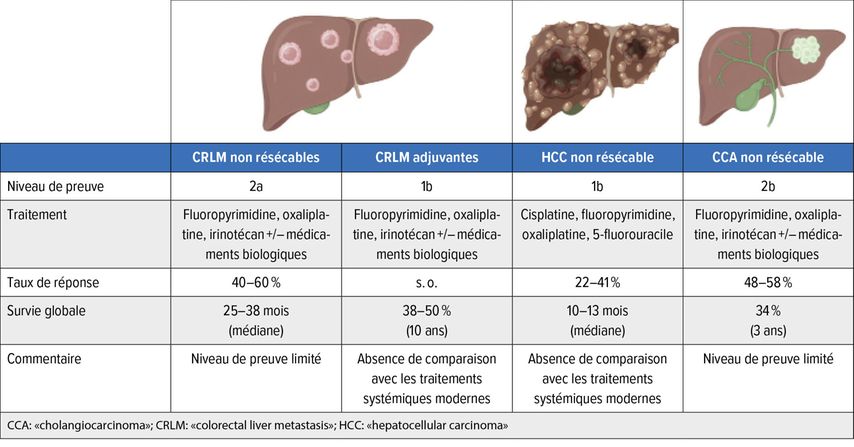
Pour les métastases hépatiques colorectales non résécables, l’objectif est la conversion en masse tumorale résécable. Les taux de réponse après chimiothérapie intra-artérielle atteignent entre 40 et 76%. Cela s’accompagne d’une résécabilité secondaire pouvant atteindre jusqu’à 50%. La chimiothérapie intra-artérielle est administrée en combinaison avec la chimiothérapie systémique.
-
Pour le carcinome hépatocellulaire et le cholangiocarcinome, le contrôle local de la tumeur est au premier plan. Une conversion en une maladie résécable par voie chirurgicale est plus rarement possible.
-
La pompe de chimiothérapie est implantée au moyen d’une procédure mini-invasive assistée par robot. Le traitement doit être effectué dans des centres de chirurgie viscérale et d’oncologie hautement spécialisés, et disposant d’une expérience confirmée en chirurgie hépatique complexe.
Le foie a une structure anatomique unique avec une double vascularisation par la veine porte et l’artère hépatique. Les tumeurs hépatiques sont principalement vascularisées par l’artère hépatique. On tire parti de cette caractéristique lors de la chimiothérapie intra-artérielle, laquelle utilise une pompe implantée dans la paroi abdominale. Un cathéter délivre la chimiothérapie dans l’artère hépatique via l’artère gastroduodénale (GDA) (Fig.1). Par rapport à la chimiothérapie systémique, la chimiothérapie intra-artérielle permet d’atteindre des concentrations de médicament jusqu’à 400 fois plus élevées dans le foie. La métabolisation des agents chimiothérapeutiques dans le foie et l’effet de premier passage élevé qui en résulte assurent une concentration systémique faible avec peu d’effets secondaires.
Fig.1: Résumé des domaines d’application de la chimiothérapie intra-artérielle et des résultats respectifs
Cet article de synthèse aborde les indications les plus courantes de la chimiothérapie intra-artérielle:
-
les métastases hépatiques colorectales et
-
les tumeurs hépatiques primitives.
Le cancer colorectal représente le quatrième type de cancer le plus fréquent dans le monde, avec une incidence de plus de 1,9million de cas. Les métastases hépatiques colorectales (CRLM) sont déterminantes pour le pronostic oncologique à long terme. Au moment du diagnostic, 25% des patient·es présentent déjà des métastases hépatiques synchrones et 25% supplémentaires développent ultérieurement des métastases hépatiques métachrones.
Lors de l’imagerie initiale, seules 20 à 30% des métastases hépatiques sont résécables et peuvent donc être traitées de manière curative. Par conséquent, un concept thérapeutique multimodal est souvent adapté aux patient·es. Des traitements systémiques et locaux sont utilisés dans ce cadre, avec pour objectif la conversion en une maladie résécable. Le traitement systémique actuel associe les agents chimiothérapeutiques 5-fluorouracile (5-FU), leucovorine et/ou oxaliplatine ou irinotécan. Ils sont souvent utilisés en combinaison avec des médicaments biologiques pour obtenir des taux de réponse élevés (70%). Cela permet de convertir jusqu’à 40% des CRLM initialement non résécables en un stade résécable.
Le carcinome hépatocellulaire (HCC) et le cholangiocarcinome (CCA) sont des cancers du foie primitifs.Avec 0,9million de nouveaux cas par an, ils sont plus rares que les CRLM, qui sont souvent seulement diagnostiquées à un stade avancé. En particulier dans le cas du CCA, qui est généralement difficile à diagnostiquer et à traiter, une réduction de la masse tumorale est décisive pour obtenir un «downstaging» en maladie résécable.
Les indications actuelles de la chimiothérapie intra-artérielle comprennent le «downstaging» des tumeurs hépatiques non résécables, le traitement adjuvant après résection de CRLM ainsi que le traitement palliatif pour le contrôle de la tumeur. La chimiothérapie intra-artérielle est souvent utilisée en combinaison avec une chimiothérapie systémique. Les paragraphes suivants abordent l’indication et les preuves actuelles disponibles sur le sujet.
Indications et contre-indications
La préparation préopératoire inclut les variantes anatomiques et la fonction hépatique.
Anatomie artérielle
Une condition préalable à la chimiothérapie intra-artérielle est une artère unique vascularisant le foie, sans branche artérielle de l’artère hépatique vers des organes voisins ou sans artère supplémentaire vascularisant le foie. La GDA doit être ouverte et présenter un diamètre adéquat pour la mise en place du cathéter. Le meilleur examen préopératoire est l’angio-TDM à haute résolution.
Fonction hépatique
Une lésion du parenchyme hépatique s’est souvent déjà produite dans les tumeurs hépatiques primitives et a contribué à la carcinogenèse, mais il faut en outre anticiper une lésion du parenchyme due à la toxicité de la chimiothérapie.
Les hépatopathies préexistantes et l’hypertension portale peuvent augmenter la morbidité lors de l’implantation de la pompe à perfusion et également réduire la tolérance à la chimiothérapie, ce qui influence à son tour l’effet du traitement. Cependant, il n’existe actuellement aucune valeur seuil basée sur des preuves en dessous de laquelle la fonction hépatique est considérée comme insuffisante pour une chimiothérapie intra-artérielle. Cette dernière s’est avérée sûre chez les patient·es atteint·es d’hépatopathie classée Child-Pugh A et peut constituer une option thérapeutique moins toxique qu’une monothérapie systémique chez les patient·es atteint·es de cirrhose classée Child-Pugh B.
Métastases hépatiques colorectales
Combinaison de chimiothérapie intra-artérielle et systémique
Niveau de preuve 2a
L’utilisation de la chimiothérapie intra-artérielle seule sans traitement systémique a été abandonnée en raison du risque de progression tumorale extra-hépatique et donc d’un bénéfice limité. L’importance du traitement systémique pour la résécabilité de CRLM a été soulignée par Lam et al. dans une étude randomisée. Le taux de réponse était de 64%, dont 23% des patient·es ont subi une résection curative.1
Un traitement systémique combiné avec une chimiothérapie intra-artérielle visant à améliorer le taux de réponse et la survie sans progression est une approche thérapeutique attrayante pour augmenter davantage l’effet de «downstaging». La première étude décrivant la chimiothérapie intra-artérielle en combinaison avec un traitement systémique a été une étude de phaseI publiée en 1989 par Safi et al. Elle a comparé la floxuridine seule (également connue sous le nom de FUDR), qui est métabolisée en 5-fluorouracile, à la floxuridine en combinaison avec un traitement systémique, mais n’a révélé aucune différence significative, avec des taux de réponse de 50% dans les deux cas.2 Pendant la période de suivi de 36 mois, aucun des deux groupes n’a montré d’augmentation de la probabilité de survie, mais la durée de survie a été prolongée dans un sous-groupe qui a répondu à la chimiothérapie intra-artérielle.
Actuellement, le niveau de preuve le plus élevé et la majeure partie de l’expérience proviennent d’une vaste cohorte du Memorial Sloan Kettering Cancer Center (MSKCC) à New York.
Une étude de phaseII combinant la chimiothérapie intra-artérielle avec le traitement systémique a montré que l’administration conjointe était sûre et efficace. D’Angelica et al. ont combiné la floxuridine avec le meilleur traitement systémique sur la base des chimiothérapies antérieures des patient·es.3 Une réponse tumorale a été obtenue chez 76% des patient·es, et même une conversion en une maladie résécable avec une probabilité de survie accrue chez 47%. L’association floxuridine et bévacizumab a également été étudiée. Elle a toutefois révélé une toxicité accrue des voies biliaires. Les auteur·es ont donc déconseillé ce traitement combiné. Les résultats à long terme de la cohorte MSKCC présentant des CRLM initialement inopérables ont mis en évidence un taux de conversion encore plus élevé (52%). Le taux de survie à 5 ans dans cette étude à un seul bras a été remarquable (36%).4
L’utilisation de l’irinotécan, de l’oxaliplatine et du 5-FU en combinaison avec le cétuximab administré par voie intraveineuse a permis d’obtenir un taux de réponse de 41% avec une survie globale de 25,5 mois. Environ 30% des patient·es ont pu subir une résection. Kemeny et al. ont même rapporté un taux de réponse de 92% et un taux de résécabilité de 47% en comparant le 5-FU par voie intra-artérielle et le traitement systémique par oxaliplatine et irinotécan (Fig.1).5,6
Traitement adjuvant
Niveau de preuve 1b
Une méta-analyse récemment publiée a identifié huit études randomisées impliquant 652 patient·es. Le hazard ratio (HR) pour la survie globale était de 0,91 (IC à 95%: 0,72–1,14) et ne montrait aucune différence entre les patient·es avec et sans chimiothérapie intra-artérielle. La moitié des études ont comparé l’utilisation avec un traitement systémique comme contrôle, l’autre moitié sans traitement adjuvant comme contrôle. Dès que des études non randomisées ont été incluses, un avantage de la chimiothérapie intra-artérielle en termes de survie globale a été mis en évidence (HR: 0,77; IC à 95%: 0,64–0,93). Ce qui est important pour l’interprétation des résultats, c’est que seules deux études randomisées ont été publiées après 2010.
D’autres analyses de sous-groupes d’études non randomisées ont montré un bénéfice principalement sous floxuridine (HR: 0,76; IC à 95%: 0,62–0,94) et sous chimiothérapie intra-artérielle en combinaison avec un traitement systémique adjuvant (HR: 0,75; IC à 95%: 0,59–0,90). Une fois de plus, l’une des principales limites des études incluses est l’hétérogénéité en termes de charge tumorale, d’évaluation de la réponse et de résécabilité. Les traitements systémiques combinent principalement le 5-FU, l’oxaliplatine et l’irinotécan, mais plusieurs nouveaux médicaments biologiques peuvent être ajoutés. Les principes actifs modernes administrés par voie intra-artérielle permettent d’augmenter les taux de réponse. La possibilité d’initier une chimiothérapie intra-artérielle chez les patient·es dont la maladie progresse sous traitement systémique, même après plusieurs lignes de traitement, constitue une extension prometteuse des options thérapeutiques pour une maladie avancée difficile à traiter.
Dans ce domaine également, la plus vaste étude a été menée par le MSKCC. Chez les patient·es ayant subi une résection complète suivie d’une chimiothérapie intra-artérielle, la probabilité de survie globale à dix ans était de 51 par rapport à 31% chez les patient·es n’ayant reçu qu’un traitement systémique adjuvant.7 Les données sur la probabilité de survie à dix ans ont été mises à jour et complétées par les informations issues de la base de données institutionnelle. Un taux de survie globale accru de 57% a finalement été obtenu.8 Il convient de noter que peu de centres internationaux ont publié plus d’une série initiale et qu’il y a donc un manque de consensus et de valeurs de référence concernant les résultats à atteindre.
Tumeurs hépatiques primitives
Carcinome hépatocellulaire
Niveau de preuve 1b
Le traitement du HCC est basé sur l’algorithme Barcelona Clinic Liver Cancer (BCLC), qui a été mis à jour en 2022.9 La résection chirurgicale est uniquement proposée aux patient·es présentant un petit HCC sans invasion macrovasculaire et avec une fonction hépatique préservée. Dans la plupart des pays, la transplantation est réservée aux patient·es atteint·es d’HCC selon les critères de Milan ou des versions adaptées.10
Pour l’HCC de stade intermédiaire ou avancé, il existe plusieurs options de traitements locaux et systémiques. Les traitements par voie intra-artérielle jouent un rôle dans le traitement de l’HCC situé en dehors des critères de transplantation ou comme mesure de transition ou de «downstaging» avant la transplantation. Outre l’embolisation assistée par cathéter comme la chimio-embolisation intra-artérielle (TACE) ou la radiothérapie locale, la chimiothérapie intra-artérielle fait partie des options thérapeutiques multimodales de cet algorithme. Dans la pratique, la chimiothérapie intra-artérielle est généralement combinée avec un traitement systémique, car aucun avantage en termes de survie n’a été démontré lorsqu’elle est utilisée seule.
L’efficacité du sorafénib en combinaison avec une chimiothérapie intra-artérielle a été évaluée dans plusieurs ERC.11–14 Ikeda et al. ont montré des taux de réponse trois fois plus élevés (7,3 par rapport à 21,7%; p=0,09) et une survie médiane prolongée lorsque les patient·es étaient traité·es par sorafénib et cisplatine par voie intra-artérielle par rapport au sorafénib seul (10,6 par rapport à 8,7 mois; HR: 0,68; IC à 95%: 0,44–1,05; p=0,073). He et al. ont fourni des résultats similaires dans une étude randomisée multicentrique. Les auteur·es ont comparé la chimiothérapie intra-artérielle par FOLFOX en plus du sorafénib avec le sorafénib seul chez les patient·es atteint·es d’HCC avec invasion portale. On a constaté ici un taux de réponse nettement plus élevé (40,8 par rapport à 2,5%; p<0,001) et une survie presque deux fois plus longue (13,4 par rapport à 7,1 mois; HR: 0,35; IC à 95%: 0,26–0,48; p<0,001).En revanche, la plus vaste étude de phaseIII randomisée multicentrique, portant sur 206 patient·es, n’a trouvé aucune différence significative en termes de survie globale lorsque le sorafénib était combiné avec une chimiothérapie intra-artérielle à base de cisplatine à faible dose et de 5-FU (11,5 par rapport à 11,8 mois; p=0,955). Une autre petite étude randomisée, incluant des patient·es atteint·es de thrombose portale, a montré des taux de réponse plus élevés sous traitement combiné par sorafénib et oxaliplatine/5-FU par voie intra-artérielle par rapport au sorafénib seul (41 par rapport à 3%; p<0,001). En outre, la survie médiane était de 16,3 mois sous sorafénib plus chimiothérapie intra-artérielle et de 6,5 mois sous sorafénib seul (HR: 0,28; IC à 95%: 0,15–0,53; p<0,001). Dans les études mentionnées, le taux d’événements indésirables dans le groupe recevant une chimiothérapie intra-artérielle était comparable à celui du groupe de contrôle. Les complications liées au cathéter étaient faibles, avec une incidence de 6 à 12%. Il convient de noter qu’une seule nouvelle opération a été nécessaire dans les quatre études en raison d’un événement indésirable survenu sous chimiothérapie intra-artérielle.
Alors que les études randomisées ont démontré la faisabilité de la chimiothérapie intra-artérielle, l’avantage supplémentaire en termes de survie de la combinaison avec le sorafénib n’a toutefois pas été démontré de manière constante. En fin de compte, une vaste étude multicentrique est nécessaire pour confirmer ou infirmer un bénéfice de la chimiothérapie intra-artérielle dans l’HCC.
Cholangiocarcinome
Niveau de preuve 2b
Les patient·es atteint·es de CCA présentent souvent un stade avancé de la maladie, avec une durée de survie courte. Dans le cas du CCA intrahépatique (iCCA) au stade précoce, la chirurgie peut augmenter le taux de survie à 5 ans jusqu’à 40%.15 Le rôle de la transplantation en cas de maladie inopérable reste controversé, car les critères de sélection ne sont pas clairement définis à ce jour. Bien que des progrès aient été réalisés dans le traitement systémique des patient·es atteint·es de CCA avancé, la durée médiane de survie avec les derniers schémas thérapeutiques est toujours d’à peine 12 mois. Les méthodes de traitement local telles que la radio-embolisation, la chimio-embolisation ou la chimiothérapie intra-artérielle sont donc des options thérapeutiques attrayantes tant que la tumeur est limitée au foie.
Il existe peu de preuves concernant la chimiothérapie intra-artérielle dans l’iCCA. Dans une étude de phaseIII à un bras, l’administration intra-artérielle de floxuridine combinée avec l’administration systémique de gemcitabine et d’oxaliplatine a permis à 38 patient·es atteint·es de tumeurs initialement inopérables d’obtenir un taux de réponse radiologique de 58% et un contrôle de la tumeur de 86%. L’effet était indépendant du statut des ganglions lymphatiques. Quatre patient·es (11%) ont même pu obtenir une conversion en un stade résécable.16
Chez les patient·es atteint·es d’iCCA inopérable, les données à long terme issues d’études prospectives montrent également un excellent contrôle de la tumeur sous chimiothérapie intra-artérielle. Ainsi, 48% des patient·es ont obtenu une réponse partielle et un taux de survie à trois ans de près de 40%, même sans résection. Kasai a rapporté une série de cas de 20 patient·es atteint·es d’iCCA avancé avec un taux de réponse de 60% lorsque les patient·es recevaient un traitement combiné par 5-FU et interféron pégylé en combinaison avec une chimiothérapie intra-artérielle. Cependant, un quart des patient·es de cette cohorte présentaient déjà des métastases pulmonaires. Ghiringhelli et al. ont rapporté un taux de contrôle de la maladie de 91% dans une série de douze patient·es traité·es par gemcitabine et oxaliplatine.17
La dernière étude bi-institutionnelle, à laquelle ont participé 268 patient·es des Pays-Bas et du MSKCC, a mis en évidence un net avantage en termes de survie dans une cohorte traitée par voie intra-artérielle par rapport à l’administration systémique de gemcitabine et de cisplatine (survie globale à trois ans: 34,3 par rapport à 3,5%).18 La probabilité de survie au cours de la période de suivi était presque quatre fois plus élevée sous chimiothérapie intra-artérielle.
Une analyse multicentrique rétrospective a comparé le traitement par le 5-FU par voie intra-artérielle de l’iCCA multifocal mis en évidence à l’histologie chez 141 patient·es à la résection chez 178 patient·es.19 Les patient·es traité·es sur une période de 18 ans présentaient une charge tumorale plus élevée dans le groupe sous chimiothérapie intra-artérielle. La mortalité à 30 jours était 8 fois plus élevée dans le groupe ayant subi une résection (chimiothérapie intra-artérielle: 0,8% par rapport à résection: 6,2%), tandis que la survie globale médiane était comparable (20 par rapport à 19 mois). Sur la base de ces résultats, l’indication de la résection dans l’iCCA multifocal doit être reconsidérée si aucun avantage de survie ne peut être obtenu par rapport à la chimiothérapie intra-artérielle – d’autant plus que le risque de mortalité lié à la résection chirurgicale était nettement plus élevé.
Dans une méta-analyse de quatre études et de 144 patient·es, y compris l’étude de phaseII susmentionnée, les patient·es atteint·es d’iCCA inopérable traité par la floxuridine par voie intra-artérielle ont montré une probabilité de survie à trois ans nettement plus élevée, soit 39,5 par rapport à 0% sous chimiothérapie systémique.
En résumé, la chimiothérapie par voie intra-artérielle peut augmenter les taux de réponse ainsi que de résécabilité et prolonger la survie à long terme chez certain·es patient·es présentant des tumeurs hépatiques primitives et secondaires. La combinaison avec la chimiothérapie systémique est particulièrement prometteuse dans le traitement de conversion des tumeurs initialement inopérables. En outre, le traitement adjuvant des patient·es atteint·es d’hépatopathies ou le traitement palliatif des maladies limitées au foie est attrayant et a le potentiel de minimiser les effets secondaires systémiques.
Littérature:
1 Lam VW et al.: A systematic review of clinical response and survival outcomes of downsizing systemic chemotherapy and rescue liver surgery in patients with initially unresectable colorectal liver metastases. Ann Surg Oncol 2012; 19(4): 1292-1301 2 Safi F et al.: Regional chemotherapy for hepatic metastases of colorectal carcinoma (continuous intraarterial versus continuous intraarterial/intravenous therapy). Results of a controlled clinical trial. Cancer 1989; 64(2): 379-87 3 DʼAngelica MI et al.: Phase II trial of hepatic artery infusional and systemic chemotherapy for patients with unresectable hepatic metastases from colorectal cancer: conversion to resection and long-term outcomes. Ann Surg 2015; 261(2): 353-60 4 Pak LM et al.: Prospective phase II trial of combination hepatic artery infusion and systemic chemotherapy for unresectable colorectal liver metastases: long term results and curative potential. J Surg Oncol 2018; 117(4): 634-43 5 Kemeny NE et al.: Conversion to resectability using hepatic artery infusion plus systemic chemotherapy for the treatment of unresectable liver metastases from colorectal carcinoma. JClin Oncol 2009; 27(21): 3465-71 6 Boige V et al.: Hepatic arterial infusion of oxaliplatin and intravenous LV5FU2 in unresectable liver metastases from colorectal cancer after systemic chemotherapy failure. Ann Surg Oncol 2008; 15(1): 219-26 7 Srouji R et al.: Addition of adjuvant hepatic artery infusion to systemic chemotherapy following resection of colorectal liver metastases is associated with reduced liver-related mortality. J Surg Oncol 2020; 121(8): 1314-9 8 Ecker BL et al.: Genomic stratification of resectable colorectal liver metastasis patients and implications for adjuvant therapy and survival. Ann Surg 2022; 275(2): 371-81 9 Reig M et al.: BCLC strategy for prognosis prediction and treatment recommendation: the 2022 update. J Hepatol 2022; 76(3): 681-93 10 Tschuor C et al.: Allocation of liver grafts worldwide - is there a best system? J Hepatol 2019; 71(4): 707-18 11 Ikeda M et al.: Sorafenib plus hepatic arterial infusion chemotherapy with cisplatin versus sorafenib for advanced hepatocellular carcinoma: randomized phase II trial. Ann Oncol 2016; 27(11): 2090-6 12 He M et al.: Sorafenib plus hepatic arterial infusion of oxaliplatin, fluorouracil, and leucovorin vs sorafenib alone for hepatocellular carcinoma with portal vein invasion: a randomized clinical trial. JAMA Oncol 2019; 5(7): 953-60 13 Kudo M et al.: Sorafenib plus low-dose cisplatin and fluorouracil hepatic arterial infusion chemotherapy versus sorafenib alone in patients with advanced hepatocellular carcinoma (SILIUS): a randomised, open label, phase 3 trial. Lancet Gastroenterol Hepatol 2018; 3(6): 424-32 14 Zheng K et al.: Sorafenib plus hepatic arterial infusion chemotherapy versus sorafenib for hepatocellular carcinoma with major portal vein tumor thrombosis: a randomized trial. Radiology 2022; 303(2): 455-64 15 Marcus R et al.: Systemic therapy is associated with improved oncologic outcomes in resectable stage II/III intrahepatic cholangiocarcinoma: an examination of the National Cancer Database over the past decade. Cancers (Basel) 2022; 14(17): 4320 16 Cercek A et al.: Assessment of hepatic arterial infusion of floxuridine in combination with systemic gemcitabine and oxaliplatin in patients with unresectable intrahepatic cholangiocarcinoma: aphase 2 clinical trial. JAMA Oncol 2020; 6(1): 60-7 17 Ghiringhelli F et al.: Hepatic arterial infusion of gemcitabine plus oxaliplatin as second-line treatment for locally advanced intrahepatic cholangiocarcinoma: preliminary experience. Chemotherapy 2013; 59(5): 354-60 18 Franssen S et al.: Gemcitabine with cisplatin versus hepatic arterial infusion pump chemotherapy for liver-confined unresectable intrahepatic cholangiocarcinoma. Ann Surg Oncol 2024; 31(1): 115-124 19 Franssen S et al.: Comparison of hepatic arterial infusion pump chemotherapy vs resection for patients with multifocal intrahepatic cholangiocarcinoma. JAMA Surg 2022; 157(7): 590-6
Das könnte Sie auch interessieren:
Options thérapeutiques pour la SLA
L’accumulation d’espèces réactives de l’oxygène (ROS) et le stress oxydatif qui en résulte favorisent la pathogenèse de maladies neuronales telles que la sclérose latérale amyotrophique ...
Études visant à modifier la pratique en cas de cancer de l’urothélium et de la prostate
Le paysage thérapeutique des tumeurs urologiques est en constante évolution. Les progrès les plus marquants concernent les premières lignes de traitement. Voici un aperçu des études qui ...
Nouvelles approches thérapeutiques et données modifiant les directives
Cette année, le congrès de l’ISTH s’est tenu du 21 au 25 juin à Washington D.C. Au cours des 115 sessions, les expert·es les plus renommé·es du monde ont présenté les dernières données ...