Résultats finaux de l’étude CheckMate-901 – Analyse de sous-groupe pour l’étude EV-302/KEYNOTE-A39
Compte-rendu:
Dre rer. nat. Ine Schmale
Les résultats finaux de l’étude CheckMate-901 confirment, avec une durée de suivi de plus de 5 ans, l’avantage en termes de survie de l’immunothérapie par rapport à la chimiothérapie pour les patient·es atteint·es d’un carcinome urothélial non éligibles au cisplatine. Sur la base des résultats de l’étude de phaseIII EV-302, l’enfortumab vedotin (EV) plus pembrolizumab est devenu le nouveau traitement de référence en première ligne du carcinome urothélial (CU) localement avancé ou métastasique. Une analyse des patient·es atteint·es ayant répondu au traitement a été présentée lors du congrès de l’ASCO.
Résultats finaux de l’étude CheckMate 901 sur le CU non éligible au cisplatine
Les patient·es atteint·es d’un carcinome urothélial non éligibles à une chimiothérapie à base de cisplatine, mais dont l’état de santé est bon, peuvent être traité·es en première ligne par gemcitabine plus carboplatine. Le développement des inhibiteurs des points de contrôle a ouvert la voie à de nouvelles options thérapeutiques pour ces patient·es.
Dans l’étude de phaseIII randomisée ouverte CheckMate 901, le traitement par nivolumab plus ipilimumab (4 cycles) suivi de nivolumab en monothérapie (jusqu’à 24 mois) a été comparé à la gemcitabine plus cisplatine/carboplatine (6 cycles). Au total, 445 patient·es ont été inclus·es dans la cohorte des patient·es non éligibles au cisplatine. Les patient·es étaient âgé·es en moyenne de 70 à 71 ans, présentaient des métastases hépatiques dans 22 à 23% des cas et une expression de PD-L1 <1% dans 66% des tumeurs. Les critères d’évaluation primaires de l’étude étaient la survie globale (OS) de la cohorte des patient·es non éligibles au cisplatine et des patient·es présentant une expression de PD-L1 ≥1%.
Avec une durée de suivi de 69,2 mois, les résultats finaux de l’étude ont été publiés lors du congrès de l’ASCO.1 Le délai médian jusqu’à l’arrêt du traitement était de 2,2 mois dans le bras sous nivolumab plus ipilimumab par rapport à 3,8 mois dans le bras sous gemcitabine plus carboplatine. L’arrêt du traitement était dû à la toxicité dans 28 par rapport à 11% des cas et à la progression de la maladie dans 40 par rapport à 27% des cas. Seul·es 46% des patient·es ont complété 4 cycles de nivolumab plus ipilimumab, 12% ont complété le traitement par nivolumab en monothérapie et 44% ont complété 6 cycles de chimiothérapie.
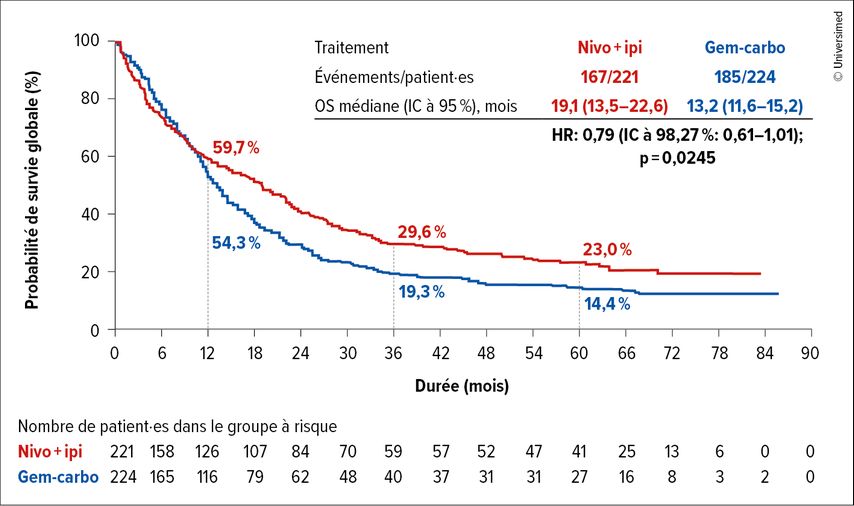
L’étude CheckMate 901 n’a pas atteint le seuil pré-spécifié pour un avantage significatif de l’immunothérapie chez les patient·es non éligibles au cisplatine (HR: 0,79; IC à 98,27%: 0,61–1,01; p=0,0245; Fig.1). Néanmoins, les courbes de Kaplan-Meier pour l’OS à 12 mois se sont divisées et sont restées séparées de manière cohérente, avec un avantage pour l’immunothérapie. 29,6% des patient·es du bras expérimental étaient en vie par rapport à 19,3% des patient·es du bras de contrôle après 3 ans et 23,0 par rapport à 14,4% après 5 ans. L’OS médiane était de 19,1 par rapport à 13,2 mois. Le deuxième critère d’évaluation primaire, à savoir un avantage en termes d’OS en cas d’expression de PD-L1 ≥1, n’a pas non plus été atteint (HR: 0,87; IC à 97,48%: 0,61–1,23; p=0,364). En revanche, un avantage a été observé pour le nivolumab plus ipilimumab par rapport à la gemcitabine plus dérivé du platine chez l’ensemble des patient·es randomisé·es (HR: 0,78; IC à 95%: 0,66–0,92).
Fig.1: Survie globale chez les patient·es atteint·es de carcinome urothélial non éligibles au cisplatine sous nivolumab plus ipilimumab par rapport à sous gemcitabine plus cisplatine/carboplatine dans l’étude CheckMate-901 (modifiée selon van der Heijden MS et al.)1
La survie sans progression (PFS) était en médiane de 5,3 par rapport à 5,9 mois, mais les courbes de Kaplan-Meier se sont séparées précocement et sont restées séparées de manière cohérente, comme pour l’OS. 31,5 par rapport à 17,2% des patient·es n’ont montré aucune progression à 12 mois, 20 par rapport à 4,9% à 3 ans et 16,8 par rapport à 4,9% à 60 mois. 35,3 par rapport à 38,8% des patient·es ont répondu au médicament à l’étude. La durée médiane de la réponse était de 25,0 (IC à 95%: 14,8–61,8) par rapport à 7,4 mois (IC à 95%: 5,8–8,5). Aucun nouveau signal de sécurité n’a été observé.
Conclusion
L’étude CheckMate-901 n’a pas atteint ses critères d’évaluation primaires. Les patient·es qui ont répondu, ont toutefois bénéficié de l’immunothérapie à long terme. Après 60 mois, 23,0 par rapport à 14,4% des patient·es non éligibles au cisplatine étaient en vie.
Une analyse exploratoire confirme le traitement de première ligne par EV plus Pembro dans le CU avancé
L’étude de phaseIII EV-302/KEYNOTE-A39 a évalué l’enfortumab vedotin plus pembrolizumab par rapport à la chimiothérapie de référence à base de cisplatine/carboplatine plus gemcitabine en première ligne chez des patient·es atteint·es d’un carcinome urothélial localement avancé ou métastasique.2
Les deux critères d’évaluation primaires étaient la PFS et l’OS. Une réponse a été observée chez 67,5 par rapport à 44,2% des patient·es, avec une rémission complète (CR) chez 30,4 par rapport à 14,5%. Une analyse exploratoire des patient·es atteint·es ayant répondu au médicament à l’étude n’a révélé aucun signal concernant les caractéristiques des patient·es au moment du diagnostic. Tous les groupes de patient·es ont répondu plus fréquemment à l’enfortumab vedotin plus pembrolizumab qu’à la chimiothérapie.
La durée médiane de la réponse a été de 23,3 mois sous association expérimentale par rapport à 7,0 mois sous chimiothérapie. 67,5 par rapport à 35,1% des patient·es ayant répondu au traitement après 12 mois et 49,4 par rapport à 24,0% après 24 mois étaient en rémission continue. Ce résultat a été observé indépendamment de l’éligibilité des patient·es au cisplatine. Les patient·es en CR ont également présenté une durée de la réponse plus longue sous enfortumab vedotin plus pembrolizumab par rapport à la chimiothérapie. 84,3 par rapport à 60% étaient toujours en CR après 12 mois et 74,3 par rapport à 43,2% après 24 mois. La durée de la réponse à l’enfortumab vedotin plus pembrolizumab était de 12 mois chez 49,0% des patient·es en rémission partielle (PR) et de 24 mois chez 23,4%. Sous chimiothérapie, ces chiffres n’étaient respectivement que de 11,3 et 8,2%. Après 2 ans, 76,3 par rapport à 59,8% des patient·es ayant répondu étaient encore en vie dans les deux bras de l’étude et 95,4 par rapport à 85,8% des patient·es étaient en CR. Des modifications de dose ont été régulièrement effectuées chez les patient·es ayant répondu au traitement. Malgré une durée de traitement plus longue, le profil de sécurité des patient·es ayant répondu a été comparable à celui de l’ensemble de la population étudiée.
Conclusion
Les résultats de l’analyse de sous-groupe de patient·es ayant répondu, confirment l’enfortumab vedotin plus pembrolizumab comme traitement de référence en première ligne dans le carcinome urothélial localement avancé ou métastasique, quelles que soient les caractéristiques des patient·es (y compris l’éligibilité au cisplatine).
Source:
Congrès 2025 de l’American Society of Clinical Oncology (ASCO), 30 mai au 4 juin, Chicago, États-Unis
Littérature:
1 van der Heijden MS et al.: Nivolumab plus ipilimumab vs gemcitabine-carboplatin chemotherapy for previously untreated unresectable or metastatic urothelial carcinoma: final results for cisplatin-ineligible patients from the CheckMate 901 trial. ASCO 2025; Abstr. #4500 2 Gupta S et al.: Expolartory analysis of responders from the phase 3 EV-302 trial of enfortumab vedotin plus pembrolizumab vs chemotherapy in previously untreated locally advanced or metastatic urothelial carcinoma. ASCO 2025; Abstr. #4502
Das könnte Sie auch interessieren:
Traitement innovant des tumeurs hépatiques primitives et secondaires
La chimiothérapie intra-artérielle constitue une extension efficace de l’éventail des traitements des tumeurs malignes hépatiques primitives et secondaires avancées. La chimiothérapie ...
Les données de l’ASCO redéfinissent lesnormes
Le traitement par T-DXd s’est révélé supérieur au ramucirumab plus paclitaxel dans l’étude DESTINY-Gastric04. Le conjugué anticorps-médicament est désormais le standard de deuxième ligne ...
LMC-PC: l’asciminib comme standard? – LLA-B nouvellement diagnostiquée: le blinatumomab pour la consolidation
En raison de la longue durée du traitement, la LMC nécessite non seulement une thérapie efficace, mais également une bonne tolérance. L’asciminib s’est révélé efficace et sûr chez les ...