LMC-PC: l’asciminib comme standard? – LLA-B nouvellement diagnostiquée: le blinatumomab pour la consolidation
Compte-rendu:
Dre rer. nat. Ine Schmale
En raison de la longue durée du traitement, la LMC nécessite non seulement une thérapie efficace, mais également une bonne tolérance. L’asciminib s’est révélé efficace et sûr chez les patient·es nouvellement diagnostiqué·es. Dans l’étude ASC4START, la substance a été comparée au nilotinib. Dans l’étude de phaseIII E1910, des patient·es nouvellement diagnostiqué·es avec une LLC à cellules B BCR::ABL1 négative et en rémission complète MRD-négative ont reçu une consolidation par chimiothérapie et blinatumomab. Lors du congrès de l’EHA, les résultats concernant les patient·es adultes plus jeunes ont été présentés. Des données prometteuses ont également été rapportées sur le traitement de sous-types de LMA à impact pronostique ainsi que sur la prophylaxie de la GvHD.
Une meilleure tolérance permet à davantage de patient·es atteint·es de LMC d’atteindre leur objectif thérapeutique
Comparé à d’autres inhibiteurs de tyrosine kinase de deuxième génération, l’asciminib agit de manière hautement spécifique contre BCR::ABL1 et peut ainsi limiter les effets indésirables hors cible. L’étude de phaseIIIb ASC4START a évalué de manière randomisée l’asciminib versus le nilotinib chez des patient·es atteint·es de leucémie myéloïde chronique à chromosome Philadelphie positif en phase chronique (LMC-CPPh+) nouvellement diagnostiquée.1 Au total, 568 malades ≥18 ans ont été inclus·es. Le critère d’évaluation principal de l’étude était le délai avant l’arrêt du traitement et avant le décès lié aux effets indésirables.
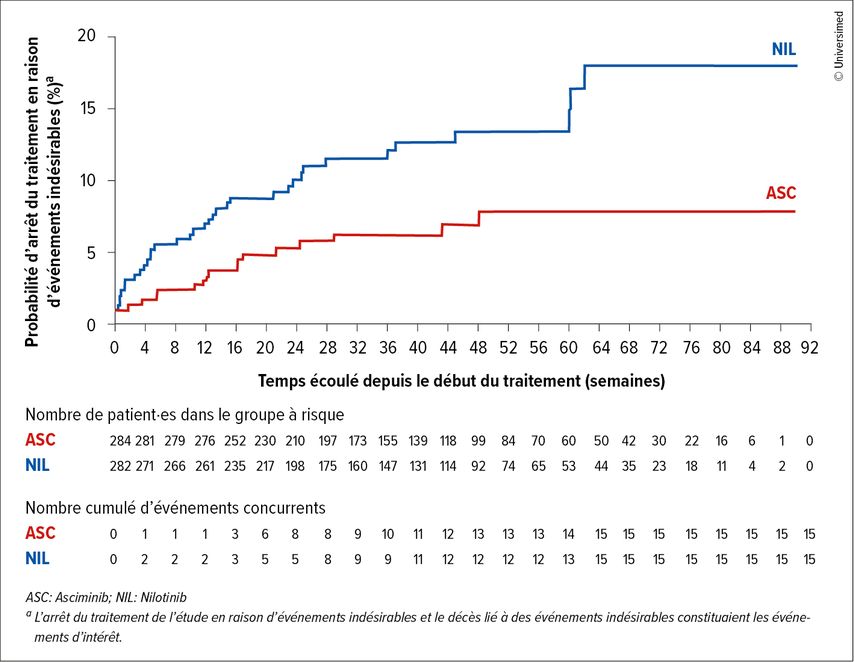
Lors de la première analyse, avec un suivi médian de 9,7 mois, 89,1% contre 82,0% des patient·es poursuivaient l’asciminib ou le nilotinib. Sous asciminib, 10,9% des patient·es avaient interrompu le traitement, 4,9% en raison d’effets indésirables (Fig.1) et 0,7% étaient décédé·es. Sous nilotinib, 17,3% des patient·es ont arrêté le traitement, 11,6% en raison d’effets indésirables et 0,4% sont décédé·es. La différence de tolérance entre les bras de l’étude était significative (HR: 0,45; IC à 95%: 0,25–0,81; p=0,004).
Fig.1: Délai avant l’arrêt du traitement en raison d’événements indésirables sous asciminib comparé au nilotinib dans la leucémie myéloïde chronique à chromosome Philadelphie positif nouvellement diagnostiquée et en phase chronique, dans l’étude ASC4START (modifiée selon Hochhaus A et al.)3
Au-delà d’une meilleure tolérance, davantage de patient·es ont obtenu une rémission moléculaire précoce et profonde à la semaine 12 sous asciminib: BCR::ABL1 ≤10% a été observé chez 89,8% contre 82,0%, BCR::ABL1 ≤1% chez 69,0% contre 52,5%, une bonne rémission moléculaire (MMR) chez 22,9% contre 10,2%, une MR4 chez 4,6% contre 1,1% et une MR4,5 chez 2,5% contre 0,4% des patient·es.
Conclusion
Les résultats de l’étude ASC4START en cours confirment le potentiel de l’asciminib comme nouveau standard thérapeutique pour les malades atteint·es d’une LMC-PC nouvellement diagnostiquée. L’asciminib permet à un plus grand nombre de patient·es d’atteindre leur objectif thérapeutique sans changement de traitement.
Le blinatumomab, élément efficace de la consolidation dans la LLC-B nouvellement diagnostiquée
L’étude de phaseIII E1910, randomisée et ouverte, a été conduite chez des patient·es âgé·es de 30 à 70 ans atteint·es de leucémie lymphoïde aiguë à cellules B (LLA-B) BCR::ABL1 négative. Une amélioration significative de l’OS (survie globale) a été observée avec l’administration supplémentaire de blinatumomab, avec un taux de 85% à 3 ans versus 68%. Une stratification a notamment été réalisée selon l’âge, avec un cut-off à 55 ans. L’analyse de sous-groupe des 277 jeunes patient·es adultes (30 à 54 ans) a été présentée lors du Congrès de l’EHA.2 52% de cette cohorte de patient·es appartenaient au sous-groupe à haut risque moléculaire.
Après 2 cycles d’induction, 86% des malades ont présenté une RC ou une RC avec récupération incomplète (RCi). 2% des patient·es sont décédé·es de toxicité liée au traitement d’induction et 29% n’ont pas pu être randomisé·es. Finalement, 66 et 65 patient·es ont été randomisé·es pour recevoir soit chimiothérapie+blinatumomab, soit chimiothérapie seule en consolidation.
Le risque de décès a été réduit de 80% avec le blinatumomab (HR: 0,20; IC à 95%: 0,08–0,54; p<0,001). Après 3 ans, le taux d’OS était de 92% contre 67%. Le risque de rechute de la maladie a été réduit de 63% dans le bras blinatumomab par rapport au bras contrôle (HR: 0,37; IC à 95%: 0,17–0,81; p=0,009). Après 3 ans, 86% contre 66% des patient·es étaient en survie sans rechute.
Chez les très jeunes patient·es adultes (30–39 ans), dont 29% dans le bras chimiothérapie+blinatumomab et 15% dans le bras chimiothérapie seule, présentaient un haut risque moléculaire, l’ajout de blinatumomab a apporté un bénéfice majeur. À 3 ans, le taux d’OS était de 100% contre 73% et le taux de DFS (survie sans maladie) de 90% contre 69%. Les patient·es atteint·es d’une maladie BCR::ABL1-like MRD-négative ont obtenu un taux d’OS de 100% à 3 ans et un taux de DFS de 100% à 3 ans avec le blinatumomab. Sous chimiothérapie seule, ce taux n’était que de 45% dans les deux cas. L’indice de masse corporelle (IMC) n’a pas influencé les résultats.
Conclusion
L’OS et la DFS des adultes MRD-négatifs âgés de 30 à 54 ans sont significativement prolongées par une consolidation associant blinatumomab à la chimiothérapie. Les résultats de l’étude ACRIN-E1910, combinés à ceux de l’étude COG AALL 1731, soutiennent l’utilisation du blinatumomab chez les adolescents et les jeunes adultes atteints de LLA-B. Le blinatumomab peut être administré par voie orale ou par injection.
Activité prometteuse du revuménib dans la LMA nouvellement diagnostiquée
Alors que la leucémie myéloïde aiguë (LMA) avec mutation NPM1 (NPM1m) est associée à un pronostic légèrement meilleur, la LMA réarrangée KMT2A (KMT2Ar) correspond à une forme très agressive avec mauvais pronostic. Globalement, les adultes atteints de LMA ont un fort besoin de nouvelles options thérapeutiques. Le revuménib, inhibiteur de la ménine, est déjà approuvé par la FDA aux États-Unis pour les LMA KMT2Ar réfractaires ou en rechute. Au congrès de l’EHA, des résultats prometteurs de l’étude de phaseIb Beat AML ont été présentés. Le revuménib y était administré avec azacitidine et vénétoclaxchez chez des patient·es ≥60 ans nouvellement diagnostiqué·es avec une LMA NPM1m ou KMT2Ar.3 Un total de 43 patient·es atteint·es de LMA ont été traité·es, dont 9 avec le sous-type KMT2Ar et 34 avec le sous-type NPM1m. 3 personnes (7%) sont décédées dans les 30 jours. Malgré l’ajout de revuménib, la durée médiane des phases d’induction et de consolidation est restée comparable à celle de l’étude clinique précédente VIALE-A (azacitidine+vénétoclax). Globalement, une réponse a été observée chez 88,4% des patient·es inclus·es, avec une rémission complète (RC) chez 67,4% des patient·es. Aucun·e participant·e à l’étude n’a présenté de maladie réfractaire après 1 ou 2 cycles. Tous·tes les patient·es évaluables ont atteint une rémission MRD (maladie résiduelle minimale)-négative (sensibilité de 0,02%), dont 76% après le premier cycle de traitement et 89% après le deuxième.
10 patient·es (23%) ont reçu une greffe de cellules souches allogéniques. 4 rechutes ont été rapportées: 3 dans le sous-groupe KMT2Ar et 1 dans le sous-groupe NPM1m. Avec un suivi médian de 6,9 mois, le taux d’OS à 1 an était de 63%, avec 83% pour KMT2Ar et 55% pour NPM1m.
Conclusion
Le traitement azacitidine+vénétoclax+revuménib apparaît très efficace chez les patient·es âgé·es nouvellement diagnostiqué·es avec une LMA NPM1m ou KMT2Ar. Le recrutement pour l’étude de phaseIII EVOLVE-2, randomisée et contrôlée par placebo, est en cours.
Le cyclophosphamide et la ciclosporine A réduisent les complications de la GvHD
La maladie du greffon contre l’hôte (GvHD), cliniquement significative, reste un défi après transplantation de cellules souches, même en cas de donneur·euse apparenté·e compatible et malgré la prophylaxie. L’intérêt d’une prophylaxie par cyclophosphamide après transplantation avec donneur·euse apparenté·e compatible a été évalué dans l’étude BM12-CAST.4
134 patient·es atteint·es de leucémie aiguë (LMA ou LLA) ont été inclus·es et randomisé·es pour recevoir cyclophosphamide + ciclosporine A après transplantation de cellules souches, ou le schéma standard ciclosporine A+méthotrexate en tant que contrôle. Les critères d’évaluation primaires étaient la survie sans GvHD (GRFS) et la DFS.
L’âge moyen des participant·es à l’étude était de 55 à 56 ans, la majorité étant atteint·es de LMA. Concernant le conditionnement: 43 à 44% ont reçu un traitement myéloablatif (MAC) et 56 à 57% un traitement à intensité réduite (RIC). Avec un suivi médian de 36 mois, une GvHD aiguë est survenue chez 6% des patient·es du bras expérimental et une GvHD chronique chez 17%. Dans le bras contrôle, 19% des patient·es ont présenté une GvHD aiguë et 34% une GvHD chronique. Une GvHD aiguë de grade 3 a été observée chez 6,6% contre 14,7% et une GvHD de grade4 chez 0 contre 4,4% des patient·es. Une GvHD chronique modérée est apparue chez 19,7% contre 25,0% et une GvHD chronique sévère chez 1,6% contre 13,2% des malades. 18% contre 23% des patient·es ont rechuté. Dans les deux bras de l’étude, 6% des personnes atteintes sont décédées.
Le taux de GRFS à 3 ans était de 49% avec le cyclophosphamide contre 14% dans le bras témoin (HR: 0,42; 0,27–0,66; p<0,001). Aucun sous-groupe n’a été identifié comme cohorte de patients ne bénéficiant pas davantage du cyclophosphamide par rapport à la prophylaxie standard. L’OS n’a pas atteint la significativité, bien qu’une nette différence numérique favorable au bras expérimental ait été observée (HR: 0,59; IC à 95%: 0,29–1,19; p=0,132). Alors que 4 patient·es (18,2%) sont décédé·es de GvHD dans le bras contrôle, aucun décès n’a été observé dans le bras cyclophosphamide. Les infections ont représenté la principale cause de décès après la rechute de la maladie chez 3 patient·es (23,1%) contre 6 (27,3%). En termes de RFS, cyclophosphamide+ciclosporine A ont donné un résultat significativement supérieur au schéma témoin: après 2 ans, 74% contre 59% des patient·es étaient indemnes de la maladie, avec un risque de rechute réduit de 45% (HR: 0,55; IC à 95%: 0,30–1,00; p=0,045).
Conclusion
L’administration prophylactique de cyclophosphamide + ciclosporine A a prolongé le GRFS par rapport à la ciclosporineA+méthotrexate après transplantation de cellules souches avec donneur·euse apparenté·e compatible, y compris chez les patient·es plus jeunes ayant reçu un conditionnement myéloablatif (MAC). Le schéma cyclophosphamid+ciclosporine A a été bien toléré, sans augmentation de la toxicité précoce ni du risque de rechute.
Source:
Congrès hybride EHA2025 de l’Association européenne d’hématologie, 12–15 juin 2025, Milan, Italie
Littérature:
1 Hochhaus A et al.: Asciminib shows superior tolerability vs nilotinib in newly diagnosed chronic myeloid leukemia in chronic phase (CML-CP): primary endpoint results of the phase 3B ASC4START trial. EHA 2025; Abstr. #S166 2 Dinner SN et al.: Addition of blinatumomab to consolidation therapy for younger adults (< 55 years) with newly diagnosed BCR::ABL1-negative B-acute lymphoblastic leukemia (ALL) on the ECOG-ACRIN E1910 phaseIII trial. EHA 2025; Abstr. #S110 3 Zeidner J et al.: Azacitidine, venetoclax, and revumenib for newly diagnosed older adults with acute myeloid leukemia (AML) and NPM1 mutation or KMT2A rearrangement: updated results from the Beat AML consortium. EHA 2025; Abstr. #S138 4 Curtis D et al.: A phase 3 randomised trial of post-transplant cyclophophamide for GVHD prophylaxis in matched sibling donor peripheral blood stem cell transplantation: the ALLG BM12 CAST trial. EHA 2025; Abstr. #S103
Das könnte Sie auch interessieren:
Traitement innovant des tumeurs hépatiques primitives et secondaires
La chimiothérapie intra-artérielle constitue une extension efficace de l’éventail des traitements des tumeurs malignes hépatiques primitives et secondaires avancées. La chimiothérapie ...
Résultats finaux de l’étude CheckMate-901 – Analyse de sous-groupe pour l’étude EV-302/KEYNOTE-A39
Les résultats finaux de l’étude CheckMate-901 confirment, avec une durée de suivi de plus de 5 ans, l’avantage en termes de survie de l’immunothérapie par rapport à la chimiothérapie ...
Les données de l’ASCO redéfinissent lesnormes
Le traitement par T-DXd s’est révélé supérieur au ramucirumab plus paclitaxel dans l’étude DESTINY-Gastric04. Le conjugué anticorps-médicament est désormais le standard de deuxième ligne ...