Extension des options dans toutes les lignes de traitement
Compte-rendu: Dre méd. Judith Moser
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Une grande variété de données d’études prospectives a été discutée lors de la World Conference on Lung Cancer (WCLC), qui s’est tenue à Barcelone du 6 au 9 septembre 2025 et a attiré plus de 7700 participant·es. L’accent a été mis, entre autres, sur l’utilisation de substances établies et nouvelles dans différentes lignes, ainsi que sur l’amélioration de la planification thérapeutique grâce à la détermination de la «maladie résiduelle minimale» (MRD).
Chimio-immunothérapie adjuvante
Même après une résection complète et un traitement adjuvant, les taux de récidive restent élevés aux stades précoces du cancer du poumon non à petites cellules (NSCLC). Lors du WCLC 2025, Provencio et al. ont présenté les données intermédiaires de l’étude NADIM-ADJUVANT, première étude de phaseIII à démontrer l’effet d’une chimio-immunothérapie après résection de tumeurs de stadeIB–IIIA.1
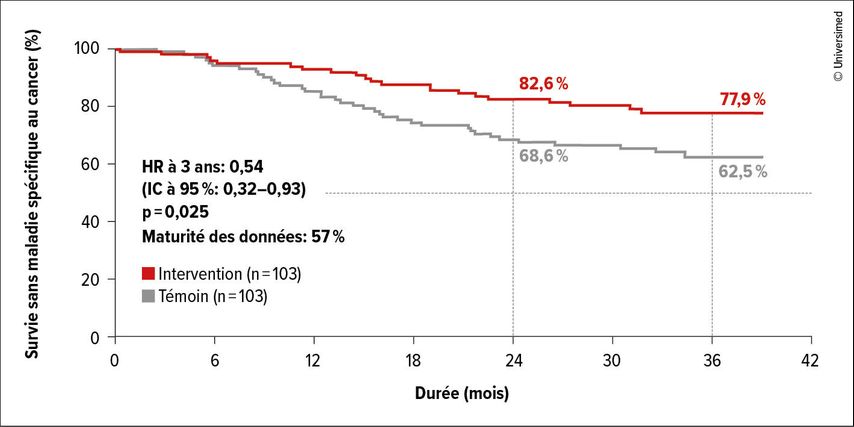
Dans le bras expérimental (n=103), le nivolumab a été administré toutes les trois semaines, associé à une chimiothérapie pendant quatre cycles, suivis de six cycles d’entretien par nivolumab; dans le bras témoin (n=103), seule la chimiothérapie a été utilisée. Concernant la survie sans maladie (DFS), un critère d’évaluation primaire, la médiane n’était pas encore atteinte dans les deux bras, mais une baisse significative de la tendance à la récidive était déjà observable dans le bras expérimental, avec des taux de DFS de 73,3% contre 59,9% à 36 mois (HR: 0,65; p=0,085). Selon une analyse de sensibilité spécifique au cancer, les taux de DFS à 36 mois étaient de 77,9% contre 62,5% (HR: 0,54; p=0,025; Fig.1). Une analyse à partir du jour 90 après la résection de la tumeur a montré un avantage significatif de la chimio-immunothérapie, avec des taux à 36 mois de 74,7% vs 60,1% (HR: 0,60; p=0,048).
Fig.1: Analyse de sensibilité de la survie sans maladie spécifique au cancer dans l’étude NADIM-ADJUVANT (modifiée selon Provencio M et al.)1
Dans le bras expérimental, les récidives locales comme les récidives à distance étaient moins fréquentes que dans le bras témoin. L’administration de l’ensemble des cycles thérapeutiques adjuvants était associée à un bénéfice clair (HR: 0,55), tandis qu’un arrêt prématuré n’apportait aucun avantage (HR: 2,03).
La négativité de la MRD selon le test Guardant-RevealTM au début de l’étude (environ 90% dans chaque bras) corrélait avec des taux de DFS supérieurs à ceux observés en cas de MRD positive. Dans le groupe MRD négatif, la combinaison a entraîné un bénéfice significatif en termes de DFS (HR: 0,31; p=0,043). Dans le bras expérimental, la médiane de DFS n’était pas encore atteinte dans le groupe MRD négatif et était de 18,9 mois dans le groupe MRD positif (HR: 5,7; p=0,045).
Les effets indésirables liés au traitement (TRAE) de grade3/4 étaient plus fréquents dans le bras expérimental que dans le bras témoin pendant la phase adjuvante (26,2% vs 14,5%). L’arrêt du traitement pour TRAE a concerné 7,7% des patient·es contre 3,8%. Dans l’ensemble, le profil des effets indésirables correspondait aux données connues sur des chimio-immunothérapies. Si ces résultats se confirment à long terme, le nivolumab plus chimiothérapie pourrait constituer un nouveau standard adjuvant pour les NSCLC précoces.
NAUTIKA1:
administration néoadjuvante d’alectinib
Des stratégies néoadjuvantes ciblées sont en cours d’évaluation dans l’étude de phaseII Umbrella NAUTIKA1 chez des patient·es atteint·es de NSCLC.
Lee et al. ont présenté les résultats d’une cohorte de tumeurs ALK-positives de stadeIB–IIIB ayant reçu de l’alectinib préopératoire pendant huit semaines.2
En postopératoire, jusqu’à quatre cycles de chimiothérapie à base de platine suivis d’alectinib étaient administrés pendant un maximum de deux ans. 30 patient·es ont débuté le traitement néoadjuvant, 27 ont été opéré·es et 21 ont reçu un traitement adjuvant.
L’analyse histologique des pièces opératoires a révélé une régression pathologique robuste en réponse à la prise néoadjuvante d’alectinib. Le taux de réponse pathologique majeure (MPR) était de 60,7%, avec 25,0% de rémissions pathologiques complètes. Selon l’imagerie, 63,3% des patient·es ont répondu au traitement néoadjuvant et 30,0% présentaient une stabilisation de la maladie. Un downstaging radiologique est survenu dans 43,3% des cas, et un downstaging pathologique ganglionnaire dans 33,3%. Le taux de résection R0 était élevé, à 92,6%.
L’alectinib néoadjuvant s’est révélé bien toléré. Aucun nouveau signal de sécurité ni aucune complication peropératoire n’a été observé. En plus de son indication établie en adjuvant, l’alectinib pourrait à l’avenir être utilisé en néoadjuvant, permettant aux patient·es atteint·es d’un NSCLC résécable ALK-positif de stadeIB–IIIB de bénéficier d’une stratégie ciblée périopératoire.
MRD & résultats dans NeoADAURA
L’osimertinib néoadjuvant, avec ou sans chimiothérapie complémentaire, a montré une amélioration significative du TPM dans l’étude NeoADAURA chez les patient·es atteint·es de NSCLC résécable à EGFR muté, par rapport à la chimiothérapie néoadjuvante seule.3
L’analyse des données de l’étude présentée au WCLC 2025 a évalué la corrélation entre MRD et MPR ainsi qu’avec la survie sans événement (EFS).4
Sur la base du «whole genome sequencing» de l’ADN tumoral et germinal, des panels individualisés de MRD ont été élaborés pour chaque patient·e; la MRD a ensuite été monitorée via le dosage plasmatique NeXT-Personal®. Un peu plus de 60 personnes ont été analysées dans chacun des trois bras.
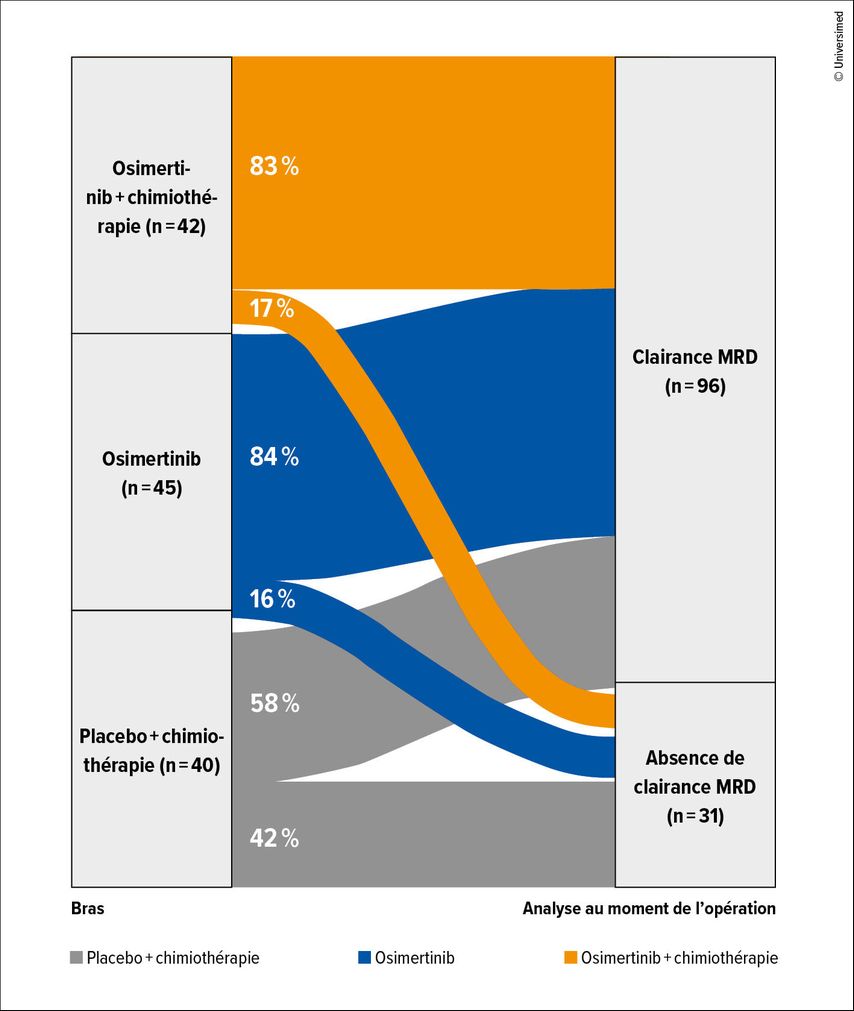
Les patient·es MRD négatif·ves au début de l’étude sont resté·es plus longtemps sans événement: à 18 mois, l’EFS atteignait 96%, contre 82% chez les patient·es initialement MRD positif·ves. La clairance de la MRD était définie comme une réduction de l’ADNc d’un facteur 10 ou comme une négativité préopératoire après positivité initiale. Cette clairance de la MRD est principalement survenue sous traitements à base d’osimertinib (Fig.2) et était associée à un taux de MPR significativement plus élevé que l’absence de clairance dans l’ensemble du collectif (24% vs 6%; p=0,0378).
Fig.2: Clairance de la MRD sous traitement néoadjuvant contenant de l’osimertinib vs chimiothérapie (modifiée selon Blakely CM et al.)4
Des résultats similaires ont été observés pour la MRD préopératoire négative, plus fréquente dans les bras osimertinib et associée à la MPR (20% vs 9% en cas de MRD positive; p=0,0546). Comme le soulignent les auteur·es, ces données mettent en évidence l’utilité potentielle du test de MRD en complément de la MPR dans les schémas thérapeutiques néoadjuvants contenant de l’osimertinib.
FLAURA2: analyse finale de l’OS
Dans l’étude de phaseIII FLAURA2, il avait déjà été démontré que l’ajout d’une chimiothérapie à base de platine à l’osimertinib de première ligne dans les NSCLC avancés EGFR-mutés prolongeait significativement la survie sans progression (PFS) par rapport à l’osimertinib seul.5
L’analyse finale de la survie globale (OS) confirme désormais la supériorité de la combinaison, avec une différence médiane de dix mois (47,5 vs 37,6 mois; HR: 0,77; p=0,02).6
Après quatre ans, 49% des patient·es étaient en vie contre 41%. Le bénéfice en OS était cohérent dans les sous-groupes, indépendamment du type de mutation EGFR (délétion de l’exon 19 vs mutation L858R) et de la présence de métastases du SNC.
L’analyse a également montré que le bras combinaison bénéficiait d’une période prolongée sans chimiothérapie. L’osimertinib a été administré pendant 30,5 mois en médiane (contre 21,2 mois en monothérapie), le platine pendant 2,8 mois et le pemetrexed pendant 8,3 mois. La première thérapie de suivi la plus fréquente dans les deux bras était une chimiothérapie à base de platine; même si celle-ci a suivi l’osimertinib seul dans 72% des cas dans le bras témoin, la combinaison demeurait supérieure pour l’OS dans le bras expérimental.
Au cours d’un suivi supplémentaire de plus de deux ans depuis l’analyse primaire, aucun nouveau signal de sécurité n’est apparu et aucun décès causé par un EI lié au traitement n’a été observé dans le bras expérimental (vs un cas dans le bras témoin). Les taux d’arrêt de l’osimertinib pour effets indésirables restaient faibles. Dans l’ensemble, l’analyse finale d’OS de l’étude FLAURA2 confirme l’importance d’osimertinib plus chimiothérapie comme standard thérapeutique de première ligne dans le NSCLC avancé EGFR-positif.
Ivonescimab plus chimiothérapie
L’étude de phaseIII HARMONi évalue l’ivonescimab, anticorps bispécifique ciblant PD-1 et VEGF-A, dans le NSCLC avancé EGFR-positif après progression sous inhibiteur de tyrosine kinase EGFR de troisième génération.7
Au total, 219 patient·es ont reçu soit ivonescimab plus chimiothérapie, soit placebo plus chimiothérapie. Environ 70% des patient·es étaient d’origine asiatique; près de 25% présentaient des métastases cérébrales. Les critères d’évaluation coprimaires étaient l’OS et la PFS évaluées par un comité radiologique indépendant.
Concernant la PFS, l’ajout d’ivonescimab a apporté un bénéfice statistiquement significatif et cliniquement pertinent après un suivi médian de 22,3 mois, avec une réduction du risque de 48% (6,8 vs 4,4 mois; HR: 0,52; p<0,0001). Tous les sous-groupes ont bénéficié de cette combinaison. Chez les patient·es présentant des métastases cérébrales à l’inclusion, la réduction du risque de progression atteignait 66% (HR: 0,34). Une proportion plus importante de patient·es traité·es a répondu au traitement dans le bras expérimental (45% vs 34%), avec une durée de réponse notablement prolongée par rapport au bras témoin (7,6 vs 4,2 mois).
Pour l’OS, une tendance favorable à la combinaison a été observée (16,8 vs 14,0 mois; HR: 0,79; p=0,057). Une analyse post-hoc incluant les patient·es nord-américain·es et européen·nes après un suivi prolongé a montré des résultats cohérents, avec un allongement numérique de l’OS de trois mois (17,0 vs 14,0 mois). Dans cette population occidentale, tous les sous-groupes ont également bénéficié de l’ajout d’ivonescimab.
L’association a été bien tolérée: les effets indésirables liés au traitement (TRAE) ont entraîné des arrêts de traitement (7,3% vs 5,0%) et des décès (1,8% vs 2,3%) dans des proportions comparables entre les deux bras. Les événements immuno-associés et les EI typiques de l’inhibition du VEGF étaient majoritairement de faible grade.
ADC Iza-Bren: données préliminaires
Le conjugué anticorps-médicament (ADC) Iza-Bren (BL-B01D1) associe un anticorps bispécifique ciblant EGFR et HER3 à un nouvel inhibiteur de topo-I.
Lors du WCLC 2025, Zhou et al. ont présenté les données de phaseII évaluant Iza-Bren à différentes doses, en association avec l’osimertinib oral en première ligne chez des patient·es atteint·es d’un NSCLC avancé EGFR-muté.8
Au total, 154 patient·es ont reçu Iza-Bren aux doses de 2,2mg/kg, 2,5mg/kg ou 2,75mg/kg aux jours 1 et 8 d’un cycle de trois semaines, ou 4,0mg/kg ou 4,5mg/kg toutes les trois semaines.
L’association d’osimertinib + Iza-Bren 2,2–2,75mg/kg présentait un profil de sécurité favorable et gérable. Les TRAE les plus fréquemment observés étaient les cytopénies, les nausées et les stomatites. Les EI de grade élevé étaient principalement liés aux neutropénies, contrôlées par des mesures appropriées. Des réductions de dose pour neutropénie ont été nécessaires chez 11,4% des patient·es, et 0,8% ont interrompu le traitement.
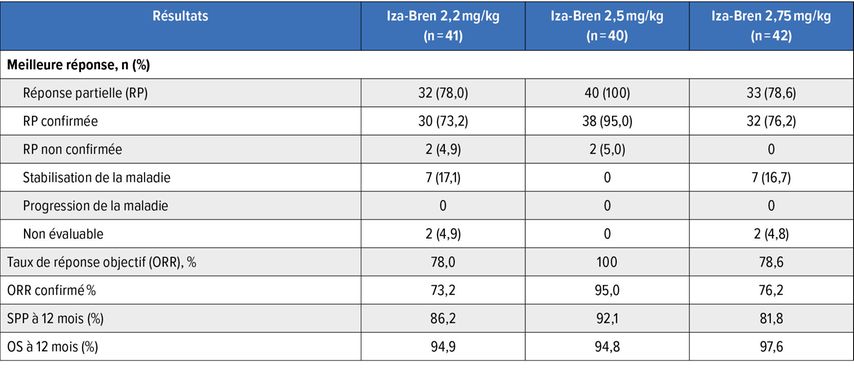
L’efficacité suggère une activité antitumorale préliminaire encourageante. Sous la dose de 2,5mg/kg, le taux de réponse était de 100%; à 12 mois, 94,8% des patient·es étaient vivant·es et 92,1% sans progression (Tab.1). Au total, 85,4% des personnes traitées avec les doses de 2,2 à 2,75mg/kg ont présenté une réponse objective. La durée médiane de réponse n’était pas encore atteinte au moment de l’analyse. Une étude de phaseIII est en cours en Chine, évaluant Iza-Bren 2,5mg/kg aux jours 1 et 8 d’un cycle de trois semaines, en association avec l’osimertinib en première ligne du NSCLC EGFR-muté.
CAN-2409/valaciclovir: OS notable dans le NSCLC
Dans le NSCLC avancé avec réponse inadéquate aux inhibiteurs de points de contrôle immunitaire (ICI), une étude de phaseIIa a évalué l’adénovirus intratumoral CAN-2409, incapable de se répliquer.9 Les patient·es ayant répondu >18 semaines aux ICI par stabilisation (n=5) ou progression (n=41) de la maladie ont reçu deux injections intratumorales de CAN-2409 à six semaines d’intervalle, associées à une administration de valaciclovir oral pendant deux semaines, en plus de la poursuite du traitement par ICI.
Le profil de sécurité et de tolérance était favorable: les TRAE étaient principalement de grade 1–2, et moins de 5% des patient·es ont développé des TRAE de grade 3. Aucune toxicité limitant la dose ni de TRAE de grade4–5 n’ont été observés. Les EI les plus courants étaient fatigue, nausées et fièvre. Dans la cohorte avec maladie en progression, l’OS médiane atteignait 21,5 mois. Chez les patient·es présentant une histologie non maligne, l’OS médiane était de 25,4 mois.
Des effets abscopaux – réduction des lésions non traités – ont été observés chez deux tiers des patient·es, suggérant l’induction d’une immunité antitumorale systémique et durable. Au total, 37% des participant·es à l’étude étaient en vie plus de deux ans après le traitement. Les auteur·es estiment qu’une étude randomisée de phaseIII chez les patient·es atteint·es de tumeurs non malignes est justifiée.
Source:
IASLC 2025 World Conference on Lung Cancer (WCLC) 2025, 6–9 septembre 2025, Barcelone, Espagne
Littérature:
1 Provencio M et al.: Adjuvant chemotherapy (CT) vs CT-immunotherapy for R0 stage IB-IIIA NSCLC patients (NADIM ADJUVANT): a randomized, phase 3 trial. WCLC 2025; Abstr. #PL03.10 2 Lee JM et al.: Nautika1: clinical outcomes and pathologic regression with neoadjuvant alectinib in resectable stage IB-IIIB ALK + NSCLC. WCLC 2025; Abstr. #MA04.02 3 He J et al.: Neoadjuvant osimertinib for resectable EGFR-mutated non-small cell lung cancer. JClin Oncol 2025; 43(26): 2875-87 4 Blakely CM et al.: Molecular residual disease (MRD) analysis from NeoADAURA: neoadjuvant osimertinib ± chemotherapy in resectable EGFRm NSCLC. WCLC 2025; Abstr. #OA02.02 5 Planchard D et al.: Osimertinib with or without chemotherapy in EGFR-mutated advanced NSCLC. N Engl J Med 2023; 389(21): 1935-48 6 Planchard D et al.: First-line osimertinib + chemotherapy versus osimertinib monotherapy in EGFRm advanced NSCLC: FLAURA2 final overall survival. WCLC 2025; Abstr. #PL02.06 7 Goldman JW et al.: Ivonescimab vs placebo plus chemo, phase 3 in patients with EGFR+ NSCLC progressed with 3rd gen EGFR-TKI treatment: HARMONi. WCLC 2025; Abstr. #PL02.12 8 Zhou F et al.: Phase II study of iza-bren (BL-B01D1) combo with osimertinib in EGFR mutated locally advanced or metastatic NSCLC patients. WCLC 2025; Abstr. #OA10.04 9 Aggarwal C et al.: CAN-2409 with continued immune checkpoint inhibitor (ICI) in patients with stage III/IV NSCLC with inadequate response to ICI. WCLC 2025; Abstr. #MA10.02
Das könnte Sie auch interessieren:
De nouvelles données sur le cancer du sein précoce qui améliorent la thérapie dans la pratique
Les résultats présentés lors du congrès ESMO de cette année concernant le traitement du cancer du sein précoce vont modifier les standards thérapeutiques, tant pour les patient·es HER2- ...
Traitements efficaces pour l’adénocarcinome de l’estomac et de la jonction œsogastrique
Dans le domaine des tumeurs gastro-intestinales, des progrès ont été réalisés, en particulier dans le traitement des patient·es atteint·es d’adénocarcinome de l’estomac et de la jonction ...
Intégration: précoce, progressive, conjointe ou (trop) tardive?
Les nouveaux traitements anticancéreux modifient également l’approche des soins palliatifs. Plus la durée de survie augmente, plus l’accent est mis sur la qualité de vie. Le moment de l’ ...