Embolie pulmonaire: signes pour le parcours thérapeutiques
Auteur:
Pr Dr méd. Lars C. Huber
Leiter Departement Innere Medizin
Stadtspital Zürich
E-mail: lars.huber@stadtspital.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
L’embolie pulmonaire est une pathologie fréquente et potentiellement fatale. Le diagnostic d’embolie pulmonaire reste un défi, car il reste l’un des diagnostics les plus souvent manqués. Cet aperçu fournit des signes cliniques qui peuvent être utiles dans le parcours thérapeutique, de la suspicion au diagnostic et au traitement.
Keypoints
-
L’incidence de l’embolie pulmonaire n’a cessé d’augmenter au cours des dernières années. Parallèlement, la mortalité est en baisse.
-
Il existe des scores cliniques validés pour établir le diagnostic, stratifier le risque et évaluer la durée du traitement. Ils peuvent être utiles, mais ne remplacent pas l’évaluation clinique individualisée.
-
Dans le cas d’une embolie pulmonaire à faible risque avec instabilité hémodynamique, la pertinence d’examens complémentaires basés sur des dispositifs (notamment l’échocardiographie de routine) est surestimée. L’importance des tests de la coagulation est également faible.
-
Aujourd’hui, le traitement utilise généralement des AOD, souvent le rivaroxaban ou l’apixaban.
Épidémiologie
L’embolie pulmonaire fait partie, avec la thrombose veineuse profonde (TVP), du spectre de la maladie thrombo-embolique veineuse (MTEV). Les deux manifestations sont à peu près aussi fréquentes l’une que l’autre, avec une légère prédominance de la TVP (Fig.1). Les études d’incidence montrent un risque lié à l’âge: plus l’âge est avancé, plus la fréquence est élevée, avec une augmentation légèrement plus marquée chez les hommes. Globalement, l’incidence annuelle de la MTEV est d’environ 1:2000. Cela correspond à 8000–10000 embolies pulmonaires par an en Suisse. Malgré une incidence croissante, il est intéressant de noter que la mortalité de l’embolie pulmonaire est en baisse ces dernières années, indiquant un éventuel surdiagnostic. La mortalité de l’embolie pulmonaire à haut risque avec instabilité hémodynamique a toutefois augmenté au cours des dernières années. La cause n’est pas claire.
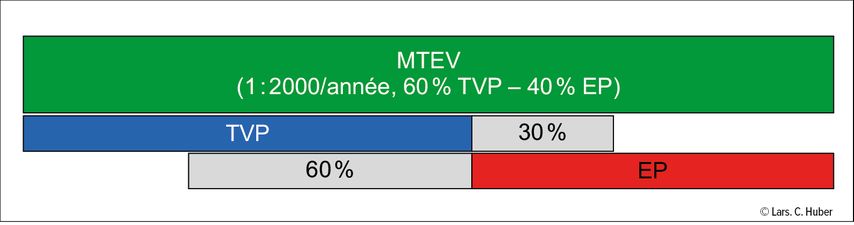
Fig.1: Spectre de la maladie thrombo-embolique veineuse (MTEV). La MTEV (barre verte) comprend la thrombose veineuse profonde (TVP, barre bleue) et l’embolie pulmonaire (EP, barre rouge). Jusqu’à 30% des patient·es atteint·es de TVP présentent également une EP, généralement asymptomatique. Inversement, l’EP s’accompagne d’une TVP dans jusqu’à 60% des cas, elle aussi souvent asymptomatique. L’exclusion mutuelle est inutile dans la pratique clinique quotidienne, car il s’agit dans les deux cas de la même entité clinique avec un traitement identique.
Symptômes, évaluation initiale et biais cognitif
Les principaux symptômes d’une embolie pulmonaire aiguë sont une dyspnée aiguë, une douleur thoracique pleurétique et une syncope. Cette dernière survient dans environ 10 à 15% des cas. Un gonflement unilatéral des jambes à l’examen clinique suggère la présence d’une embolie pulmonaire lorsque les patient·es se présentent avec les principaux symptômes mentionnés ci-dessus. Inversement, il est important de noter l’absence d’embolie pulmonaire dans la plupart des cas de dyspnée aiguë. Il en va de même pour la syncope. Ces deux raisons sont fréquentes et justifient une visite aux urgences. L’évaluation initiale comprend généralement une radiographie thoracique, un ECG et une gazométrie artérielle. Ces modalités n’ont toutefois pas vraiment pour objectif de confirmer ou d’exclure une embolie pulmonaire, car la sensibilité et la spécificité sont faibles pour tous les examens. La radiographie sert en premier lieu à rechercher d’autres causes, telles qu’une pneumonie, une insuffisance cardiaque ou un pneumothorax. Cependant, les infiltrats pleuraux peuvent aussi correspondre à des infarctus pulmonaires hémorragiques consécutifs à des embolies pulmonaires périphériques de petite taille («Hampton’s hump»). L’ECG fournit un large éventail de résultats non spécifiques, tels que la tachycardie, le bloc de branche droit ou l’aspect S1Q3T3 («McGinn-White sign»). Chez les patient·es présentant une dyspnée aiguë et un ECG avec un aspect S1Q3T3, une embolie pulmonaire est uniquement présente dans la moitié des cas. La gazométrie artérielle révèle souvent une hypoxémie, une hypocapnie et une augmentation du gradient alvéolo-artériel. Des résultats normaux n’excluent toutefois en aucun cas la présence d’une embolie pulmonaire.
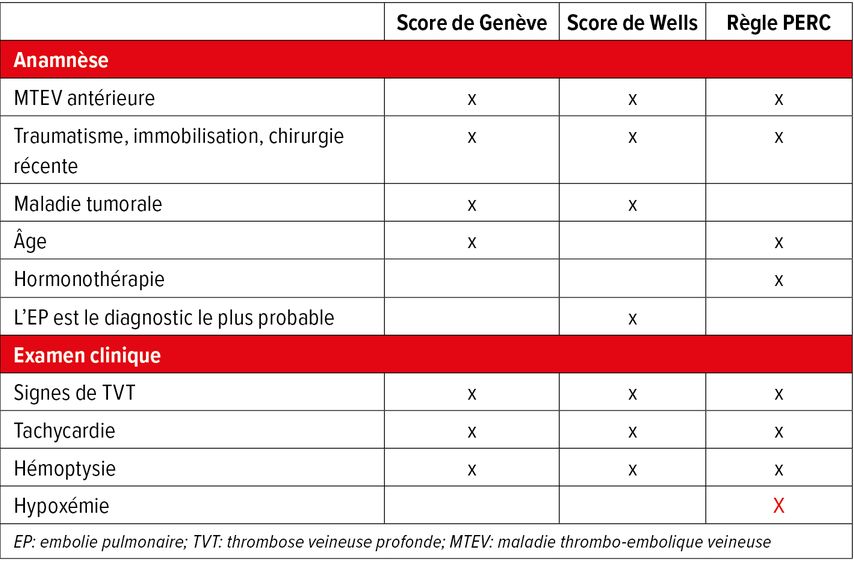
La détermination de la probabilité pré-test peut se faire par des scores cliniques (p.ex. score de Wells, score de Genève, critères YEARS; Tab. 1) ou par l’évaluation médicale («gestalt diagnosis», jugement clinique global). Les scores sont validés et peuvent être utiles au quotidien. Pour les médecins expérimenté·es, la «gestalt diagnosis» est équivalente aux scores. Personnellement, j’utilise toujours la «gestalt diagnosis», car elle me permet de formuler une probabilité pré-test en tenant compte de toutes les informations disponibles. La procédure d’évaluation est présentée dans la Figure 2.
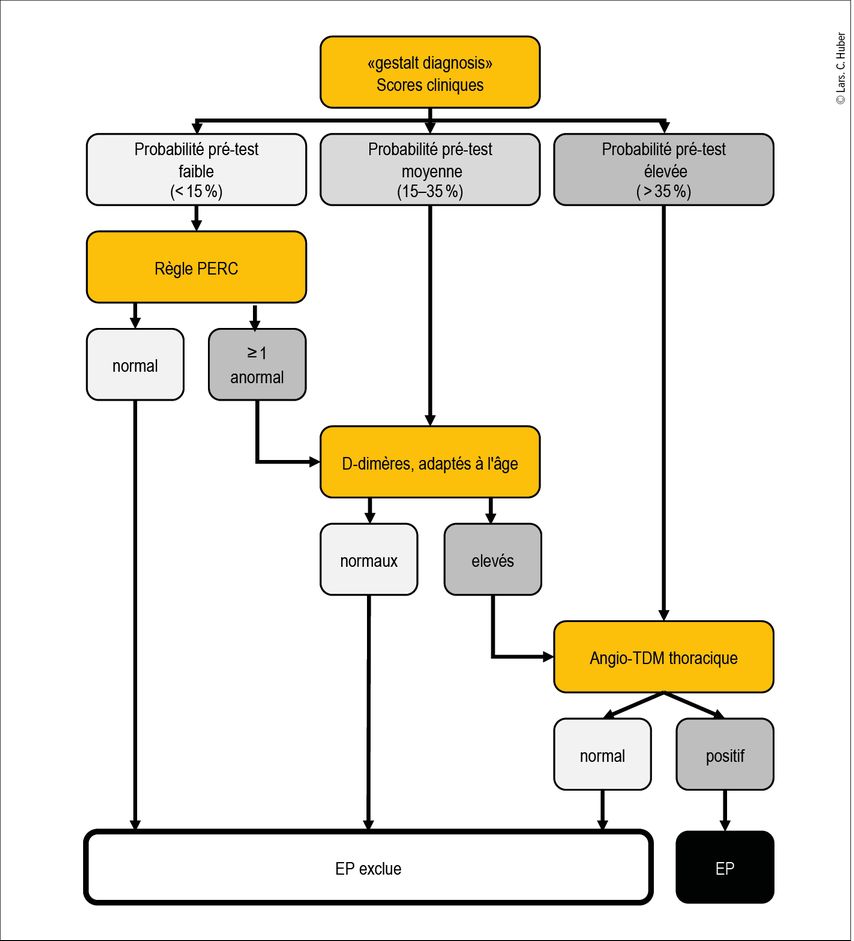
Fig.2: Algorithme d’évaluation en cas de suspicion d’embolie pulmonaire. La détermination de la probabilité pré-test se fait par l’évaluation médicale («gestalt diagnosis») ou par les scores cliniques établis. Si la probabilité pré-test est faible, la règle PERC peut être utilisée pour le diagnostic d’exclusion; si elle est moyenne, les D-dimères sont déterminés. Une probabilité pré-test élevée d’une embolie pulmonaire nécessite directement une imagerie diagnostique par angio-TDM
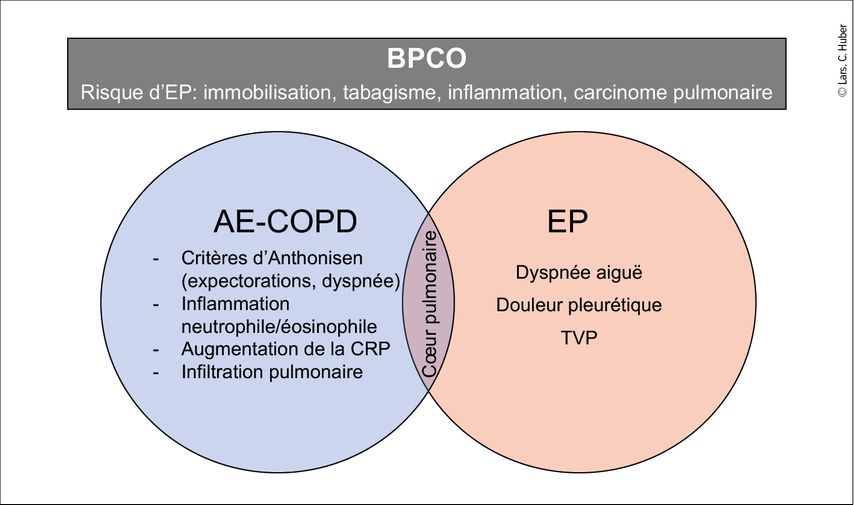
Les biais cognitifs constituent un problème central lors de la pose du diagnostic: le biais d’ancrage chez les patient·es présentant des diagnostics déjà établis, tels qu’une insuffisance cardiaque ou une BPCO (Fig.3), semble réduire la probabilité d’une embolie pulmonaire, alors qu’il s’agit en fait de facteurs de risque pour une MTEV. L’impression subjective des médecins peut également conduire à des erreurs de jugement. Chez les patient·es souffrant de dyspnée aiguë, mais souriant·es, un diagnostic alternatif est par exemple plus probable.
Fig.3: Biais d’ancrage et «pensée en silo» clinique. Les patient·es atteint·es de BPCO présentent des facteurs de risque importants pour le développement d’une MTEV. Chez les patient·es hospitalisé·es diagnostiqué·es d’une BPCO avec exacerbation aiguë (AE-COPD), jusqu’à 30% présentent une EP. Les signes d’alerte sont une augmentation de la dyspnée comme seul critère d’Anthonisen rempli, sans modification significative de la quantité et de la qualité des expectorations, avec une activité inflammatoire systémique globalement faible
Stratification du risque
La classification selon le risque a des conséquences directes sur le traitement. Le score PESI permet d’identifier les patient·es à faible risque qui peuvent être traité·es en ambulatoire, une option qui est encore trop rarement utilisée. L’utilisation de l’échocardiographie pour une évaluation supplémentaire du risque est controversée. Les études ne montrent aucun avantage en termes de survie, mais des coûts ultérieurs plus élevés lorsque l’échocardiographie est utilisée systématiquement chez les patient·es à faible risque avec instabilité hémodynamique. Une indication importante de l’échocardiographie est l’évaluation des patient·es présentant un syndrome post-embolie pulmonaire. Cette entité, sans définition claire, concerne environ 10% des patient·es après une embolie pulmonaire aiguë. Si les symptômes persistent malgré un traitement adéquat >3 mois après la phase aiguë, il faut exclure une hypertension pulmonaire thromboembolique chronique (HTPC). Il s’agit d’une forme potentiellement curative d’hypertension pulmonaire.
Traitement: quel médicament, quelle durée, quelle dose?
Le traitement s’oriente autour de trois questions centrales:
Quel médicament? En règle générale, on utilise des anticoagulants oraux directs (AOD). L’apixaban semble avoir un profil de sécurité plus favorable que le rivaroxaban (surtout chez les patient·es âgé·es présentant des hémorragies gastro-intestinales). Il présente des taux stables dans l’intervalle thérapeutique cible même en cas de prise inadéquate (p. ex. dose supplémentaire ou dose oubliée) et peut être pris indépendamment des repas.
Quelle durée? La durée du traitement dépend de la cause. En cas de facteurs de risque importants réversibles (p. ex. intervention chirurgicale majeure), le traitement peut être arrêté après 3 mois. En cas de facteurs de risque importants persistants (p. ex. tumeur maligne), le traitement doit être poursuivi sur le long terme sans date d’arrêt définie. En cas de facteurs de risque mineurs ou d’événements non provoqués, des scores (p. ex. VTE-PREDICT) peuvent aider à évaluer le risque de récidive et donc la durée du traitement.
Quelle dose pendant la phase de traitement prolongé (> 6 mois)? Une dose prophylactique réduite (p. ex. apixaban à 2 x 2,5 mg) est efficace et sûre chez les patient·es atteint·es de tumeurs, selon l’étude API-CAT.
Examen de la coagulation
Le diagnostic de thrombophilie n’a qu’une importance limitée dans la prise en charge de l’embolie pulmonaire. Les principaux signes d’une thrombophilie héréditaire sont fournis par l’anamnèse: jeune âge lors du premier événement (<50 ans), antécédents familiaux chez les parents au premier degré, localisation inhabituelle de la MTEV ou des thromboses artérielles, événements récurrents. Dans la plupart des cas, les analyses de laboratoire n’influencent ni la décision thérapeutique ni la durée du traitement. Une exception importante est le syndrome des antiphospholipides, pour lequel les antagonistes de la vitamine K sont recommandés. Le bilan de thrombophilie doit donc être utilisé de manière ciblée et avec retenue.
Littérature:
● Arrigo M, Huber LC: Pulmonary Embolism and heart failure: A reappraisal. Card Fail Rev 2021; 7: e03 ● Arrigo M et al.: Diagnosis and treatment of right ventricular failure secondary to acutely increased right ventricular afterload (acute cor pulmonale). A Clinical Consensus Statement of the Association for Acute CardioVascular Care (ACVC) of the ESC. Eur Heart J Acute Cardiovasc Care 2023; 13: 304-12 ● Arrigo M, Huber LC: Vaskuläre Dyspnoe: Lungenembolie. Ther Umsch 2023; 80: 265-70 ● Stüssi-Helbling M et al.: Pearls and myths in the evaluation of patients with suspected acute pulmonary embolism. Am J Medicine 2019; 132: 685-91
Littérature supplémentaire auprès de l’auteur
Das könnte Sie auch interessieren:
Plus qu’un problème de sécheresse: gros plan sur la maladie de Sjögren
La maladie de Sjögren est une maladie auto-immune systémique inflammatoire chronique présentant une grande variabilité clinique. Elle fait partie de la famille des collagénoses, à ...
Le Pelargonium sidoides est-il une option thérapeutique chez les enfants atteints du syndrome mains-pieds-bouche?
Une étude a examiné pour la première fois l’extrait de racine de Pelargonium sidoides EPs®7630 chez des enfants atteints du syndrome mains-pieds-bouche et a démontré une réduction ...
Prise en charge des acouphènes en 2025
Le traitement des acouphènes a évolué au cours des dernières années. Les directives de l’AWMF sur la prise en charge des acouphènes proposent des recommandations fondées sur des preuves ...