Wozu soll man bei einem auffälligen Ergebnis raten?
Autorinnen:
Dr. med. Valeria Filippi
Prof. Gwendolin Manegold-Brauer
Geburtshilfe und Pränatalmedizin
Gyn. Sonographie und Pränataldiagnostik Frauenklinik Universitätsspital Basel
Korrespondenz:
E-Mail: valeria.filippi@usb.ch
Nichtinvasive Pränataltests (NIPT) sind aus der modernen Schwangerenbetreuung kaum mehr wegzudenken. Sie bieten hohe Genauigkeit hinsichtlich der häufigsten Trisomien, und die Risiken einer invasiven Diagnostik können vermieden werden. Die Ergebnisse müssen aber kritisch eingeordnet werden: Basis des NIPT ist die zellfreie fetale DNA, die im Wesentlichen von der Plazenta und nicht vom Fetus stammt. Falsch positive und falsch negative Resultate sind deswegen möglich. Entscheidend sind daher die richtige Indikations-stellung, die Berücksichtigung der Ultraschallbefunde und eine präzise Beratung, die die Möglichkeiten, aber auch die Grenzen des NIPT einbezieht.
Keypoints
-
Der NIPT ist heute ein wertvoller Screeningtest in der Pränataldiagnostik, sollte aber nur bei unauffälligem Ultraschall eingesetzt werden.
-
Bei auffälligen sonografischen Befunden (wie z.B. auch einer erhöhten Nackentransparenz) ist eine invasive Diagnostik empfohlen.
-
Der NIPT analysiert zellfreie DNA, die hauptsächlich aus der Plazenta stammt und nicht direkt vom Kind (nicht immer 100% identisch).
-
Falsch positive Befunde entstehen vor allem durch plazentare Mosaike, aber auch durch «vanishing twins» oder maternale Erkrankungen.
-
Auffällige Ergebnisse sollten immer durch einen diagnostischen Test (Amniozentese oder Chorionzottenbiopsie) bestätigt werden.
Die Einführung der NIPT markiert einen Meilenstein in der pränatalen Diagnostik. Der Test analysiert zellfreie DNA im mütterlichen Blut, die überwiegend aus dem Trophoblasten stammt. Damit lassen sich insbesondere Trisomie 21, 18 und 13 mit hoher Sensitivität detektieren. Für Trisomie 21 liegt die Detektionsrate >99%, für Trisomie 18 und 13 geringfügig darunter. Der Vorteil im Vergleich zu klassischen Screeningverfahren wie dem Ersttrimestertest (ETT) liegt in der niedrigen Falschpositiv-Rate. Doch der NIPT bleibt ein Screeningverfahren: Der positiv prädiktive Wert (PPV) hängt stark von der Vortestwahrscheinlichkeit und der getesteten Chromosomenstörung ab. In Hochrisikokollektiven für die Trisomie 21 (z.B. fortgeschrittenes maternales Alter) ist die Chance, dass sich ein auffälliger NIPT in der invasiven Diagnostik bestätigt, deutlich höher als in Niedrigrisikogruppen.1
Ursachen für diskordante NIPT-Ergebnisse
Plazentare und fetale Mosaike
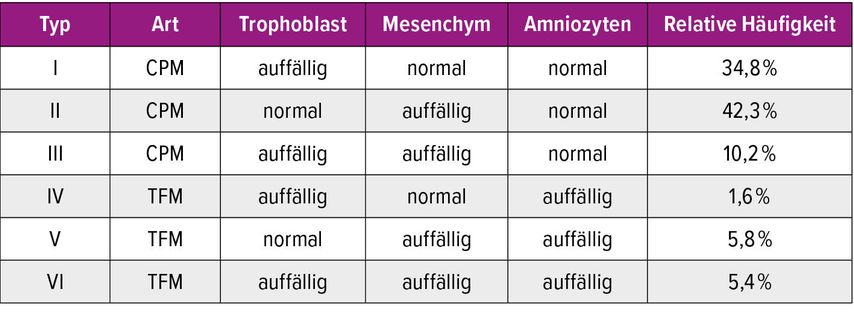
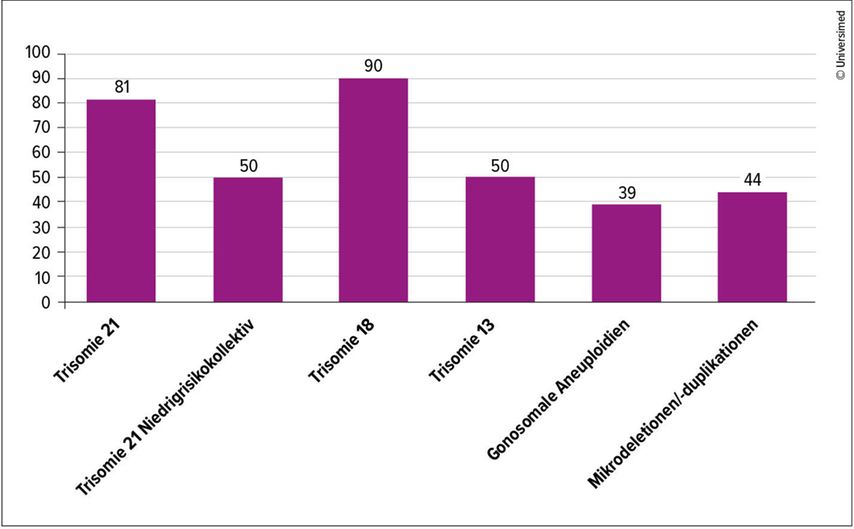
In den meisten Fällen ist der Chromosomensatz der Plazenta und des Fetus gleich. In 1–2% der Fälle treten aber Mosaizismen auf, bei denen Plazenta und Fetus unterschiedlich sind.2 «Confined placental mosaicism» (CPM) bezeichnet das Vorliegen einer Chromosomenanomalie ausschliesslich in der Plazenta, während der Fetus selbst einen unauffälligen Karyotyp hat. Dieses Phänomen entsteht sehr früh in der Embryonalentwicklung, wenn sich Trophoblast und Embryoblast voneinander trennen und es zu fehlerhaften Chromosomenverteilungen bei der Zellteilung kommt. Entscheidend ist, dass NIPT die DNA aus dem Trophoblasten analysiert und damit ausschliesslich das plazentare Genom widerspiegelt. Es kann daher Mosaike der Plazenta anzeigen, die im Fetus gar nicht existieren (falsch positiv), und gleichzeitig echte fetale Mosaike übersehen, wenn die Plazenta keine entsprechenden Anteile trägt (falsch negativ).3 Wie in Tabelle 1 gezeigt, kann CPM vom Typ I oder Typ III im NIPT auffällig erscheinen, obwohl der Fetus gesund ist. Dagegen bleibt CPM vom Typ II im NIPT unentdeckt, da die Chromosomenveränderung lediglich im Mesenchym der Chorionzotten liegt und somit im zellfreien DNA-Test nicht auffällt. Auch ein sogenannter echter fetaler Mosaizismus («true fetal mosaicism»[TFM]), bei dem Plazenta und Fetus unterschiedliche Mosaike tragen, kann vom NIPT übersehen werden, wenn die Plazenta keine entsprechenden Veränderungen aufweist (TFM V; Tab.1). CPM tritt besonders häufig bei Trisomie 13 und Monosomie X auf (Abb.1). Der geschätzte Anteil von CPM bei positiven NIPT-Ergebnissen liegt für Trisomie 13 bei etwa 20–30% und für das Turner-Syndrom (45,X) bei rund 50–70%.4,5 Studien zeigen, dass CPM in bis zu 1–2% aller Schwangerschaften vorkommt und die häufigste Ursache diskordanter NIPT-Ergebnisse darstellt. Daraus ergibt sich eine wesentliche Konsequenz: Ein auffälliges NIPT-Ergebnis muss immer durch invasive Diagnostik bestätigt werden, um eine Fehldiagnose zu vermeiden.6
Tab. 1: Inzidenz der verschiedenen Typen von Mosaizismen (CPM und TFM), die nach der Karyotypisierung von Chorionzotten und Amniozyten festgestellt wurden (modifiziert nach Grati FR et al.)3
Abb. 1: Wahrscheinlichkeit, dass der Befund sich bei auffälligem NIPT bestätigt (positiv prädiktiver Wert). Modifiziert nach Norton ME et al., Lüthgens K et al. und Familiari A et al.22–24
«Vanishing Twin»
«Vanishing twins» werden bei etwa 1% aller Schwangerschaften zum Zeitpunkt des ETT festgestellt. Ein wesentlicher Punkt beim «Vanishing twin»-Syndrom ist, dass fetale Aneuploidien häufig Ursache für einen Frühabort eines der Zwillinge sind und die zellfreie DNA dieses Feten/der Plazenta dann zu einem auffälligen NIPT-Ergebnis führt, das gar nicht zum überlebenden Fetus passt. Studien zeigen, dass zellfreie DNA (cfDNA) des abgestorbenen Zwillings bis zu etwa acht Wochen nach dem Tod im maternalen Blut nachweisbar sein kann, und in Einzelfällen sogar bis zu 15 Wochen, wobei der Effekt mit der Zeit deutlich abnimmt.7 Je näher der Zeitpunkt des Absterbens am Zeitpunkt der NIPT-Abnahme liegt, desto höher ist die Wahrscheinlichkeit für ein auffälliges Ergebnis, insbesondere bezüglich Aneuploidien oder Geschlechtsanalyse. Ein einfach nachvollziehbares Szenario ist eine Geschlechtsdiskrepanz: Der NIPT erkennt ein Y-Chromosom vom verstorbenen männlichen Zwilling, obwohl der vitale Fetus weiblich ist. Damit wird sofort klar, dass die Interpretation im Hinblick auf den überlebenden Zwilling nicht zuverlässig möglich ist. Studien belegen ein hohes Risiko für unklare Ergebnisse.8,9 Daher empfehlen internationale Leitlinien bei «Vanishing twin»-Schwangerschaften auf einen NIPT zu verzichten. Bei Indikation bzw. bei auffälligem Ersttrimesterscreening sollte primär eine invasive Diagnostik angeboten werden.10–12
Maternale Ursachen
Neben plazentaren Faktoren können auch maternale Besonderheiten zu auffälligen NIPT-Ergebnissen führen. Dazu gehören seltene, aber klinisch bedeutsame Konstellationen wie unerkannt bestehende maligne Erkrankungen, am häufigsten Brust- und Zervixkarzinome, Hodgkin- und Non-Hodgkin-Lymphome, maligne Melanome, Leukämien, Ovarial- und kolorektale Karzinome.13 Darüber hinaus können Mosaike der Mutter,14 eine Organtransplantation von einem männlichen Spender,14 grosse Uterusmyome,15 bestimmte Autoimmunerkrankungen,16 Vitamin-B12-Mangel17 oder eine Antikoagulation18 das Ergebnis verfälschen. Auch wenn diese Ursachen selten sind, ist ihre klinische Relevanz hoch. In einzelnen Fällen wurde durch einen auffälligen NIPT sogar eine bislang unerkannte Tumorerkrankung bei der Mutter diagnostiziert. Für die Praxis bedeutet das: Diskrepante Befunde sind nicht automatisch fetalen Ursprungs, sondern können, falls nicht anders erklärbar, auch auf eine relevante maternale Erkrankung hinweisen.
Interpretation, Ultraschall und invasive Bestätigung
Ultraschall bleibt unverzichtbar
Der NIPT ist ein guter Screeningtest, um bei unauffälligen Feten, wenn erwünscht, letzte Risiken für die häufigsten Chromosomenstörungen auszuschliessen. Er dient hauptsächlich als Ergänzung der Ultraschalldiagnostik. Fetale Fehlbildungen treten viel häufiger auf als Chromosomenstörungen (2–3%)19 und können nur durch eine sonografische Untersuchung erkannt werden. Auch nach einem auffälligen NIPT-Resultat ist der Ultraschall ein wichtiger weiterer Baustein in der Interpretation des Befunds.
Auffälliger NIPT – wie weiter?
Ein auffälliges Ergebnis muss immer durch einen diagnostischen Test mit einer invasiven Diagnostik bestätigt werden. Die Wahl des Verfahrens richtet sich nach Gestationsalter und klinischem Kontext. Ganz allgemein gesprochen wird bei auffälligen sonografischen Befunden meist eine Chorionzottenbiopsie (CVS) ab der 12. Schwangerschaftswoche empfohlen, ggf. muss die Langzeitkultur der Chorionzotten abgewartet werden. Ihr grosser Vorteil liegt in der frühen Diagnosestellung. Bei unauffälligem Ultraschall ist hingegen in der Regel die Amniozentese (AC) ab der 15. Schwangerschaftswoche vorzuziehen. Sie analysiert fetale Zellen direkt und reduziert damit das Risiko diskordanter Ergebnisse, die durch Mosaizismen bedingt sind.20
Unauffälliger NIPT
Ein unauffälliges NIPT-Ergebnis nach unauffälligem Ultraschall kann beruhigen, da die häufigsten drei Chromosomenstörungen mit hoher Wahrscheinlichkeit nicht vorliegen. Unbedingt weiter notwendig ist die Feindiagnostik zwischen 20. und 22. SSW, da dies die Untersuchung mit der höchsten Detektionsrate für Fehlbildungen ist. Die Detektion ist einerseits wichtig für das perinatale Management, andererseits auch Anlass für genetische Untersuchungen, mit denen umfassend nach Aneuploidien, submikroskopischen Veränderungen oder Einzelgenerkrankungen gesucht werden kann.
Literatur:
1 Gil MM et al.: Analysis of cell-free DNA in maternal blood in screening for aneuploidies: updated meta-analysis. Ultrasound Obstet Gynecol 2017; 50(3): 302-14 2 Zhang H et al.: Non-invasive prenatal testing for trisomies 21, 18 and 13: clinical experience from 146 958 pregnancies. Ultrasound Obstet Gynecol 2015; 45(5): 530-38 3 Grati FR et al.: Chromosomal mosaicism in the fetoplacental unit. Prenat Diagn 2015; 35(11): 1011-19 4 Bonanni G et al.: Confined placental mosaicism as a source of discordant results between NIPT and invasive testing. Prenat Diagn 2022; 42(3): 293-301 5 Wang Y et al.: Detection of mosaic and segmental aneuploidies by maternal plasma DNA sequencing. Genet Med 2017; 19(1): 97-103 6 American College of Obstetricians and Gynecologists (ACOG). Current Guidance: Non-Invasive Prenatal Testing. 20257 Boo HY, Han YJ: Cell-free DNA screening in twin pregnancies. Obstet Gynecol Sci 2024; 67(2): 160-68 8 Malm H et al.: Vanishing twin syndrome and impact on cell-free DNA testing: a multicenter retrospective study. Ultrasound Obstet Gynecol 2019; 54(2): 155-63 9 Bianchi DW et al.: Noninvasive prenatal testing and incidental detection of occult maternal malignancies. JAMA 2017; 318(9): 861-8 10 Deutsche Gesellschaft für Gynäkologie und Geburtshilfe (DGGG). Leitlinien11Schweizerische Gesellschaft für Ultraschall in der Medizin (SGUM). Empfehlungen 2018 12 Österreichische Gesellschaft für Ultraschall in der Medizin (ÖGUM). Empfehlungen 201813 Sehnert AJ et al.: Optimal detection of fetal chromosomal abnormalities by massively parallel DNA sequencing of cell-free fetal DNA from maternal blood. Clin Chem 2011; 57(7): 1042-49 14 Bianchi DW et al.: Fetal sex chromosome testing by maternal plasma DNA sequencing: clinical laboratory experience and biology. Obstet Gynecol 2015; 125(2): 375-82 15 Rolnik DL et al.: Uterine fibroids and non-informative cell-free DNA screening results. Ultrasound Obstet Gynecol 2024; 64(4): 463-9 16 MacKinnon HJ et al.: The impact of maternal autoimmune disease on cell-free DNA test characteristics. Am J Obstet Gynecol MFM 2021; 3(6): 100466 17 Schuring-Blom H et al.: Maternal vitamin B12 deficiency and abnormal cell-free DNA results in pregnancy. Prenat Diagn 2016; 36(8): 790-3 18 Grömminger S et al.: The influence of low molecular weight heparin medication on plasma DNA in pregnant women. Prenat Diagn 2015; 35(11): 1155-7 19 Irvine B et al.: Congenital anomalies in Canada 2013: a perinatal health surveillance report. Ottawa: Public Health Agency of Canada; 201320 Mardy AH, Norton ME: Counseling for noninvasive prenatal testing: current practice and future directions. Prenat Diagn 2021; 41(10): 1249-54 21 Grati FR: Chromosomal mosaicism in human feto-placental development: implications for prenatal diagnosis. J Clin Med 2014; 3(3): 809-37 22 Norton ME et al.: Cell-free DNA analysis for noninvasive examination of trisomy. N Engl J Med 2015; 372(17): 1589-97 23 Lüthgens K et al.: Confirmation rate of cell free DNA screening for sex chromosomal abnormalities according to the method of confirmatory testing. Prenat Diagn 2021; 41(10): 1258-63 24 Familiari A et al.: Cell-free DNA analysis of maternal blood in prenatal screening for chromosomal microdeletions and microduplications: a systematic review. Prenat Diagn 2021; 41(10): 1324-31
Das könnte Sie auch interessieren:
Evidenz, Anwendungen und Realitätscheck
Die Präimplantationsdiagnostik (PGT) hat sich in den vergangenen zwei Jahrzehnten zu einem integralen Bestandteil der assistierten Reproduktionsmedizin entwickelt und bietet Paaren mit ...
Abnorme uterine Blutung in der Adoleszenz
Verstärkte Menstruationsblutungen gehören zu den häufigsten gynäkologischen Beschwerden bei jugendlichen Mädchen. Bei einem relevanten Anteil liegen bisher unerkannte Blutgerinnungs- ...
Muss das duktale Carcinoma in situ noch operativ behandelt werden?
Das duktale Carcinoma in situ (DCIS) ist ein möglicher Vorläufer des invasiven Mammakarzinoms, wird jedoch zunehmend als heterogene Entität erkannt, sodass eine Standardtherapie mit ...