Evidenz, Anwendungen und Realitätscheck
Autor:innen:
Dr. med. Florian Götze
Dr. med. Eva Müller-Stucki
Lara Girod, MSc
360° Kinderwunsch Zentrum Zürich
Korrespondenz:
E-Mail: info@360grad.ch
Die Präimplantationsdiagnostik (PGT) hat sich in den vergangenen zwei Jahrzehnten zu einem integralen Bestandteil der assistierten Reproduktionsmedizin entwickelt und bietet Paaren mit erhöhtem genetischem Risiko die Möglichkeit, Embryonen vor Transfer und Implantation auf chromosomale oder monogenetische Anomalien zu untersuchen. Während PGT initial primär für schwerwiegende monogenetische Erkrankungen eingesetzt wurde, hat die Einführung von Next-Generation-Sequencing (NGS) das Spektrum der Anwendungen erheblich erweitert und gleichzeitig neue Herausforderungen in Bezug auf Evidenz, klinischen Nutzen und ethische Implikationen geschaffen. Für Gynäkologen in der Primärversorgung ist ein fundiertes Verständnis der PGT-Modalitäten, Indikationen und Limitationen essenziell, um Patientinnen evidenzbasiert zu beraten und realistische Erwartungen zu vermitteln.
Keypoints
-
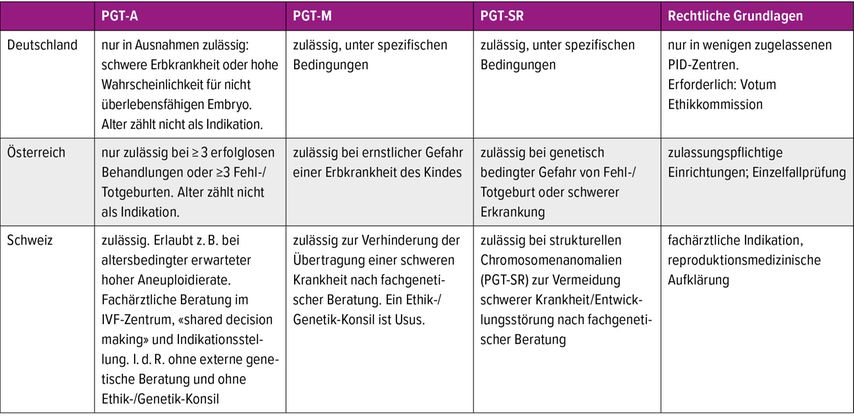
Die PGT-A setzt grundsätzlich eine IVF-Indikation voraus und ist kein eigenständiges Verfahren.
-
Für PGT-M gelten gemäss Schweizer Fortpflanzungsmedizingesetz (FmedG) strenge Kriterien.
-
PGT-SR dient der Reduktion von (habituellen) Aborten bei nachgewiesener struktureller Chromosomenaberration eines der Elternteile.
-
Präkonzeptionelle genetische Abklärung: Paare müssen vor PGT-M und PGT-SR stets eine genetische Beratung erhalten, idealerweise durch spezialisierte Fachärzte für Genetik.
-
PGT-A gehört als Werkzeug zum Alltag der Reproduktionsmediziner – diese können die damit einhergehenden Aufklärungen und Diskussionen in der Regel bis zu einem gewissen Grad selbst gewährleisten.
-
In der Schweiz dürfen maximal 12 Präembryonen vom Tag 1 an weiterkultiviert werden. Eine Geschlechtsselektion ist nicht vorgesehen.
-
PGT kann zu Deselektion von Embryonen, Datenschutzfragen (z.B. Offenlegung von sogenannten Überschussinformationen) und psychologischer Belastung führen.
-
Allen Schwangeren nach PGT sollte eine Beratung bezüglich geeigneter nichtinvasiver und invasiver Pränataldiagnostik angeboten werden. Dies betrifft besonders Mosaik- oder PGT-M-Transfers.
Methodische Grundlagen und PGT-Kategorien
PGT umfasst drei Hauptkategorien, die auf spezifischen klinischen Indikationen basieren: PGT-A («preimplantation genetic testing for aneuploidy») zur Detektion numerischer Chromosomenanomalien inklusive der Trisomie 21, PGT-SR («structural rearrangements») für strukturelle chromosomale Aberrationen und PGT-M («monogenic disorders») für monogenetische Erkrankungen. Der technische Ablauf integriert PGT nahtlos in den IVF-Zyklus: Nach kontrollierter ovarieller Stimulation und Fertilisation gewonnener Eizellen erfolgt die Embryokultur bis zum Blastozystenstadium (Tag 5–6), gefolgt von einer Trophektodermbiopsie, bei der 5–10 Zellen der zukünftigen Plazenta unter dem Mikroskop mithilfe eines Lasers entnommen werden (Abb.1). Die biopsierten Embryonen werden kryokonserviert, während die Zellproben mittels NGS analysiert werden – eine Methode, die im Vergleich zu früheren FISH- oder aCGH-Techniken eine deutlich höhere Auflösung aufweist und besser reproduzierbar ist.
PGT-A: Aneuploidie-Screening
PGT-A zielt auf die Identifikation numerischer Chromosomenanomalien (inklusive einer Trisomie 21) ab, die primär durch Fehler in der maternalen Meiose entstehen und deren Inzidenz altersabhängig dramatisch zunimmt: Während bei Frauen unter 35 Jahren etwa 30–40% der Embryonen aneuploid sind, steigt dieser Anteil bei Frauen über 40 Jahre auf 50–70%. Die Hauptindikationen für PGT-A umfassen fortgeschrittenes maternales Alter, rezidivierende Fehlgeburten, wiederholtes IVF-Versagen und schwere männliche Infertilität. Theoretisch sollte PGT-A durch Selektion euploider Embryonen die Implantationsrate pro Transfer erhöhen und die Zeit bis zum Eintreten einer Schwangerschaft durch Priorisierung von geeigneten Embryonen sowie das Fehlgeburtsrisiko reduzieren.
Die Evidenzlage zu PGT-A ist jedoch kontrovers und durch heterogene Studienergebnisse gekennzeichnet. Subgruppenanalysen deuten allerdings darauf hin, dass Frauen in fortgeschrittenem maternalem Alter möglicherweise profitieren, während sich bei jungen Patientinnen mit guter Prognose kein Vorteil zeigte. Die American Society for Reproductive Medicine (ASRM) und die Human Fertilisation and Embryology Authority (HFEA) haben ihre Empfehlungen entsprechend angepasst: Die ASRM konstatiert, dass der Wert von PGT-A als routinemässigem Screening-Test unklar bleibt, während die HFEA PGT-A in ihrem neuen 5-Farben-System (2024) differenziert bewertet: Rot für Lebendgeburtenrate (die meisten Patienten), Grün für Fehlgeburtsreduktion (die meisten Patienten), Grau für die Indikation Erhöhung der Zahl von Lebendgeburten und Verringerung der Zahl von Aborten bei älteren Frauen (Tab. 1).
Eine internationale Studie von Gill et al. mit 123987 Patientinnen demonstrierte, dass nach konsequentem Ausschluss bekannter anderer (z.B. uteriner) Implantationshindernisse und Transfers von kumulativ fünf euploiden Embryonen eine Lebendgeburtenrate von 98,1% erreicht wurde (95% CI: 96,5–99,6%). Dies impliziert, dass «rezidivierendes Implantationsversagen» bei korrekter Embryoselektion extrem selten ist. Komplementär zeigt die Analyse von Rodríguez-Varela et al., dass der minimal benötigte Bedarf an reifen Oozyten (sog. MII) für das Erzielen von mindestens einer euploiden Blastozyste altersabhängig exponentiell steigt: von 2,6 Oozyten bei 35-Jährigen auf 12,2 Oozyten bei ≥45-Jährigen. Diese Evidenz unterstreicht die Notwendigkeit transparenter Aufklärung über altersbedingte Limitationen und eines konsequenten Erwartungsmanagements gemeinsam mit den Paaren.
PGT-SR und PGT-M: strukturelle und monogenetische Anomalien
PGT-SR adressiert strukturelle Rearrangements wie Translokationen, Inversionen und Deletionen, die bei etwa 5% der subfertilen Paare vorkommen und ansonsten zu einem erhöhten Risiko für Aborte und IVF-Versagen führen können. Klassische Indikation hierfür ist z.B. die Robertson-Translokation als balancierte Trägerkonstellation bei einem Elternteil.
PGT-M hingegen wird für monogenetische Erkrankungen eingesetzt, die autosomal-dominant (50% Transmissionsrisiko), autosomal-rezessiv (25% bei Trägerpaaren) oder X-chromosomal vererbt werden (Tab. 2).
Klinische Outcomes und Sicherheit
Die klinischen Outcomes von PGT hängen massgeblich von der korrekten Indikationsstellung und den Patientencharakteristika ab. Bei euploiden Embryonen nach PGT-A werden Implantationsraten von bis zu 60% und eine Reduktion der Fehlgeburtsraten von 10–15% (auch bei Frauen in fortgeschrittenem Alter) berichtet. Der «elective» Single-Embryo-Transfer (eSET) euploider Embryonen minimiert zudem das Risiko für Mehrlingsschwangerschaften, die mit erhöhten perinatalen Komplikationen assoziiert sind.
Risiken der Embryobiopsie
Die Trophektodermbiopsie ist ein invasiver Eingriff, dessen Sicherheit intensiv untersucht wurde. Studien, die PGT-Kinder mit IVF-Kontrollen verglichen, fanden keine signifikanten Unterschiede in kongenitalen Anomalien (3–5% in beiden Gruppen), der neurologischen Entwicklung oder den Langzeit-Outcomes. Das Risiko für einen gänzlichen Verlust von getesteten Embryonen wird mit ca. 1–6% angegeben, während die Überlebensrate nach dem Auftauen von nicht biopsierten Embryonen bei >98,5% liegt.
Mosaizismus: eine komplexe diagnostische Herausforderung
Klinisch können Mosaikembryonen insbesondere bei fehlenden euploiden Alternativen eine vertretbare Transferoption sein, dabei ist jedoch eine individuelle genetische Beratung erforderlich. Pränatale Tests fallen in den meisten Fällen unauffällig aus, was darauf hindeutet, dass sich ein Teil der embryonalen Mosaizismen im Verlauf der Entwicklung ausgleicht, auch wenn dies im Einzelfall nicht prognostiziert werden kann.
Mosaizismus – das Vorhandensein von euploiden und aneuploiden Zelllinien innerhalb eines Embryos – stellt eine der grössten Herausforderungen in der PGT-A dar und betrifft 2–50% der Blastozysten, je nach Detektionsschwelle und Plattform. Die Ursachen für Mosaikbefunde sind vielfältig: Echter Mosaizismus durch postzygotische mitotische Fehler (Nondisjunktion), technische Artefakte (Amplifikationsbias, Kontamination, statistische Variabilität), beschriebene Diskrepanzen zwischen der Biopsie, dem restlichen Trophektoderm und dem Embryoblasten legen nahe, dass Biopsien mitunter nicht repräsentativ ausfallen können. Neuere Untersuchungen zeigen, dass Mosaike sogar noch häufiger vorkommen könnten, als durch bisherige Studien belegt wurde.
Klinisches Management von Embryomosaiken
Die Transferempfehlungen für Mosaikembryonen variieren zwischen Zentren, folgen jedoch zunehmend standardisierten Prinzipien, z.B. von ESHRE (European Society of Human Reproduction and Embryology) und ASRM. Low-Level-Mosaike (je nach Klassifikation ca. 20–40/49% aneuploide Zellen) zeigen konsistent niedrigere Abortraten und teils ähnlich hohe Lebendgeburtenraten wie gänzlich euploide Embryonen. Im Gegensatz dazu zeigen High-Level-Mosaike (typische Definition etwa 50–80% aneuploide Zellen) deutlich schlechtere Prognosen, wobei die Grenzwerte je nach Labor bzw. Studie variieren. Diese Daten unterstützen die Hypothese der Selbstkorrektur durch selektive Proliferation euploider Zellen oder Apoptose aneuploider Zellen während der Entwicklung, obwohl alternative Erklärungen (technische Überschätzung, geringe Trophektoderm-ICM-Konkordanz) ebenfalls plausibel sind. Die Hypothese der Selbstkorrektur beim Menschen bleibt jedoch wissenschaftlich umstritten und ist nicht definitiv bewiesen.
PGT-Realitätscheck: eine sinnvolle Ergänzung mit (möglichen) Tücken im klinischen Alltag
Trotz der theoretischen Vorteile bringt PGT im klinischen Alltag auch regelmässig immer wieder Herausforderungen mit sich, da Situationen eintreten können, die für die Paare zu einer plötzlichen Belastungsprobe werden.
Begrenzte Embryoverfügbarkeit und Verluste
Ein häufiges zentrales Problem ist eine geringe Anzahl biopsierbarer Embryonen. Von allen gewonnenen Eizellen entwickelt im Normalfall nur ein gewisser Anteil zu Tag 5/Tag 6 Blastozysten mit ausreichender Morphologie (erforderlich: Grad A/B) für die Zellentnahme. Grad-C-Embryonen sind teilweise technisch nicht biopsierbar oder zeigen höhere Verlustraten. Bei Patientinnen mit schlechter ovarieller Reserve (Surrogatmarker niedriger AMH) bei fortgeschrittenem mütterlichem Alter (AMA) oder schwerem Male-Faktor kann dies bedeuten, dass am Ende des gesamten Prozesses kein einziger euploider Embryo für einen Transfer zur Verfügung steht. Dies führt zu wiederholten IVF-Zyklen mit erheblichen emotionalen und finanziellen Belastungen, ohne jede Garantie für Embryotransfers oder gar Schwangerschaftseintritt.
Technische Fehlerquellen und Fehldiagnosen
Amplifikationsfehler (ca. 0,5% der Fälle), Kontaminationen oder unzureichende DNA-Qualität können selten einzelne Analysen unbrauchbar machen. Das Vorliegen eines Mosaizismus stellt die Repräsentativität einer Trophektodermbiopsie grundsätzlich infrage: Die Konkordanz zwischen Trophektoderm (zukünftige Plazenta) und innerer Zellmasse (ICM, zukünftiger Embryo) bei Mosaikdiagnosen variiert, was bedeutet, dass theoretisch auch vitale, euploide Embryonen fälschlicherweise verworfen werden könnten. Umgekehrt können aneuploide Zellen in der ICM vorhanden sein, obwohl die Biopsie euploid erscheint, was falsch negative Ergebnisse erklärt.
Unvorhersehbare Ergebnisse und emotionale Belastung
Viele Paare erleben unerwartete oder unerwünschte Ergebnisse, auf welche sie im Rahmen der Therapieplanung konsequent einfühlsam vorbereitet werden müssen: keine euploiden Embryonen (häufig bei >40 Jahren), ausschliesslich Mosaikembryonen oder unbestimmte Befunde, die eine zweite Biopsie erfordern (mit zusätzlichen Kosten und Verlustrisiken). Die Deselektion von Embryonen – insbesondere bei grenzwertigen Mosaikbefunden – kann zu ethischen Dilemmata und psychologischer Belastung führen. Paare müssen wissen, dass eine PGT keine Garantie für gesunde Schwangerschaften bietet: Multifaktorielle genetische Erkrankungen, De-novo-Mutationen und nicht genetische Ursachen für Fehlgeburten bleiben unentdeckt.
Kosten-Nutzen-Verhältnis und fehlende Erstattung
Die Kosten werden in der Schweiz nicht von Krankenversicherungen übernommen. Für junge Patientinnen ohne Risikofaktoren ist PGT-A nicht kosteneffektiv und kann sogar kontraproduktiv sein, da potenziell gesunde Embryonen verworfen oder durch die Biopsie geschädigt werden. Metaanalysen zeigen, dass PGT-A die kumulative Lebendgeburtenrate nicht steigert, was bedeutet, dass die zusätzlichen Kosten für viele Paare keinen messbaren Vorteil an Schwangerschaften bringen, aber je nach Situation kann sie die emotionale Belastung durch frustrane Transferversuche oder Aborte reduzieren.
Alternativen
-
Für die PGT-A stellt der Embryotransfer ohne vorherige Biopsie des Embryos eine klassische Alternative dar, falls Erstere aufgrund mangelnder Quantität oder Qualität nicht infrage kommt.
-
PGT-A und PGT-M könnte durch Abwarten eines spontanen oder assistierten Schwangerschaftseintritts gefolgt von invasiver Pränataldiagnostik (CVS/Amniozentese) ersetzt werden. Aufgrund des imminenten Abortrisikos und des Damoklesschwerts eines Schwangerschaftsabbruchs ist dieses Vorgehen problembehaftet und nur in seltenen Fällen die bessere Alternative.
Fazit für die gynäkologische Praxis
PGT ist eine wertvolle Option für streng ausgewählte Patientengruppen – insbesondere für Paare mit bekannten Veranlagungen für monogenetische Erkrankungen oder strukturelle Chromosomenanomalien sowie für Frauen in fortgeschrittenem maternalem Alter oder mit wiederholten Fehlgeburten. Die Evidenz für PGT-A als routinemässiges Screening bleibt jedoch begrenzt und kontrovers: Es erhöht nicht die kumulative Lebendgeburtenrate, kann aber bei selektierten Frauen die Zeit bis zur Schwangerschaft verkürzen und die Zahl der Fehlgeburten vermindern. Mosaizismus kompliziert die Interpretation und erfordert individualisierte Transferstrategien sowie pränatale Bestätigung. Die Embryobiopsie durch erfahrene Embryologen wird standardisiert durchgeführt und ist relativ sicher, doch Langzeitdaten fehlen, weshalb potenzielle Assoziationen mit perinatalen Komplikationen in nationalen Datenbanken systematisch proaktiv nachverfolgt werden. Die Kosteneffektivität ist für einige Indikationen fraglich, was eine sorgfältige Nutzen-Risiko-Abwägung erfordert. Die Zentren sollten Paare evidenzbasiert beraten, realistische Erwartungen setzen und die Tücken des Alltags – begrenzte Embryoverfügbarkeit, technische Fehlerquellen, Mosaizismus, emotionale Belastung und fehlende Garantien – transparent kommunizieren. Interdisziplinäre Zusammenarbeit zwischen Genetikern, Reproduktionsmedizinern und Psychosomatikern sowie kontinuierliche Anpassungen an neue Evidenz sind die Voraussetzung, um Präimplantationsdiagnostik verantwortungsvoll in den Alltag einzubinden.◼
Literatur:
bei den Verfasser:innen
Das könnte Sie auch interessieren:
Neue S2k-Leitlinie 2024: hypertensive Erkrankungen in der Schwangerschaft
Hypertensive Erkrankungen in der Schwangerschaft (HES) betreffen in Deutschland ca. 6–8% der Schwangerschaften und gehören zu den häufigsten maternalen Komplikationen. Zudem sind sie ...
Postpartale Blutung im Fokus
Wenn sich die Sonne über dem Tafelberg erhebt und das goldene Licht über Kapstadt legt, ahnt man kaum, dass sich hier im Oktober 2025 mehr als 8000 Fachpersonen aus über 130 Ländern ...
Künstliche Intelligenz in der Brustpathologie
Die Einführung von künstlicher Intelligenz (KI) markiert einen Paradigmenwechsel in der Pathologie – insbesondere in der Brustpathologie. Validierte KI-Tools steigern bereits heute ...