Muss das duktale Carcinoma in situ noch operativ behandelt werden?
Das duktale Carcinoma in situ (DCIS) ist ein möglicher Vorläufer des invasiven Mammakarzinoms, wird jedoch zunehmend als heterogene Entität erkannt, sodass eine Standardtherapie mit Operation, Radiotherapie und ggf. endokriner Therapie nicht in jedem Fall gerechtfertigt erscheint. Die randomisierte COMET-Studie zeigte bei Niedrigrisiko-DCIS keinen Unterschied zwischen Beobachtungsgruppe und operativ behandelter Gruppe, bisher jedoch mit kurzen Nachbeobachtungszeiten und unter hoher Adhärenz zu endokriner Therapie. Die Deeskalation der adjuvanten Radiotherapie ist nur bei klarer Niedrigrisikokonstellation sinnvoll, ein vollständiger Verzicht ist mit klaren Nachteilen behaftet. Der Konsens bleibt, dass ausserhalb von Studien keine reine Überwachung angeboten werden soll, auch die Radiotherapie bleibt Standard. Der Nutzen der endokrinen Therapie bei DCIS sollte in der Praxis betont werden.
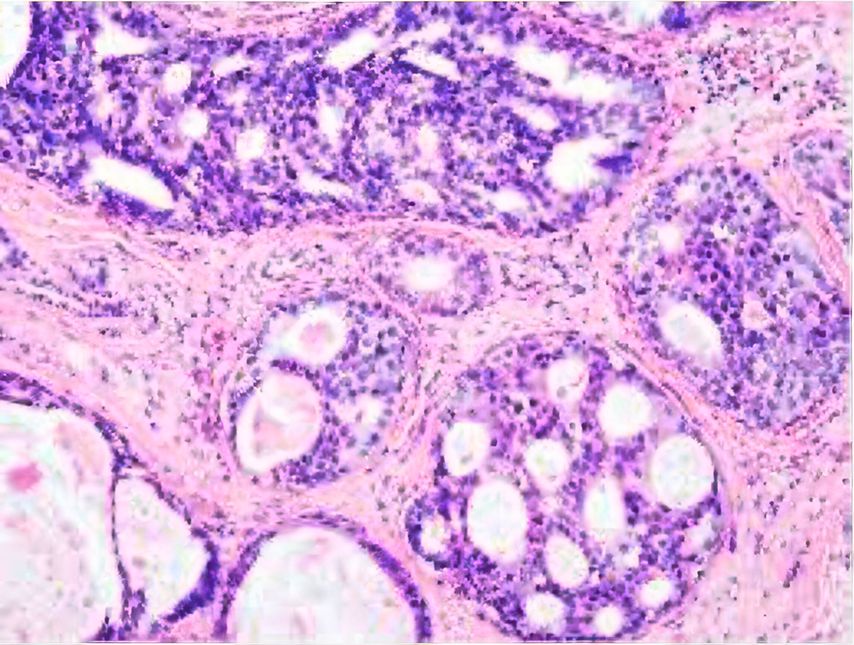
Das duktale Carcinoma in situ (DCIS) beschreibt eine Vorstufe des Mammakarzinoms, bei der maligne Zellen innerhalb der Milchgänge wachsen, jedoch die Basalmembran noch nicht durchbrochen haben (Abb.1). DCIS gilt als nicht zwingender, aber möglicher Vorläufer eines invasiven Karzinoms.1 Daher bestand die Standardtherapie bisher meist aus operativer Entfernung, adjuvanter Radiotherapie und – bei Hormonrezeptorpositivität – endokriner Therapie, in Analogie zum invasiven Mammakarzinom. Mit verbesserter Bildgebung wie Tomosynthese-Mammografie, Früherkennungsprogrammen und zunehmender Durchführung von Magnet- Resonanz-Imaging (MRI) werden heute vermehrt kleine, niedriggradige DCIS-Läsionen entdeckt.2 Studien zeigen jedoch, dass nicht jedes DCIS fortschreitet, und bei operativer Entfernung findet sich nur bei etwa 10–23% ein invasives Karzinom.3 Zudem führte der Anstieg an DCIS-Diagnosen nicht zu einem signifikanten Rückgang der Zahl an invasiven Karzinomen oder der Brustkrebssterblichkeit. Dies wirft die Frage nach einer möglichen Übertherapie auf.4
Abb. 1: DCIS, H&E-Färbung. Bild mit freundlicher Genehmigung von Prof. Varga
Verzicht auf operative Behandlung in Studien einerseits …
Schon vor zehn Jahren zeigte eine retrospektive Auswertung der US-amerikanischen «Surveillance, Epidemiology and End Results»(SEER)-Datenbank, dass bei Verzicht auf eine operative Behandlung bei «Low grade»-DCIS kein Nachteil hinsichtlich des Brustkrebs-spezifischen Gesamtüberlebens zu erkennen ist.5 Prospektive, randomisierte Studien haben bisher gefehlt, sodass in der Folge der genannten Publikation gleich drei grössere Studien initiiert wurden: der LOw RISk DCIS (LORIS) Trial, der LOw Risk DCIS(LORD)- und der Comparing an Operation to Monitoring, With or Without Endocrine Therapy for Low-Risk DCIS (COMET) Trial.6–8 Alle drei Studien berücksichtigen Patientinnen ab mindestens 40 Jahren mit «Non-high-grade»-DCIS. Zwei der Studien sind randomisiert, eine Studie (LORD) berücksichtigt die Präferenz der Patientinnen. Bisher publiziert wurden die Daten des COMET Trial, welcher untersucht, ob bei Patientinnen mit niedrigem Risiko ein «active monitoring» – also regelmässige Bildgebung und klinische Kontrollen – ebenso sicher ist wie die leitliniengerechte Therapie (Abb.2). In die Studie wurden knapp 1000 Frauen mit Hormonrezeptor-positivem, niedrig- bis mittelgradigem DCIS eingeschlossen. Die zentrale Fragestellung war: Lässt sich durch ein schonenderes Vorgehen eine ähnlich gute Sicherheit erreichen, ohne unnötige Therapien und deren Nebenwirkungen in Kauf zu nehmen? In der Gruppe mit «active monitoring» erhielten 19 Patientinnen (4,2%) im Verlauf die Diagnose eines invasiven Karzinoms, welches anschliessend standardgemäss therapiert wurde. In der Gruppe mit leitliniengerechtem Vorgehen erhielten 27 Patientinnen (5,9%) die Diagnose. In beiden Gruppen nahm die Mehrheit der Patientinnen (etwa 70%) eine endokrine Therapie ein.
Die Ergebnisse dieser Studie deuten eine neue Richtung im Umgang mit «Low grade»-DCIS an, sind jedoch keinesfalls überzubewerten. Denn zum einen ist der Beobachtungszeitraum mit gut zwei Jahren relativ kurz hinsichtlich des biologischen Verhaltens eines DCIS, zum anderen wurde mit über 70% Einnahme einer endokrinen Therapie eine hohe Compliance erreicht. Dass die konsequente endokrine Therapie protektiv hinsichtlich der Folgeinzidenz eines invasiven Karzinoms wirkt, konnte auch schon in früheren Studien gezeigt werden.9,10 Interessant ist, dass trotz einer gewissen Unsicherheit bei einem bioptisch nachgewiesenen DCIS die Patientinnen in beiden Gruppen keine Unterschiede hinsichtlich Besorgnis, Depression, Angst oder Lebensqualität aufwiesen. Auch wünschten sich mehr Studienteilnehmerinnen, in die Beobachtungsgruppe zu wechseln, als andersherum.6
… die Zunahme prophylaktischer Mastektomien andererseits
Dies steht konträr zu dem Trend prophylaktischer Mastektomien, die zunehmend auch von Patientinnen ohne nachgewiesene pathogene Mutation gewünscht wird.11–13 Für Frauen mit erhöhtem Lebenszeitrisiko für Brustkrebs gilt die prophylaktische Mastektomie gemäss der Society of Surgical Oncology als angemessene Option.14 Ein «Hochrisikostatus» wird häufig über Modelle wie Gail oder Tyrer-Cuzick definiert (>20% Lebenszeitrisiko), bleibt jedoch unscharf ohne klare Grenzwerte für unterschiedliche Präventionsstrategien. Die Therapieempfehlungen berücksichtigen neben der Risikohöhe v.a. Patientenpräferenz, Alter, Komorbiditäten und weitere Risikofaktoren sowie Hochrisikoläsionen wie atypische Hyperplasie (ADH), welche morphologische Ähnlichkeiten mit dem DCIS aufweist.14
Der Stellenwert der Radiotherapie
Mehrere grosse randomisierte Studien untersuchten den Effekt der adjuvanten Radiotherapie (Ganzbrustbestrahlung) nach brusterhaltender Operation bei DCIS. Alle zeigten, dass die Radiotherapie das Risiko ipsilateraler Ereignisse etwa halbiert, jedoch ohne Einfluss auf die Brustkrebsmortalität.15,16 In der Studie RTOG 9804 beispielsweise betrug die Rate an lokalen Rezidiven (DCIS oder invasives Karzinom) nach sieben Jahren 0,9% mit Radiotherapie versus 6,7% ohne Radiotherapie bei Niedrigrisiko-DCIS.17 Subgruppen ohne relativen Nutzen der Radiotherapie lassen sich bislang schwer definieren, eine Partialbrustbestrahlung kommt für Patientinnen mit Niedrigrisiko-DCIS infrage, während ein Tumorbett-Boost für Patientinnen in einer Hochrisikosituation befürwortet werden soll. Prognosetools wie der Van-Nuys-Index, das Sloan-Kettering-Nomogramm und genomische Tests können dabei helfen, die Therapie zu individualisieren.18
Individuelle Risikofaktoren
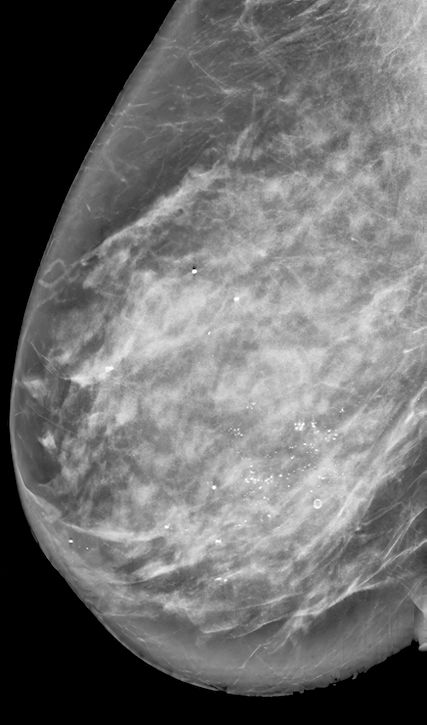
Um auch in Zukunft Patientinnen hinsichtlich der Notwendigkeit einer operativen Therapie des DCIS adäquat beraten zu können, müssen Risikofaktoren für das Vorliegen oder zukünftige Auftreten eines invasiven Karzinoms berücksichtigt werden. Dazu gehören pathologische Faktoren wie «High grade»-DCIS, Comedonekrosen, Hormonrezeptornegativität und HER2-Positivität; patientinnenassoziierte Faktoren wie jüngeres Alter oder erhöhte familiäre Belastung hinsichtlich Mammakarzinom sowie klinische Faktoren wie grössere Läsion (Abb. 3) und Vorhandensein einer assoziierten Raumforderung.19
Aktueller Konsens
Bei der internationalen St.-Gallen-Konsensus-Konferenz in Wien 2025 kam das Expertenpanel zu folgender Empfehlung: Während früher die Radiotherapie nach brusterhaltender Operation bei DCIS als Standard galt, zeigen aktuelle Daten, dass diese strikte Empfehlung häufig zu Übertherapie führt, ohne das Überleben zu verlängern. Demgegenüber wird die endokrine Therapie möglicherweise zu wenig genutzt. Entsprechend zeichnet sich derzeit ein Trend zu einer restriktiveren Indikationsstellung für Radiotherapie und zu einer breiteren Anwendung der adjuvanten endokrinen Therapie ab. Die Daten der COMET-Studie wurden diskutiert, jedoch sprach sich das Panel nicht für aktives Monitoring als Alternative zur Standardtherapie aus. So votierten 90% für eine Operation des DCIS im Falle einer 55-jährigen Patientin mit <1cm Verkalkungen und ebenso noch im Falle einer 70-jährigen Patientin. Nur 19% der Panelisten hielten endokrine Therapie und jährliche Nachsorge für vertretbar.20
Zusammenfassung
Der Verzicht auf eine operative Therapie zugunsten einer engmaschigen Überwachung ist auch bei «Low grade»-DCIS ausserhalb von Studien aktuell nicht zu empfehlen. Langzeitergebnisse aus randomisierten Studien werden in den nächsten Jahren erwartet. Die adjuvante Radiotherapie ist ebenfalls nach wie vor Standard, kann aber bei Niedrigrisikosituation deeskaliert werden. Der protektive und therapeutische Wert der endokrinen Therapie bei DCIS wurde eher unterschätzt, sie sollte in der klinischen Praxis einen grösseren Stellenwert erhalten.
Literatur:
1 Sinn HP, Kreipe H: A brief overview of the WHO classification of breast tumors, 4th Edition, focusing on issues and updates from the 3rd Edition. Breast Care 2013; 8(2): 149-54 2 Van Steenbergen LN et al.: Screening caused rising incidence rates of ductal carcinoma in situ of the breast. Breast Cancer Res Treat 2009; 115(1): 181-3 3 Brennan ME et al.: Ductal carcinoma in situ at core-needle biopsy: meta-analysis of underestimation and predictors of invasive breast cancer. Radiology 2011; 260(1): 119-28 4 Delaloge S et al.: Ductal carcinoma in situ of the breast: finding the balance between overtreatment and undertreatment. Lancet 2024; 403(10445): 2734-46 5 Sagara Y et al.: Survival benefit of breast surgery for low-grade ductal carcinoma in situ: a population-based cohort study. JAMA Surg 2015; 150(8):739-45 6 Hwang ES et al.: Active monitoring with or without endocrine therapy for low-risk ductal carcinoma in situ: the COMET randomized clinical trial. JAMA 2025; 333(11): 972-80 7 Schmitz RSJM et al.: Active surveillance versus treatment in low-risk DCIS: Women’s preferences in the LORD-trial. Eur J Cancer 2023; 192:113276 8 Francis A et al.: The LORIS Trial: Addressing overtreatment of ductal carcinoma in situ. Clin Oncol 2015; 27(1): 6-8 9 Chen YY et al.: Pathologic and biologic response to preoperative endocrine therapy in patients with ER-positive ductal carcinoma in situ. BMC Cancer 2009; 9(1): 285 10 Hwang ES et al.: Phase II single-arm study of preoperative letrozole for estrogen receptor–positive postmenopausal ductal carcinoma in situ: CALGB 40903 (Alliance). J Clin Oncol 2020; 38(12): 1284-92 11 Baskin AS et al.: Trends in contralateral prophylactic mastectomy utilization for small unilateral breast cancer. J Surg Res 2021; 262: 71-84 12 Wong SM et al.: Growing use of contralateral prophylactic mastectomy despite no improvement in long-term survival for invasive breast cancer. Ann Surg 2017; 265(3): 581-9 13 Thompson JL et al.: Prophylactic mastectomy and occult malignancy: Surgical and imaging considerations. J Surg Oncol 2023; 127(1): 18-27 14 Showalter SL et al.: Highlights and perspectives from the Society of Surgical Oncology’s statements on bilateral and contralateral risk-reducing mastectomy. Ann Surg Oncol 2025; 32(6): 3857-60 15 Chua BH et al.: Radiation doses and fractionation schedules in non-low-risk ductal carcinoma in situ in the breast (BIG 3–07/TROG 07.01): a randomised, factorial, multicentre, open-label, phase 3 study. Lancet 2022; 400(10350): 431-40 16 Rakovitch E et al.: The time-varying effect of radiotherapy after breast-conserving surgery for DCIS. Breast Cancer Res Treat 2019; 178(1): 221-30 17 McCormick B et al.: RTOG 9804: A prospective randomized trial for good-risk ductal carcinoma in situ comparing radiotherapy with observation. J Clin Oncol 2015; 33(7): 709-15 18 Leonardi MC et al.: Tools to guide radiation oncologists in the management of DCIS. Healthcare 2024;12(7): 795 19 Maxwell AJ et al.: Risk factors for the development of invasive cancer in unresected ductal carcinoma in situ. Eur J Surgi Oncol 2018; 44(4): 429-35 20 Ditsch N et al.: St. Gallen/Vienna 2025 summary of key messages on therapy in early breast cancer from the 2025 St. Gallen International Breast Cancer Conference. Breast Care 2025; 20(4): 288-97
Das könnte Sie auch interessieren:
Schmerztherapie postpartal
Paracetamol und nonsteroidale Antirheumatika (NSAR) werden seit Jahren routinemässig in der Schmerztherapie nach der Geburt zum Einsatz gebracht. Opioide kommen bei Bedarf ergänzend und ...
Folsäure und Spina bifida
Auch in Zeiten der modernen Perinatalmedizin bleibt die Spina bifida eine folgenschwere Fehlbildung. Die konsequente perikonzeptionelle Folsäureprophylaxe ist eine Präventionsmassnahme ...
Schwangerschaft mit Multipler Sklerose
Was früher als Hindernis galt, ist heute gut beherrschbar: Frauen mit Multipler Sklerose (MS) können mit entsprechender Vorbereitung eine Schwangerschaft sicher und selbstbestimmt ...