Künstliche Intelligenz in der Brustpathologie
Autor:
Dr. med. Umberto Maccio
Institut für Pathologie und Molekularpathologie
Universitätsspital Zürich, Schweiz
E-Mail: Umberto.maccio@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Einführung von künstlicher Intelligenz (KI) markiert einen Paradigmenwechsel in der Pathologie – insbesondere in der Brustpathologie. Validierte KI-Tools steigern bereits heute diagnostische Präzision und Effizienz, während neue Forschungsansätze das Potenzial eröffnen, Prognose und Therapieentscheidungen grundlegend zu verändern. Gleichzeitig erfordert dieser Fortschritt eine kritische Auseinandersetzung mit ethischen, regulatorischen und finanziellen Rahmenbedingungen, um Chancen verantwortungsvoll zu nutzen.
Einführung
Künstliche Intelligenz (KI) bezeichnet den Oberbegriff für computergestützte Systeme, die Aufgaben lösen können, die normalerweise menschliche Intelligenz erfordern. Ein zentraler Teilbereich der KI ist das maschinelle Lernen (ML), bei dem Algorithmen aus Daten lernen, Muster zu erkennen und Vorhersagen zu treffen, ohne explizit programmiert zu werden. Deep Learning (DL) ist wiederum eine spezielle Methode des maschinellen Lernens, die auf mehrschichtigen neuronalen Netzen basiert und besonders gut darin ist, komplexe Strukturen in grossen Datenmengen, wie beispielsweise Bildern oder Sprache, zu analysieren.1,2
Pathologie und künstliche Intelligenz
Die Anwendungen der KI in der Pathologie lassen sich grundsätzlich in drei grosse Bereiche einteilen: Bildanalyse (z.B. Mitosezählung, Quantifizierung immunhistochemischer Marker), Diagnose/Screening (z.B. Nachweis von Karzinomherden in Stanzbiopsien) und Vorhersage von Outcomes (z.B. Vorhersage der Prognose, des Therapieansprechens, Triage zur Zuweisung des Patienten zu molekularen Tests; Abb. 1).3 Eine vor ca. zwei Jahren durchgeführte internationale Umfrage unter erfahrenen Pathologen ergab, dass in den kommenden zehn Jahren ein wesentlicher Beitrag der KI zur Verbesserung der diagnostischen Genauigkeit tatsächlich erwartet wird – unter anderem durch Unterstützung bei der Erkennung seltener Befunde, durch Standardisierung von Diagnosen und Tumorgradierungen sowie durch eine stärkere Quantifizierung histopathologischer Analysen. Zudem bestand ein breiter Konsens, dass die Zahl spezialisierter sog. «Computational Pathologinnen und Pathologen» deutlich zunehmen wird, die Rolle der Pathologen in multidisziplinären Konferenzen wachsen wird und sich die Aufgabenprofile von Labortechnikern erheblich verändern werden.4 Um KI in der Pathologie anwenden zu können, ist die Digitalisierung histologischer Bilder unverzichtbar, da sie die Schnittstelle zwischen den Gewebeproben und jedem KI-basierten Analysesystem ermöglicht.5 Dieser Schritt wird als «digitale Pathologie» bezeichnet.6 Bemerkenswert ist, dass mehrere Studien eine nahezu perfekte Übereinstimmung zwischen der mikroskopischen Beurteilung von Präparaten und der Auswertung derselben digitalisierten Bilder gezeigt haben, sodass weltweit zahlreiche Pathologieinstitute bereits eine vollständige digitale Transformation umgesetzt und das klassische optische Mikroskop abgeschafft haben.7,8 Wenn auf die digitalen Objektträger Algorithmen angewendet werden – beispielsweise mittels Graph Neural Networks, Whole-Slide-Graph-Analysen oder Subimage-Patches –, können diese theoretisch trainiert werden, um Prognosen oder Diagnosen basierend auf der digitalen Analyse der Präparate zu erstellen. Die Schnittstelle zwischen digitaler Pathologie und der Integration von KI-Modellen wird als «computational pathology» (computergestützte Pathologie) bezeichnet und stellt den entscheidenden Übergang für den Einsatz von KI in der Pathologie dar.9
Notwendigkeit der künstlichen Intelligenz in der Pathologie: Chancen und Risiken
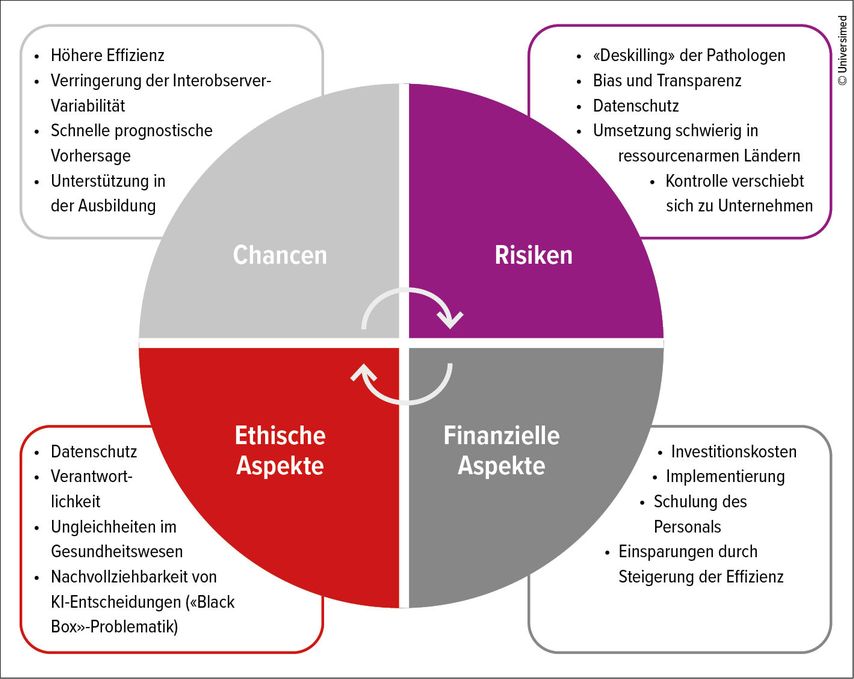
Die Notwendigkeit des KI-Einsatzes in der Pathologie ergibt sich aus unterschiedlichen Gründen, u.a. der zunehmenden Komplexität der Diagnostik, der wachsenden Zahl zu analysierender Fälle und Biomarker sowie der globalen Pathologenkapazität, was den steigenden Bedarf langfristig nicht decken kann.10–13 Aus dem bisher Dargelegten ergibt sich, dass der Einsatz von auf KI-basierten Systemen in der Pathologie ein wertvoller Verbündeter für Pathologinnen und Pathologen sein kann – vorausgesetzt, dass diese Werkzeuge den Arzt bzw. die Ärztin unterstützen und nicht ersetzen. Gleichzeitig ist es wichtig anzuerkennen, dass der Einführungsprozess der KI in die Pathologie Risiken und Herausforderungen mit sich bringt, die wie folgt zusammengefasst werden können:
-
Erosion der diagnostischen Fähigkeiten und «Deskilling» der Pathologen durch zu starke Abhängigkeit von KI-Systemen14,15
-
Risiko der Verlagerung der Kontrolle von medizinischen Fachleuten zu kommerziellen Interessengruppen, insbesondere bei proprietären Algorithmen und Datenplattformen15,16
-
Bias und mangelnde Transparenz in KI-Modellen, die zu fehlerhaften oder ungerechten Entscheidungen führen können15,17
-
Datenschutz und regulatorische Unsicherheiten, die die Implementierung erschweren15,18,19
Diese, auch in Abbildung 2 abgebildeten Aspekte müssen sorgfältig abgewogen werden, um die Vorteile der KI zu realisieren und die Risiken zu minimieren.
Abb. 2: Zusammenfassung der wesentlichen Aspekte zur Einführung von künstlicher Intelligenz in der Brustpathologie und allgemein in der Pathologie
Anwendungen in der Brustpathologie
Die Brustpathologie bildet keine Ausnahme in diesem Kontext tiefgreifender Veränderungen in der Pathologie und generell in der Medizin, die durch KI ausgelöst werden. Mehrere KI-Tools sind für die klinische Anwendung zugelassen und validiert, wobei die unten aufgelisteten zu den wichtigsten zählen. Aiforia® bietet KI-gestützte Bildanalyse für die Mammapathologie, insbesondere zur Erkennung und Quantifizierung von Tumorzellen, Biomarkern (z.B. ER, PR, HER2, Ki-67) und zur Unterstützung der Diagnostik. Die Validierung erfolgt in multizentrischen Studien mit hoher Übereinstimmung mit manuellen Pathologiebefunden; Die CE-IVD-Zulassung für klinische Anwendungen in Europa ist vorhanden.20,21 PANProfiler Breast ist ein UKCA-markiertes Deep-Learning-Tool, das aus H&E-gefärbten Schnitten den ER- und PR-Status sowie HER2-Negativität vorhersagen kann. In Blindvalidierungsstudien zeigte das Tool eine hohe Konkordanz (90–93% für ER, 86–91% für PR, 91–100% für HER2-negativ) mit den pathologischen Standardbefunden. Die Zulassung besteht für den klinischen Einsatz im Vereinigten Königreich.22 Stratipath Breast ist ein CE-IVD-zertifiziertes KI-Tool zur Risikostratifizierung von Brustkrebspatientinnen anhand digitaler H&E-Schnitte. Stratipath Breast bietet eine schnellere und kostengünstigere Alternative zu Genexpressionstests. Durch den Einsatz von KI zur Analyse routinemässiger Pathologieschnitte können Laborzeit und -kosten reduziert werden, sodass Risikoeinschätzungen innerhalb einer Stunde statt erst nach mehreren Wochen vorliegen. Die Validierung erfolgte in multizentrischen Kohortenstudien.23,24 Mindpeak entwickelt KI-Lösungen zur automatisierten Quantifizierung von Biomarkern (z.B. ER, PR, Ki-67) in der Mammapathologie. Die Validierung umfasst multizentrische Studien mit hoher Übereinstimmung mit manuellen Auswertungen; CE-IVD-Zulassung und FDA-Freigabe für bestimmte Module liegen vor.21 Visiopharm® bietet CE-IVD-zertifizierte KI-Module für die automatisierte Analyse von Brustkrebs-Biomarkern und Tumorcharakteristika. Die Validierung erfolgt durch multizentrische Studien mit Vergleich mit etablierten diagnostischen Methoden.20,21 Paige® ist ein KI-System für die digitale Pathologie, das in den USA von der FDA für bestimmte Anwendungen zugelassen ist. In der Mammapathologie unterstützt Paige die Erkennung und Klassifikation von Brusttumoren; die Validierung umfasst multizentrische Studien.20 Galen IBEX ist eine CE-IVD-zertifizierte KI-Plattform zur Unterstützung der Brustkrebsdiagnostik. Die Validierung erfolgt durch multizentrische Studien; für ausgewählte Module besteht eine FDA-Zulassung.20 Die Integration dieser Tools erfolgt meist als Assistenzsysteme, wobei die finale diagnostische Verantwortung beim Pathologen verbleibt. Die Validierungsstudien zeigen, dass KI die Interobserver-Variabilität reduziert und die Effizienz steigert, ohne die diagnostische Qualität zu kompromittieren.23 Darüber hinaus wurden bisher mehrere hochentwickelte Algorithmen – beispielsweise solche, die die Zusammensetzung des Tumormikromilieus (sog. TME; «tumor microenvironment») und der TILs («tumor infiltrating lymphocytes») quantifizieren oder das Vorliegen spezifischer Mutationen wie BRCA1/2 auf Basis der HE-Morphologie prognostizieren können – primär zu Forschungszwecken entwickelt und sind bislang nicht für den routinediagnostischen Einsatz validiert.25–29
Ethische und finanzielle Aspekte
Die ethische Implementierung von KI in der Pathologie erfordert Transparenz, Rechenschaftspflicht und Governance. Pathologen müssen aktiv in die Entwicklung und Überwachung von KI-Systemen eingebunden werden, um Bias und unethische Nutzung zu verhindern. Die medizinische Literatur betont, dass KI die Versorgung verbessern kann, aber nur bei verantwortungsvoller Anwendung.16,30–33 Datenschutz ist ein weiteres zentrales Thema, da KI-Systeme grosse Mengen sensibler Patientendaten benötigen. Die Einhaltung von Datenschutzgesetzen und ethischen Standards zur Datenminimierung und -sicherung ist unerlässlich.34 Die finanziellen Aspekte von künstlicher Intelligenz (KI) in der Pathologie umfassen mehrere zentrale Bereiche: Investitionskosten, laufende Betriebskosten, potenzielle Einsparungen und Fragen der Erstattung. Die initialen Investitionskosten für KI-Anwendungen in der Pathologie sind hoch, da die Implementierung digitaler Bildgebungssysteme, die Modernisierung der IT-Infrastruktur und die Integration von KI-Algorithmen erforderlich sind. Dazu zählen Kosten für Hardware, Software, Datenmanagement und die Schulung des Personals. Laufende Kosten entstehen durch Wartung, Updates, Validierung und regulatorische Anforderungen, insbesondere im Hinblick auf die Qualitätssicherung und die Einhaltung von Datenschutzstandards.19,35,36 Potenzielle Einsparungen ergeben sich durch die Steigerung der Effizienz und Produktivität: KI kann Routineaufgaben automatisieren, die Durchlaufzeiten verkürzen und die diagnostische Genauigkeit erhöhen, was zu einer Reduktion von Fehlern und Wiederholungsuntersuchungen führen kann.11,18 Ein zentrales Hindernis bleibt die Erstattung: In den meisten Ländern existieren bislang keine etablierten Vergütungsmodelle für KI-basierte Diagnostik in der Pathologie und regulatorische Zulassungen sind Voraussetzung für eine mögliche Kostenerstattung. Die kommerzielle Investition in KI-Produkte hängt daher stark von der Aussicht auf regulatorische Anerkennung und die Integration in bestehende Abrechnungsstrukturen ab.19,35 Zusammenfassend transformiert KI die Brustpathologie durch Automatisierung, Standardisierung und die Erweiterung diagnostischer und prognostischer Möglichkeiten. Die Integration validierter KI-Tools in die klinische Routine ist im Gange, wobei ethische und finanzielle Rahmenbedingungen kontinuierlich weiterentwickelt werden.
Literatur:
1 Stenzinger A, Alber M et al.: Artificial intelligence and pathology: From principles to practice and future applications in histomorphology and molecular profiling. Semin Cancer Biol 2022; 84: 129-43 2 Pantanowitz L et al.: Nongenerative artificial intelligence in medicine: advancements and applications in supervised and unsupervised machine learning. Mod Pathol 2025; 38(3): 100680 3 Zabihollahy F et al.: Simplified artificial intelligence terminology for pathologists. Diagnostics (Basel) 2025; 15(13): 1699 4 Berbis MA et al.: Computational pathology in 2030: a Delphi study forecasting the role of AI in pathology within the next decade. EBioMedicine 2023; 88: 104427 5 Niazi MKK et al.: Digital pathology and artificial intelligence. Lancet Oncol 2019; 20(5): e253-e261 6Matias-Guiu X et al.: Implementing digital pathology: qualitative and financial insights from eight leading European laboratories. Virchows Arch 20257 Goacher E et al.: The diagnostic concordance of whole slide imaging and light microscopy: a systematic review. Arch Pathol Lab Med 2017; 141(1): 151-61 8 Clarke E et al.: Faster than light (microscopy): superiority of digital pathology over microscopy for assessment of immunohistochemistry. J Clin Pathol 2023; 76(5): 333-8 9 Brussee S et al.: Graph neural networks in histopathology: Emerging trends and future directions. Med Image Anal 2025; 101: 103444 10 Rakha EA et al.: Current and future applications of artificial intelligence in pathology: a clinical perspective. J Clin Pathol 2021; 74(7): 409-14 11 Vigdorovits A et al.: Breaking barriers: AI’s influence on pathology and oncology in resource-scarce medical systems. Cancers (Basel) 2023; 15(23): 5692 12 Walsh E, Orsi NM: The current troubled state of the global pathology workforce: a concise review. Diagn Pathol 2024; 19(1): 163 13 Markl B et al.: Number of pathologists in Germany: comparison with European countries, USA, and Canada. Virchows Arch 2021; 478(2): 335-41 14 Nakagawa K et al.: AI in pathology: what could possibly go wrong? Semin Diagn Pathol 2023; 40(2): 100-8 15 van Diest PJ et al.: Pros and cons of artificial intelligence implementation in diagnostic pathology. Histopathology 2024; 84(6): 924-34 16 Chauhan C, Gullapalli RR: Ethics of AI in pathology: current paradigms and emerging issues. Am J Pathol 2021; 191(10): 1673-83 17 King H et al.: How, for whom, and in what contexts will artificial intelligence be adopted in pathology? A realist interview study. J Am Med Inform Assoc 2023; 30(3): 529-38 18 Reis-Filho JS, Kather JN: Overcoming the challenges to implementation of artificial intelligence in pathology. J Natl Cancer Inst 2023; 115(6): 608-12 19 Cheng JY et al.: Challenges in the development, deployment, and regulation of artificial intelligence in anatomic pathology. Am J Pathol 2021; 191(10): 1684-92 20 Datwani S et al.: Artificial intelligence in breast pathology: Overview and recent updates. Hum Pathol 2025; 162: 105819 21 Abele N et al.: Noninferiority of artificial intelligence-assisted analysis of Ki-67 and estrogen/progesterone receptor in breast cancer routine diagnostics. Mod Pathol 2023; 36(3): 100033 22 Walsh E et al.: A deep-learning solution identifies HER2 negative cases and provides ER and PR results from H&E-stained breast cancer specimens: a blind validation study. Clin Breast Cancer 2025; 25(7): 650-57 23 Sharma A et al.: Validation of an AI-based solution for breast cancer risk stratification using routine digital histopathology images. Breast Cancer Res 2024; 26(1): 123 24 Wang Y, Sun W et al.: Clinical evaluation of deep learning-based risk profiling in breast cancer histopathology and comparison to an established multigene assay. Breast Cancer Res Treat 2024; 206(1): 163-75 25 Shao J et al.: Predicting gene mutation status via artificial intelligence technologies based on multimodal integration (MMI) to advance precision oncology. Semin Cancer Biol 2023; 91: 1-15 26 Yang Z et al.: An explainable multimodal artificial intelligence model integrating histopathological microenvironment and EHR phenotypes for germline genetic testing in breast cancer. Adv Sci (Weinh) 2025; 12(31): e02833 27 Qu H et al.: Genetic mutation and biological pathway prediction based on whole slide images in breast carcinoma using deep learning. NPJ Precis Oncol 2021; 5(1): 87 28 Wang X et al.: Prediction of BRCA gene mutation in breast cancer based on deep learning and histopathology images. Front Genet 2021; 12: 661109 29 Skok K et al.: Tumor-infiltrating lymphocytes in breast and female genital tract cancers: overlooked potential and unexplored frontiers. Cancer Med 2025; 14(13): e71023 30 Du RF et al.: Ethics of foundation models in computational pathology: overview of contemporary issues and future implications. IEEE Trans Med Imaging 2025 31 Sorell T et al.: Ethical issues in computational pathology. J Med Ethics 2022; 48(4): 278-84 32 Jackson BR et al.: Ethical and regulatory perspectives on generative artificial intelligence in pathology. Arch Pathol Lab Med 2025; 149(2): 123-29 33 Hanna MG et al.: Ethical and bias considerations in artificial intelligence/machine learning. Mod Pathol 2025; 38(3): 100686 34 Pennestri F, Banfi G: Artificial intelligence in laboratory medicine: fundamental ethical issues and normative key-points. Clin Chem Lab Med 2022; 60(12): 1867-74 35 Aggarwal A et al.: Artificial intelligence in digital pathology - time for a reality check. Nat Rev Clin Oncol 2025; 22(4): 283-91 36 Geaney A et al.: Translation of tissue-based artificial intelligence into clinical practice: from discovery to adoption. Oncogene 2023; 42(48): 3545-55
Das könnte Sie auch interessieren:
Neue S2k-Leitlinie 2024: hypertensive Erkrankungen in der Schwangerschaft
Hypertensive Erkrankungen in der Schwangerschaft (HES) betreffen in Deutschland ca. 6–8% der Schwangerschaften und gehören zu den häufigsten maternalen Komplikationen. Zudem sind sie ...
Postpartale Blutung im Fokus
Wenn sich die Sonne über dem Tafelberg erhebt und das goldene Licht über Kapstadt legt, ahnt man kaum, dass sich hier im Oktober 2025 mehr als 8000 Fachpersonen aus über 130 Ländern ...
Evidenz, Anwendungen und Realitätscheck
Die Präimplantationsdiagnostik (PGT) hat sich in den vergangenen zwei Jahrzehnten zu einem integralen Bestandteil der assistierten Reproduktionsmedizin entwickelt und bietet Paaren mit ...