Update Hyper- und Hypothyreose
Bericht: Claudia Benetti
Medizinjournalistin
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Ungefähr 4% der Schweizer Bevölkerung leiden an einer Hypothyreose und etwa 1% an einer Hyperthyreose. Was es bei Abklärung und Behandlung speziell zu beachten gilt, erläuterte Prof. Dr. med. Roger Lehmann, stellvertretender Direktor der Klinik für Endokrinologie, Diabetologie und Klinische Ernährung am Universitätsspital Zürich, am FomF Innere Medizin Update Refresher.
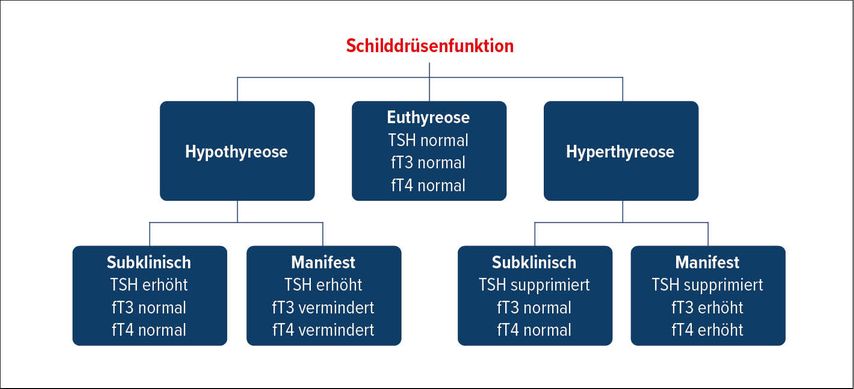
Bei den Schilddrüsenfunktionsstörungen unterscheidet man zwischen subklinischen und manifesten Über- resp. Unterfunktionen, die durch die Konstellation von TSH und den peripheren Schilddrüsenhormonen fT3 und fT4 definiert sind (Abb. 1)
Subklinische Hyperthyreose
Die subklinische Hyperthyreose ist definiert durch einen TSH-Wert <0,1mU/l und normale fT4-Werte. Als Ursache kommen ein Morbus Basedow, eine Thyreoiditis oder ein toxisches Adenom infrage. Um die Ursache für die Schilddrüsenüberfunktion zu identifizieren, wird bei einem supprimierten TSH die Szintigrafie empfohlen. «Im Uptake zu sehen ist entweder eine normale Schilddrüse oder, wenn eine Thyreoiditis vorliegt, keine Aufnahme. Liefert die Szintigrafie eine homogene Aufnahme der ganzen Schilddrüse, liegt ein Morbus Basedow vor. Bei einem toxischen Adenom sieht man auf dem Bild, wo am meisten Schilddrüsenhormone produziert werden», erklärte Lehmann.
Je nach Pathogenese entwickelt sich eine subklinische Hyperthyreose unterschiedlich rasch zu einer manifesten Schilddrüsenüberfunktion weiter. Das Progressionsrisiko ist bei einem autonomen Knoten mit 61% nach zwei Jahren am grössten, gefolgt von der Struma multinodosa mit 21% nach sieben Jahren und vom M. Basedow mit 9% nach einem Jahr.1
Subklinische Hypothyreose
Eine subklinische Schilddrüsenunterfunktion liegt vor, wenn das TSH erhöht und die peripheren Schilddrüsenhormone (fT3 und fT4) im Normbereich sind. Anders als bei der subklinischen Überfunktion braucht es bei der subklinischen Hypothyreose keine Bildgebung. «Die Werte müssen jedoch im Verlauf kontrolliert werden», so Lehmann. Eine Therapie ist indiziert, wenn Symptome bestehen oder das TSH auf einen Wert >10mU/l ansteigt.
Die Wahrscheinlichkeit, dass sich eine subklinische Hypothyreose innert eines Jahres in eine manifeste Unterfunktion weiterentwickelt, beträgt bei Patienten mit hohem TSH und negativen Schilddrüsen-Antikörpern 2,6% pro Jahr.2 «Dies ist vergleichbar mit dem Risiko bei normalem TSH und positiven Antikörpern», erläuterte Lehmann. Mit 4,3% fast doppelt so hoch ist das Progressionsrisiko bei Patienten, die sowohl ein hohes TSH als auch positive Antikörper haben.
Nicht thyreoidales Krankheitssyndrom
Ein häufiges Problem ist das nicht thyreoidale Krankheitssyndrom («euthyreot sick syndrome» oder «nonthyroidal illness syndrome»), bei dem es zu einem Absinken der Schilddrüsenhormone kommt, ohne dass tatsächlich eine Schilddrüsenerkrankung vorliegt. Bei jeder Krankheit – bei Grippe, Durchfall, Sepsis, aber auch nach Myokardinfarkt, AC-Bypass, Knochenmarktransplantation und bei Hunger – kommt es zu einem Abfall der Schilddrüsenhormone. «Bei Patienten auf der Intensivstation ist das Syndrom die Regel», sagte Lehmann.
Aufgrund der verschiedenen Halbwertszeiten sinken initial zuerst TSH und fT3 ab und später, nach etwa einer Woche, auch das fT4. Während der Rekonvaleszenz steigt das TSH als Erstes wieder an und kann dann auch überschiessen. «Erreicht das TSH Werte >20mU/l, liegt meistens eine Hypothyreose vor», so Lehmann. Steigt es hingegen nur bis 10mU/l, kann es sich auch nur um eine normale Antwort mit einer vorübergehenden, selbstlimitierenden TSH-Erhöhung handeln. Nach einer Krankheit sollten die Schilddrüsenwerte deshalb mehrfach gemessen werden.
Manifeste Überfunktion der Schilddrüse
Bei einer manifesten Überfunktion der Schilddrüse sind das TSH supprimiert und die freien Schilddrüsenhormone fT3 und fT4 erhöht. Diese Veränderungen gehen typischerweise mit Symptomen wie Gewichtsverlust, Durchfall, Wärmeintoleranz, Schwitzen, Herzklopfen, Schlafstörungen, innere Unruhe und Nervosität einher. Im Alter präsentiert sich eine Hyperthyreose oft oligosymptomatisch. «Interessanterweise fehlt vielen Patienten mit einer Überfunktion die Krankheitseinsicht. Sie fühlen sich voll leistungsfähig, müssen wenig schlafen, haben keine grossen Probleme und lieben diesen Zustand», so Lehmann.
Kommt zu einer manifesten Hyperthyreose eine endokrine Orbitopathie hinzu, liegt ein klassisches Basedow-Syndrom vor. Eine thyreotoxische Krise ist sehr selten (10–50/100000). Sie geht einher mit Fieber über 40°C, Muskelschwäche und einer Sympathikusstimulation, die zu Tachykardie, Vorhofflimmern, Diarrhö und – auch bei jüngeren Patienten – relativ rasch zum Tod führen kann.
Basedow, Knoten, Thyreoiditis, exogene T4-Zufuhr
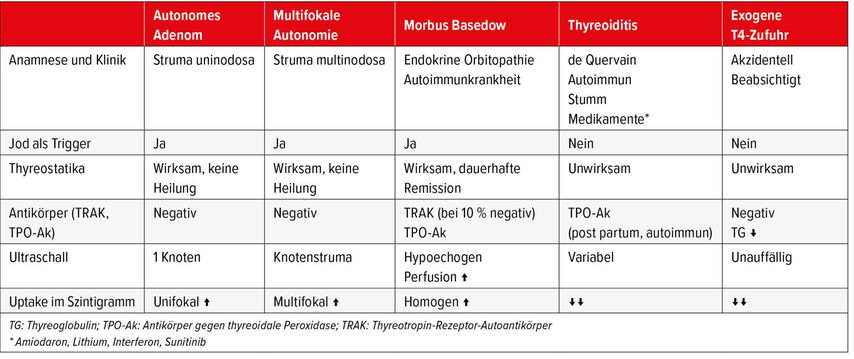
Bei einer manifesten Hyperthyreose gilt es zwischen fünf Differenzialdiagnosen zu unterscheiden: M. Basedow, autonomes Adenom, multifokales Adenom, Thyreoiditis und exogene T4-Zufuhr (Tab. 1). Die folgenden, von Lehmann aufgezählten Charakteristika helfen bei der Unterscheidung der möglichen Diagnosen:
-
M. Basedow: Bei circa 70% der Patienten mit einer Hyperthyreose liegt ein M. Basedow vor. Es handelt sich dabei um eine Autoimmunthyreoiditis. Bei 70–100% finden sich Thyreotropin-Rezeptor-Autoantikörper (TRAK) und bei 45–80% Antikörper gegen thyreoidale Peroxidase (TPO-Ak). Klinisch typisch ist eine endokrine Orbitopathie, die bereits vor oder erst nach Krankheitsbeginn auftreten kann. Bei thyreostatischer Behandlung kann sie auch fehlen. Im Ultraschall sind eine diffuse Schwellung, hypoechogene Muster, abgerundete Schilddrüsenlappen und ein hypervaskuläres Muster zu sehen. Manchmal sind auch Strömungsgeräusche über der Schilddrüse hören. Der Uptake im Szintigramm ist homogen. Thyreostatika sind wirksam, führen aber nicht immer zu einer Dauerremission.
-
Autonomes Adenom (AA) und multifokale Autonomie (MA): Bei ungefähr 30% der Hyperthyreosen liegt eine funktionelle Autonomie vor. Im Ultraschall findet man beim AA einen Knoten oder beim MA eine Knotenstruma, im Szintigramm entweder einen unifokalen Knoten (AA) oder multifokale Knoten (MA) in einem oder in beiden Schilddrüsenlappen. Die Antikörper sind negativ. Thyreostatika sind wirksam, bringen aber nie eine Heilung.
-
Thyreoiditis: Die Thyreoiditis gehört zu den seltenen Ursachen einer Hyperthyreose (ca. 2%). Sie kann stumm verlaufen und kann infektiös, autoimmun oder durch Medikamente induziert sein (v.a. Amiodaron, Lithium, Interferon, gewisse Checkpoint-Inhibitoren, frei verkäufliche Schilddrüsenpräparate, z.B. aus China oder dem Orient). Bei der postpartalen Autoimmunthyeroiditis sind die TPO-Ak positiv, bei den anderen Formen lassen sich keine Antikörper nachweisen. Der Ultraschallbefund ist variabel und der Uptake im Szintigramm ist stark reduziert oder fehlt. Die Thyreoiditis de Quervain ist schmerzhaft, tritt häufig nach einer Vireninfektion auf und entwickelt sich bei 5% zu einer Hypothyreose. Die postpartale Thyreoiditis ist meistens durch eine vorübergehende autoimmune Störung bedingt. Die Werte normalisieren sich in der Regel 12 bis 18 Monate nach der Geburt wieder. 20% der Patientinnen entwickeln jedoch eine Hypothyreose. Die akute Thyreoiditis wird meistens durch Bakterien verursacht. Sie kann schmerzhaft sein und es liegt eine generalisierte Erkrankung vor. Nach Behandlung der Infektion bildet sich in der Regel auch die Thyreoiditis vollständig zurück.
-
Exogene T4-Zufuhr: Sie kann akzidentell (z.B. durch Einnahme von frei verkäuflichen Mitteln aus Fernost mit nicht deklarierten Schilddrüsenhormonen) oder beabsichtigt (zur Leistungssteigerung oder Gewichtsabnahme) sein. Im Szintigramm findet man immer einen stark reduzierten Uptake, weil die Schilddrüsenfunktion durch die zugeführten Schilddrüsenhormone blockiert wird. Auch das Thyreoglobulin ist vermindert.
Therapie der Hyperthyreose
Je nach Pathogenese variiert die Behandlung der Hyperthyreose. Bei einer funktionellen Autonomie kommen immer ablative Verfahren zum Einsatz. Thyreostatika stellen keinen kurativen Ansatz dar. Indikationen für eine Thyreoidektomie sind: ein grosser Knoten, mechanische Kompression, rasches Wachstum, Malignitätsverdacht, Kinderwunsch und endokrine Orbitopathie. Radiojod kann gegeben werden bei kleiner Schilddrüse, einer Knotengrösse <4cm, Inoperabilität oder auf Wunsch des Patienten.
Die Thyreoiditiden werden symptomatisch mit NSAR oder Steroiden behandelt. Um die Tachykardie zu reduzieren, kann zudem ein Betablocker sinnvoll sein. Thyreostatika sind wirkungslos.
Für die Behandlung des M. Basedow bestehen drei Möglichkeiten: Thyreoidektomie, Radiojodtherapie oder thyreostatische Therapie mit Carbimazol oder Propylthiouracil. Ist ein Patient stark durch die Tachykardie beeinträchtigt, kann auch symptomatisch ein Betablocker (Propranolol oder Atenolol) gegeben werden. Mit einer thyreostatischen Behandlung erreicht etwa ein Drittel der Patienten eine dauerhafte Remission, ein Drittel eine vorübergehende Besserung und bei einem Drittel kommt es sofort nach dem Absetzen der Medikamente zu einem Rezidiv.
«Bei einer thyreostatischen Therapie wird die Schilddrüsen-Peroxidase (TPO) blockiert, sodass Thyrosin, Mono- und Dijodtyrosin nicht mehr jodiniert und somit kein T3 und kein T4 mehr synthetisiert werden können», erklärte Lehmann. Was an T3 und T4 vor Therapiebeginn bereits freigesetzt wurde und an Thyreoglobulin gebunden ist, kann durch Thyreostatika jedoch nicht beeinflusst werden.
Amiodaron und die Schilddrüse
Bei der Einnahme von Amiodaron ist Vorsicht geboten, da das Antiarrhythmikum Schilddrüsenprobleme verursachen kann. «Amiodaron enthält etwa 30% Jod, davon sind etwa 10% dejonidiert, sodass mit einer 200mg-Tablette etwa 6mg Jod aufgenommen werden. Das ist ein Mehrfaches der empfohlenen Tagesdosis und kann zu einer Autoimmun-Hypo- (AIH) oder -Hyperthyreose (AIT) führen», so der Experte.
Von einer Amiodaron-induzierten Unterfunktion betroffen sind vor allem Frauen. «Sie haben genügend Jod und als Risikofaktor positive TPO-Antikörper», sagte Lehmann. Bei der Amiodaron-induzierten Überfunktion werden zwei Typen unterschieden: Die AIT Typ 1 tritt v.a. in Jodmangelgebieten auf und die Patienten haben eine vorbestehende Schilddrüsenerkrankung (z.B. Struma). Der Körper synthetisiert exzessiv T4, die Vaskularisation ist normal oder gesteigert. Bei der AIT Typ 2 handelt es sich um eine entzündlich-destruktive Form, Schilddrüsengewebe wird zerstört und im späteren Verlauf kann eine Hypothyreose auftreten. Sie geht einher mit einer reduzierten Vaskularisierung. Die Patienten haben keine vorbestehende Schilddrüsenerkrankung.
«Bei einer Amiodaron-induzierten Hyperthyreose sollte – sowohl bei Typ 1 als auch Typ 2 – das Medikament abgesetzt werden», sagte Lehmann. Allerdings kommt es nach dem Amiodaron-Stopp nur sehr langsam zur Remission. Da das Jod im Fettgewebe gespeichert ist, dauert es in der Regel sechs bis zwölf Monate, bis es wieder eliminiert ist. Bei der AIT Typ 1 wird die Überfunktion mit Carbimazol (40–60mg/d) behandelt. Zusätzlich kann für einen Monat Perchlorat (1g/d [50 Tr.]) gegeben werden, welches die Jodaufnahme und die T3/T4-Sekretion hemmt. Bei der AIT Typ 2 ist Prednison indiziert (Beginn mit 30–40mg/d und Dosisreduktion über drei Monate).
Bei der Amiodaron-induzierten Schilddrüsenunterfunktion muss das Antiarrhythmikum nicht abgesetzt werden. Die Hypothyreose kann durch eine Substitution von Levothyroxin korrigiert werden.
Manifeste Schilddrüsenunterfunktion
Eine manifeste Hypothyreose liegt vor, wenn das TSH erhöht und die peripheren Schilddrüsenhormone fT3/fT4 vermindert sind. In sehr seltenen Fällen kann auch einmal eine zentrale Hypothyreose vorliegen. Sie entsteht durch eine Regulationsstörung im Bereich Hypophyse/Hypothalamus. «In dieser Situation kann eine Schilddrüsenunterfunktion bestehen, obschon das TSH im Normbereich ist», so Lehmann. Für die weitere Abklärung einer Hypothyreose sind insbesondere der Ultraschall und die Szintigrafie eine Option.
Eine manifeste Unterfunktion geht klinisch mit verschiedenen unspezifischen Symptomen einher. Typisch sind Müdigkeit, Depression, Gewichtszunahme, Kälteintoleranz und arterielle Hypertonie (v.a. diastolischer Bluthochdruck). Im Extremfall können auch Symptome wie Myxödem, Muskelschwäche und Haarausfall hinzukommen. Im Alter ist diese Form oft oligosymptomatisch. «Dabei kann es zu einer tiefen heiseren Stimme, einem blass-gelblichen Hautkolorit und bis hin zu einer Bewusstseinseintrübung und einer Bradypnoe kommen», erklärte Lehmann.
So vielfältig die Symptome sind, so verschieden können auch die Ursachen der Unterfunktion sein. Bei 41% ist die Ursache eine Autoimmunthyreoiditis. Sie wurde 1912 erstmals von Hakaru Hashimoto beschrieben und zeichnet sich durch eine diffuse Struma mit lymphozytären Infiltraten aus. In 80–99% der Fälle sind TPO-Antikörper und in 35–60% TAK vorhanden. Bei 37% der Patienten ist die Hypothyreose idiopathisch, bei 10% tritt sie posttherapeutisch (z.B. nach Radiojodtherapie oder Thyreoidektomie) auf und bei 2,5% ist sie Medikamenten-induziert (v.a. Amiodaron, aber auch Thyreostatika, Lithium, Interferon, Interleukin 2, Checkpoint-Inhibitoren).
Der Jodmangel als Ursache für eine Schilddrüsenunterfunktion ist in der Schweiz selten geworden. Er kommt heute nur noch vor, wenn nicht jodiertes Salz verwendet und keine Nahrung aus dem Meer gegessen wird. Der Jodbedarf beträgt 150μg/d. Bei Schwangeren ist er etwas höher (200μ/d) und bei Kindern etwas geringer (90–120μg/d).
Therapie der Schilddrüsenunterfunktion
Die Behandlung der Hypothyreose erfolgt durch eine Substitution von Thyroxin/T4 (1,6μg/kgKG/d, entspricht ungefähr 100μg/d). Das Schilddrüsenhormon muss 30 Minuten vor dem Frühstück eingenommen werden, da es sonst kaum mehr aufgenommen wird. Bei über 60-jährigen Patienten und solchen mit einer KHK kann die Dosis reduziert werden. Die Dosisanpassung erfolgt nach der Messung des fT4 zwei Wochen nach Therapiebeginn. Der Zielbereich für das fT4 liegt bei 14–16nmol/l. Das TSH wird frühestens nach sechs Wochen gemessen, hier liegt der Zielbereich bei 0,5–2μU/l.
Quelle:
FomF Update Refresher Innere Medizin 2020
Das könnte Sie auch interessieren:
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...
Neue Studiendaten zu Typ-2-Diabetes und Lebensstil
Dass gesunde Ernährung und Bewegung das Diabetesrisiko sowie verschiedene Risiken von Patienten mit Diabetes senken, ist seit Langem bekannt. Und das Detailwissen zur Bedeutung von ...
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...