Update Diabetesmanagement: Devices & künstliche Intelligenz
Autoren:
PD Dr. med. Thomas Züger
Dr. med. Vera Lehmann
Universitätsklinik für Diabetologie, Endokrinologie, Ernährungsmedizin und Metabolismus (UDEM)
Inselspital, Universitätsspital und Universität Bern
E-Mail: thomas.zueger@insel.ch
Der rasante technische Fortschritt und die Digitalisierung haben die Diabetestherapie in der vergangenen Dekade massgebend geprägt. Die laufende Optimierung und die Flexibilisierung der Diabetesbehandlung sind mitunter den zahlreichen technischen Errungenschaften zu verdanken. Hervorzuheben ist die Koppelung von kontinuierlichen Glukosemessgeräten und Insulinpumpen unter Zwischenschaltung von Kontrollalgorithmen, was eine automatisierte Insulinabgabe ermöglicht («Closed-Loop»-Systeme). Daneben haben auch die Verbreitung und Konnektivität von Smart Devices, Wearables und verschiedenster Applikationen der Diabetestechnologie zusätzlichen Schub verliehen. Die dabei generierten Daten werden zusehends mittels künstlicher Intelligenz verarbeitet. Letztere eröffnet auch neue Möglichkeiten im Bereich von Diagnostik, Prognose und Risikostratifizierung.
Keypoints
-
Zahlreiche technische Errungenschaften haben die Diabetestherapie sowohl für die Betroffenen als auch für die Behandlungsteams binnen weniger Jahre massgebend verändert.
-
Das kontinuierliche Glukosemonitoring hat sich mittlerweile als Standard in der Glukosemessung etabliert. Dessen Koppelung an Insulinpumpen unter Zwischenschaltung von Kontrollalgorithmen, welche die Insulinabgabe automatisiert dem Bedarf anpassen (sog. «Closed-Loop»-Systeme), hat die Diabetesbehandlung flexibilisiert und optimiert.
-
Künstliche Intelligenz bietet neue Möglichkeiten in der Verarbeitung therapierelevanter diabetesbezogener Daten. Ebenfalls findet sie zunehmend Anwendung in der Diagnostik sowie der Prädiktion von Krankheitsverläufen und erlaubt innovative Lösungsansätze, um praxisrelevante Probleme anzugehen.
Selbstredend hat sich die Diabetestherapie seit der Entdeckung des Insulins vor genau 100 Jahren stetig weiterentwickelt. Gerade die vergangene Dekade brachte zahlreiche Neuerungen hervor, welche die Diabetestherapie weiter optimiert und flexibilisiert haben. Dabei nahmen technische Entwicklungen eine zentrale Rolle ein. Zunächst standen dabei Personen mit Typ-1-Diabetes im Fokus, immer mehr kommen diese Neuerungen allerdings auch bei Personen mit einem Typ-2-Diabetes zum Einsatz.
Insulinpumpen
Die kontinuierliche subkutane Insulininfusion mittels Insulinpumpen hat sich seit der Jahrtausendwende zu einer weitverbreiteten Therapieoption für Personen mit Diabetes entwickelt.1 Bei den Pumpensystemen unterscheidet man zwischen Katheterpumpen und Patch-Pumpen:2 Bei Ersteren wird das Insulin über einen Katheterschlauch und eine daran konnektierte subkutan liegende Kanüle (Infusionsset) appliziert; bei den Patch-Pumpen wird die gesamte mechanische Pumpeneinheit direkt auf die Haut geklebt und ist mittels einer kurzen, direkt unter dem Patch liegenden Kanüle mit dem Subkutangewebe verbunden. Bedient wird die Patch-Pumpe durch eine Fernbedienung. Bei beiden Modellen muss die subkutan gelegte Kanüle (bei der Patch-Pumpe entsprechend die gesamte Pumpeneinheit) alle 2–3 Tage ausgewechselt werden. Hier laufen Bestrebungen, die Tragedauer durch Materialmodifikationen auf bis zu sieben Tage zu verlängern.
Die kontinuierliche Abgabe des schnell wirksamen Insulins kann variabel programmiert und so an den zirkadian variierenden Insulinbedarf adaptiert werden. Zudem kann die basale Insulinabgabe (sog. Basalrate) über frei wählbare Zeitintervalle kurzfristig reduziert oder erhöht werden, was bei längerer sportlicher Aktivität (geringerer Insulinbedarf) oder bei Krankheit (erhöhter Insulinbedarf) nützlich ist.
Nebst Optimierungen im Bereich von Hardware und Verarbeitung zeichnen sich die heutigen Insulinpumpen durch Konnektivität zu Smartphones oder Blutzuckermessgeräten aus, welche der Datenanalyse oder Fernsteuerung dienen. Ebenfalls verfügbar sind automatisierte Berechnungen der benötigten Insulindosen basierend auf Kohlenhydratmenge, aktuellem Blutzucker und noch aktivem Insulin (sog. Boluskalkulatoren).
Glukosemonitoring
Die kontinuierliche Glukosemessung (CGM) hat sich als neuer Standard in der Diabetesbehandlung etabliert. Sie liefert dabei im Vergleich zu den kapillären Punktmessungen ein exaktes Abbild des Glukoseverlaufes. Die Glukosemessung erfolgt im interstitiellen Gewebe mittels eines kleinen Sensors, welcher vom Patienten in den meisten Fällen selbstständig subkutan appliziert werden kann. Die Sensorinformationen werden über einen Transmitter an ein Empfängergerät (Receiver oder Smartphone) gesendet, welches dann den über einige Minuten gemittelten Zuckerwert anzeigt. Nebst den CGM-Systemen, bei welchen die Datenübertragung per Bluetooth automatisch an das Empfängergerät erfolgt, haben sich zwischenzeitlich auch preiswertere Flash-Glukosemonitoring(FGM)-Systeme etabliert, bei denen der Glukosewert aktiv abgerufen werden muss. Hierfür wird das Empfängergerät in die Nähe des Sensors gehalten (Übertragung per «near field communication»).
In den letzten Jahren haben sich sowohl die Tragedauer der Sensoren (mittlerweile 10–14 Tage; bei komplett implantierbaren Sensoren gar 180 Tage) als auch die Messgenauigkeit (durchschnittliche Abweichung vom Blutzucker von aktuell ca. 10%) deutlich verbessert.3 Letzteres erlaubt, dass diese Geräte ohne kapilläre Kontrollmessung für Therapientscheidungen verwendet werden können (sog. «non-adjunctive indication»). Da die Gewebeglukose der im Blut vorherrschenden Glukose physiologisch bedingt hinterherhinkt, können gerade bei schnellen Änderungen der Glykämie deutliche Messabweichungen resultieren, was nicht selten zur Verunsicherung bei den Patienten führt. Die Anwender sollten entsprechend instruiert werden, bei Dysglykämie, starker Glukosedynamik oder Zweifel an der Korrektheit des Wertes eine kapilläre Kontrollmessung durchzuführen.
Nebst der einfachen Werteabfrage und der minimalen Invasivität bieten die CGM/FGM-Systeme den grossen Vorteil, die Dynamik des Blutzuckerverhaltens zu erfassen. Glukoseabweichungen können so antizipiert und im Idealfall verhindert werden. Erleichtert wird dies durch Alarme, welche bei Über- oder Unterschreiten selbst definierter Schwellen oder Änderungsraten ausgelöst werden. Zusätzlich besteht die Möglichkeit, die Werte auf Endgeräte (z.B. Smartphone oder Smartwatches) zu übertragen, was die Konnektivität und Verwendbarkeit im Alltag verbessert (beispielsweise Werteübermittlung an Zweitpersonen).
Die Anwendung von CGM/FGM hat auch die Möglichkeiten der Behandlungsteams erweitert. Anhand der Glukoseprofile lassen sich Muster einfacher erkennen und darauf basierend die Therapie präziser anpassen. Die Diabeteseinstellung kann ganzheitlicher erfasst werden als nur mit einer isolierten HbA1c-Messung oder Blutzuckertagesprofilen. Es zeichnet sich ab, dass nicht mehr nur die Durchschnittsglukose (welche mit dem HbA1c-Wert korreliert), sondern die Zeit im Zielbereich (3,9–10mmol/l) sowie die Zeit in Hypoglykämie (<3,9mmol/l) und Hyperglykämie (>10mmol/l) und die Glukosevariabilität wichtige Faktoren bei der Beurteilung der Diabeteseinstellung sind. Diese Parameter können mittels CGM/FGM einfach analysiert und vor dem Hintergrund internationaler Referenzbereiche beurteilt werden.4
Vor Anwendung von CGM-Geräten bedarf es in der Schweiz einer Kostengutsprache bei der Krankenkasse, wobei die Limitatio ein HbA1c ≥8%, Hypoglykämien Grad II/III und den sog. «Brittle»-Diabetes (sehr starke Blutzuckerschwankungen) umfasst. Voraussetzung für die Kostenübernahme eines FGM-Systems ist eine intensivierte Insulintherapie.
«Closed-Loop»-Systeme
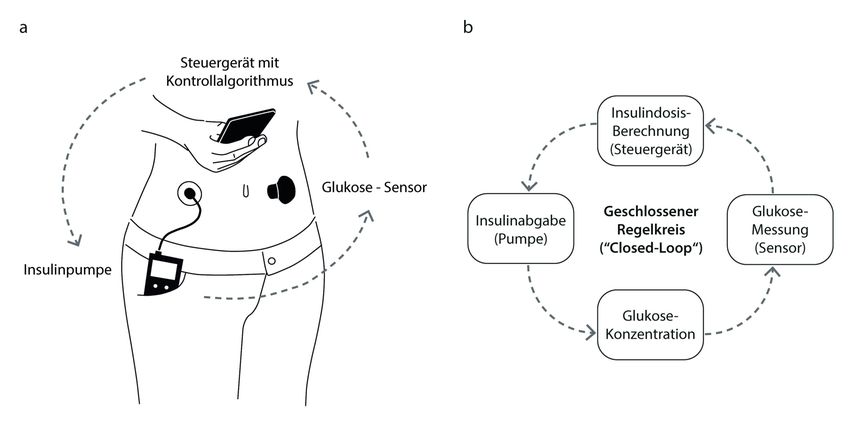
Trotz des zunehmenden Einsatzes dieser neuen Technologien hat sich die Diabeteseinstellung in der vergangenen Dekade nicht wesentlich verbessert.5,6 Gründe für dieses Technologie-Paradoxon sind mannigfaltig: Die Blutzuckereinstellung bei Personen mit Diabetes ist komplex und von zahlreichen Faktoren wie sportlicher Aktivität, Kohlenhydratzufuhr und Insulingabe abhängig. Personen mit einem Diabetes investieren täglich über eine Stunde in ihre Erkrankung und müssen dabei bis zu 600 Entscheidungen treffen.7,8 Unterstützung bezüglich der zu treffenden Entscheidungen liefern diese neuen Technologien bis anhin aber nur bedingt. Nach wie vor besteht ein hoher Grad an Eigenverantwortung seitens der Patienten. Eine Möglichkeit, das Selbstmanagement im Alltag zu vereinfachen, besteht in der Koppelung von Insulinpumpe und kontinuierlichen Glukosemessgeräten unter Zwischenschaltung von Kontrollalgorithmen, welche die Insulinabgabe automatisiert basierend auf den Glukosewerten und deren Dynamik laufend dem individuellen Bedarf anpassen (Abb. 1).9
Abb. 1: a) Ein «Closed-Loop»-System besteht aus einem Glukosesensor, einer Insulinpumpe und einem Kontrollalgorithmus, der sich entweder auf einem Smart Device befindet (wie auf dem Bild) oder direkt in die Insulinpumpe integriert ist. b) Ein «Closed-Loop» imitiert die Funktionsweise einer intakten pankreatischen Betazelle. In einem geschlossenen Regelkreis wird zyklisch evaluiert, wie viel Insulin benötigt wird, um die systemische Glukose im Zielbereich zu halten
Ziel dieser geschlossenen Regelkreise (sog. «Closed-Loop»-System) ist die Nachahmung einer intakten Betazelle, weshalb diese Systeme auch als künstliches Pankreas bezeichnet werden. Hierbei unterscheidet man grundsätzlich zwischen zwei Systemen: «Fully Closed-Loop»-Systeme, welche komplett ohne Einwirken des Patienten funktionieren (aktuell nur in Studien eingesetzt) und solche, welche zusätzliche Informationen wie körperliche Aktivität oder Mahlzeitenankündigung benötigen («Hybrid Closed-Loop [HCL]»-Systeme). Nebst verschiedenen Forschungsgruppen, haben auch sog. «Do it yourself»-Gruppierungen der Entwicklung und dem Einsatz dieser Systeme Vorschub geleistet. Die Algorithmen und Anleitungen für den Selbstbau von «Closed-Loop»-Systemen sind online frei erhältlich («open-source»), wobei Zusammenbau und Programmierung einiges an technischem Wissen voraussetzen und eine behördliche Regulierung fehlt.10 Mittlerweile sind in der Schweiz allerdings auch drei kommerziell erhältliche und damit von Swissmedic zugelassene HCL-Systeme verfügbar. Diese erfreuen sich grosser Beliebtheit, da sie das Diabetesmanagement deutlich vereinfachen und die Diabeteseinstellung signifikant verbessern.11 Im Weiteren scheint deren Einsatz den übrigen Therapieformen in Bezug auf die Blutzuckerkontrolle beim Typ-1-Diabetes überlegen zu sein.12
Künstliche Intelligenz
Schon bei der Auswertung der Blutzuckermesswerte und korrespondierender Insulindosierungen fallen grosse Datenmengen an. Dies hat sich seit Anwendung neuer Technologien (CGM, Insulinpumpen, digitale Insulinpens, «Closed-Loop»-Systeme etc.) deutlich akzentuiert. Zusätzlich fliessen zunehmend Ernährungs- und Bewegungsdaten sowie Komorbiditäten, Begleitmedikation und Laboranalysen in die umfassende Beurteilung der Diabeteseinstellung und die Entscheidung zur Therapieanpassung mit ein. Bei der integrativen Analyse dieser Daten kommen der künstlichen Intelligenz (KI) und dem maschinellen Lernen (ML) eine entscheidende Rolle zu. Diese sind in der Lage, grosse Datenmengen in kurzer Zeit zu analysieren und dabei komplexe Muster und Zusammenhänge zu erfassen. Davon profitieren nicht nur die Patienten, sondern auch die Behandlungsteams, welche mittlerweile einen wesentlichen Teil ihrer Arbeit mit der Auswertung und Interpretation dieser Daten verbringen. Erst kürzlich konnte gezeigt werden, dass eine auf KI beruhende Optimierung der Insulinpumpeneinstellungen der Therapieanpassung durch Fachpersonen nicht unterlegen ist.13 Dies ermöglicht in Zukunft die Anwendung von Applikationen, welche mit dem Patienten interagieren und ihm basierend auf den gewonnenen Daten unmittelbar und automatisiert Therapieempfehlungen unterbreiten, im Sinne von virtuellen persönlichen Assistenten (sog. «Chatbots»).
Auch in anderen Bereichen der Diabetologie wird KI bereits erfolgreich eingesetzt: so beispielsweise beim Retinopathie-Screening oder in der Prädiktion des Diabetes, respektive diabetesbezogener Komplikation.14,15 Dem Einsatz der KI sind kaum Grenzen gesetzt und es bieten sich mit diesen Verfahren neue Lösungsansätze, um praxisrelevante Probleme anzugehen. Bereits gibt es Applikationen, die mithilfe von KI die Makronährstoffzusammensetzung und Kohlenhydratmenge von Mahlzeiten basierend auf einer Fotografie der Mahlzeit erfassen. Auch gibt es Bestrebungen, die Verkehrssicherheit für Personen mit Diabetes durch den Einsatz von KI zu erhöhen. So arbeitet aktuell ein Team von Forschenden des Inselspitals Bern, der ETH Zürich und der Universität St. Gallen daran, Hypoglykämien während des Autofahrens rein basierend auf der Analyse des Fahrverhaltens sowie der Augenbewegungen mittels ML zu erkennen und den Fahrer in Echtzeit zu warnen.
Literatur:
1 Alsaleh FM et al.: Insulin pumps: from inception to the present and toward the future. J Clin Pharm Ther 2010; 35: 127-38 2 Berget C et al.: A clinical overview of insulin pump therapy for the management of diabetes: past, present, and future of intensive therapy. Diabetes Spectr 2019; 32: 194-204 3 Bailey TS et al.: Clinical accuracy of a continuous glucose monitoring system with an advanced algorithm. J Diabetes Sci Technol 2015; 9: 209-14 4 Battelino T et al.: Clinical targets for continuous glucose monitoring data interpretation: recommendations from the International Consensus on Time in Range. Diabetes Care 2019; 42: 1593-603 5 van den Boom L et al.: Temporal trends and contemporary use of insulin pump therapy and glucose monitoring among children, adolescents, and adults with type 1 diabetes between 1995 and 2017. Diabetes Care 2019; 42: 2050-6 6 Foster N et al.: State of type 1 diabetes management and outcomes from the T1D exchange in 2016-2018. Diabetes Technol Ther 2019; 21: 66-72 7 Shubrook J et al.: Time needed for diabetes self-care: nationwide survey of certified diabetes educators. Diabetes Spectr 2018; 31: 267-71 8 Coffen RD: The 600-step program for type 1 diabetes self-management in youth: the magnitude of the self-management task. Postgraduate Med 2009; 121: 119-39 9 Züger T et al.: Moderne Diabetestechnologie – von «Science Fiction» zu «Science Facts». Ther Umsch 2018; 74: 529-36 10 Melmer A et al.: Glycaemic control in individuals with type 1 diabetes using an open source artificial pancreas system (OpenAPS). Diabetes Obes Metab 2019; 21: 2333-7 11 Weisman A et al.: Effect of artificial pancreas systems on glycaemic control in patients with type 1 diabetes: a systematic review and meta-analysis of outpatient randomised controlled trials. Lancet Diabetes Endocrinol 2017; 5: 501-12 12 Pease A et al.: The efficacy of technology in type 1 diabetes: a systematic review, network meta-analysis, and narrative synthesis. Diabetes Technol Ther 2020; 22: 411-21 13 Nimri R et al.: Insulin dose optimization using an automated artificial intelligence-based decision support system in youths with type 1 diabetes. Nat Med 2020; 26: 1380-4 14 Grzybowski A et al.: Artificial intelligence for diabetic retinopathy screening: a review. Eye 2020; 34: 451-60 15 Cahn A et al.: Prediction of progression from pre-diabetes to diabetes: Development and validation of a machine learning model. Diabetes Metab Res Rev 2020; 36: e3252
Das könnte Sie auch interessieren:
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...
Neue Studiendaten zu Typ-2-Diabetes und Lebensstil
Dass gesunde Ernährung und Bewegung das Diabetesrisiko sowie verschiedene Risiken von Patienten mit Diabetes senken, ist seit Langem bekannt. Und das Detailwissen zur Bedeutung von ...
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...