Typ-2-Diabetes und Hepatopathie
Autoren:
Dr. med. Alberto Nascè1
Prof. Dr. med. François R. Jornayvaz1,2,3
1Service d’Endocrinologie, Diabétologie, Nutrition et Education Thérapeutique du Patient
Hôpitaux Universitaires de Genève
2Centre du Diabète de la Faculté de Médecine Université de Genève
3Département de Physiologie Cellulaire et du Métabolisme
Faculté de Médecine, Université de Genève
E-Mail:
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die häufigste mit Diabetes assoziierte chronische Lebererkrankung ist die «non-alcoholic fatty liver disease», kurz NAFLD, die durch eine übermässige Einlagerung von Fett in das Leberparenchym gekennzeichnet ist. Das Verhältnis zwischen NAFLD und Typ-2-Diabetes lässt sich als «unheilige Allianz» beschreiben, bei der jede der beiden Erkrankungen die negativen Aspekte der anderen befeuert.
Die «non-alcoholic fatty liver disease» (NAFLD) ist definiert durch eine Steatose in mindestens 5% der Hepatozyten, nachgewiesen durch histologische oder bildgebende Untersuchungen (Spektroskopie oder quantitative Magnetresonanztomografie mit Möglichkeit der selektiven Detektion von Fett). Um die Diagnose NAFLD stellen zu können, müssen sekundäre Ursachen einer Steatose (bestimmte Medikamente oder andere steatogene Lebererkrankungen) und ein täglicher Alkoholkonsum von ≥30g bei Männern und ≥20g bei Frauen ausgeschlossen werden.1
Der Begriff NAFLD deckt ein grosses Krankheitsspektrum ab. Je nach Schweregrad der Gewebeveränderungen werden zwei wesentliche Krankheitsformen unterschieden: die einfache Steatosis hepatis bzw. Fettleber, auch «non-alcoholic fatty liver» (NAFL) genannt, und die entzündliche Form, die unter dem Begriff «non-alcoholic steatohepatitis» (NASH) bekannt ist. Letztere kann bis zur Entwicklung einer signifikanten Leberfibrose (Stadium ≥F2 gemäss dem pathologisch-anatomischen Scoring-System Metavir) und zu gefürchteten Komplikationen wie der Leberzirrhose und dem hepatozellulärem Karzinom führen.
Epidemiologie
Betrachtet man die Epidemiologie der NAFLD, muss man von einer der Epidemien des Jahrhunderts sprechen. Mit einer Gesamtprävalenz von etwa 25% in der globalen Allgemeinbevölkerung ist sie die weltweit häufigste chronische Lebererkrankung. Die Statistiken aus den USA sind alarmierend: Laut einer aktuellen Metaanalyse von Younossi, einem der führenden NAFLD-Experten weltweit, ist sie verantwortlich für 75,1% der Fälle chronischer Lebererkrankungen, darunter 14,1% hepatozelluläre Karzinome, weshalb die NAFLD auch zu den Indikationen für eine Lebertransplantation zählt.2 Was die Zahlen für die Schweiz anbelangt, prognostiziert eine aktuelle Studie einen deutlichen Anstieg der Prävalenz in der Bevölkerung auf 24,3% bis 2030. Gleichzeitig steigt der prozentuale Anteil der schwersten Formen und die damit verbundene Mortalität.3 Eine aktuelle Metaanalyse mit Fokus auf der Assoziation zwischen NAFLD und Diabetes zeigt, dass die Prävalenz der NAFLD unter Personen mit Typ-2-Diabetes zweimal höher ist als unter Personen ohne Diabetes (Prävalenz von 55−70%). Histologische Untersuchungen zeigen zudem, dass 30–40% der Personen mit Diabetes an einer NASH leiden und 12–20% von ihnen eine signifikante Fibrose (≥F2) aufweisen. Die Zahlen variieren je nach Kontinent, wobei die Daten für die westliche Welt besonders besorgniserregend sind.4
NAFLD und Typ-2-Diabetes – eine «unheilige Allianz»
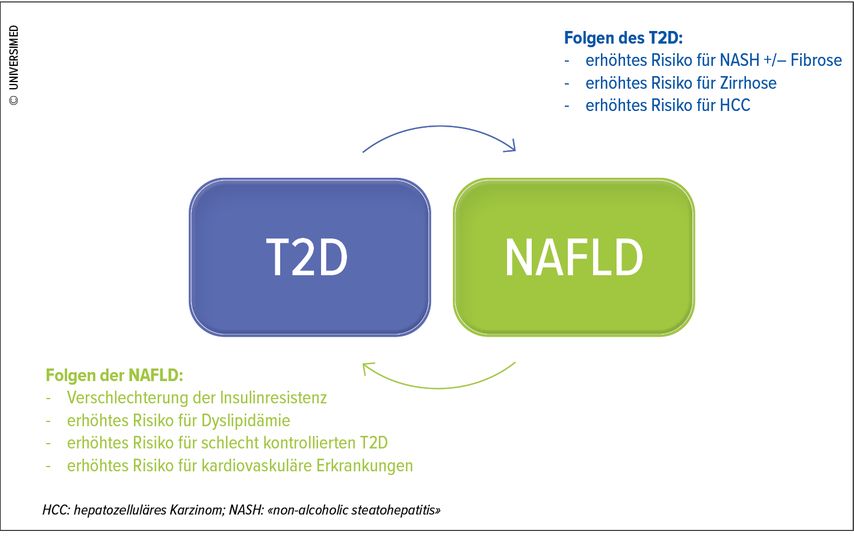
Bei Diagnose eines Typ-2-Diabetes steigt die Wahrscheinlichkeit, auch auf eine NASH, eine Leberzirrhose oder ein hepatozelluläres Karzinom zu treffen. Umgekehrt belegt die Literatur signifikante Assoziationen zwischen der NAFLD und der Entwicklung einer Insulinresistenz, die das Risiko der Entwicklung eines Typ-2-Diabetes erhöht. Das Vorliegen einer NAFLD kann den Diabetes aber auch verstärken und das Risiko für eine Dyslipidämie und kardiovaskuläre Erkrankungen erhöhen (Abb. 1).5
Abb. 1: Die «unheilige Allianz» zwischen Typ-2-Diabetes (T2D) und «non-alcoholic fatty liver disease» (NAFLD) (adaptiert nach Budd & Cusi, 2020)5
Pathophysiologisch gibt es im Wesentlichen zwei Phänomene, die diese «unheilige Allianz» erklären: Insulinresistenz und oxidativer Stress. Die NAFLD kann als Ungleichgewicht zwischen der Bildung von Triglyzeriden in der Leber (durch den Eintrag und die Veresterung freier Fettsäuren) und ihrem Abbau (durch Beta-Oxidation) und Abtransport durch «very low density lipoproteins» (VLDL) betrachtet werden. Die Fettsäuren bezieht die Leber aus drei verschiedenen Quellen: peripheren Geweben, der Nahrung und der De-novo-Lipogenese. Da der Typ-2-Diabetes mit einer peripheren Insulinresistenz und einer Dysfunktion des Fettgewebes assoziiert ist, ist somit klar, dass er zu einem Eintrag freier Fettsäuren in die Leber führt, was das energetische Gleichgewicht destabilisiert. Diese Ansammlung von Fett führt zu einem Anstieg der Konzentration toxischer Lipid-Zwischenprodukte, die im Zuge der Veresterung von Fettsäuren zu Triglyzeriden entstehen. Solche Moleküle aktivieren einerseits verschiedene inflammatorische Signalwege, die für die Blockade des Insulinrezeptors (IR) und in der Folge für eine relevante Insulinresistenz verantwortlich sind. Andererseits produzieren sie verschiedene reaktive Sauerstoffspezies («reactive oxygen species», ROS), die bei der Progression der NAFLD hin zu entzündlichen und fibrotischen Formen eine wichtige Rolle spielen. Neben dem Lipidstoffwechsel kommt auch der Dysbiose des Darmmikrobioms und der durch sie bewirkten Veränderung der Gallensäuren-Zusammensetzung eine grosse Bedeutung zu, da sie letztlich zu einer Verstärkung der Insulinresistenz und der Entzündung führen.6 Um sich gegen den übermässigen Eintrag von Fettsäuren zur Wehr zu setzen, steigern die Hepatozyten die Beta-Oxidation in den Mitochondrien. Der Zitratzyklus und die Elektronentransportkette werden auf eine harte Probe gestellt, ebenso die antioxidativen Systeme, bis ihre Redox-Kapazitäten schliesslich erschöpft sind, was oxidativen Stress und die unkontrollierte Produktion von ROS zur Folge hat.7 Die ROS, die vorrangig von Enzymen produziert werden, die als NADPH-Oxidasen bzw. NOX bezeichnet werden, sind in verschiedener Weise an der Pathogenese der NAFLD und ihrer Assoziation mit Typ-2-Diabetes beteiligt: Sie sind verantwortlich für die Blockade des IR und die Unterstützung verschiedener Entzündungskaskaden und begünstigen so das Fortschreiten der Erkrankung hin zu NASH, Fibrose, Zirrhose und hepatozellulärem Karzinom.8 Insulinresistenz und oxidativer Stress bilden somit einen Teufelskreis, der die metabolische Situation der Patienten unterhält und verschlechtert.
Screening
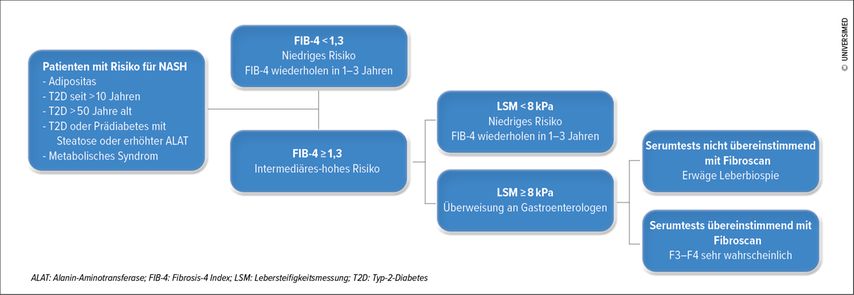
Das Ziel des NAFLD-Screenings ist es, schwere Formen (u.a. NASH) und Formen mit signifikanter Fibrose zu erkennen. Ein pathologisches Fibrosestadium ist meist mit negativen Konsequenzen assoziiert. Multizentrische histologische Studien mit NAFLD-Patienten haben gezeigt, dass die Fibrose das einzige pathologisch-anatomische Merkmal ist, das unabhängig mit der Gesamtmortalität und den hepatischen Komplikationen assoziiert ist.9,10 Gegenwärtig findet kein systematisches NAFLD-Screening in der Allgemeinbevölkerung statt, sondern es richtet sich vielmehr an bestimmte Subgruppen wie etwa Patienten mit Adipositas und Typ-2-Diabetes. In Betracht kommt ein Screening auf NAFLD auch bei Personen mit Prädiabetes oder Typ-2-Diabetes, bei denen in der bildgebenden Diagnostik eine Steatosis festgestellt wird oder die erhöhte ALAT-Werte im Serum aufweisen. Nicht zuletzt sollte bei allen Patienten mit metabolischem Syndrom ein Screening stattfinden.
Mit Blick auf das für das Screening verwendete Verfahren zeigt sich die Tendenz, die Leberbiopsie, die invasiv und teuer ist, aber nach wie vor den Goldstandard für die histologische Diagnostik einer NASH darstellt, nach Möglichkeit zu vermeiden. Da sich die Sonografie der Leber und die Transaminasen als unzuverlässig erwiesen haben (die Leberenzyme sind in 50% der NAFLD-Fälle bei Patienten mit Diabetes normal), setzt man immer häufiger auf die hepatische Elastografie, auch Fibroscan genannt, anhand derer sich mit guter Sensibilität und Spezifität die Steifigkeit des Leberparenchyms beurteilen lässt, sowie auf Serummarker der Fibrogenese (ELF, FibroMeter, FibroTest) und auch Scores zur Stratifikation des Fibroserisikos, insbesondere den Fibrosis-4 Index (FIB-4). FIB-4 ist aktuell anderen, früher angewendeten Scores wie dem NAFLD Fibrosis Score (NFS) überlegen und berücksichtigt vier einfache Parameter: Alter, Thrombozyten, ASAT und ALAT.11
Der Screening-Algorithmus, der in den Leitlinien der European Association For the Study of the Liver (EASL) und der American Diabetes Association (ADA) empfohlen wird, sieht initial die Berechnung des FIB-4-Scores vor. Ist der ermittelte Wert <1,3, wird, wie in Abbildung 2 dargestellt, empfohlen, die Berechnung jährlich zu wiederholen. Bei einem Score ≥1,3 wird ein Fibroscan durchgeführt. In Abhängigkeit von der Steifigkeit der Leber (<8kPa oder ≥8kPa) wird entweder eine jährliche Neuberechnung des FIB-4-Scores oder die Überweisung an einen Spezialisten für Gastroenterologie ins Auge gefasst. Je nachdem, ob die Elastografie-Werte und die Serum-Fibrogenesemarker stimmig sind oder nicht, entscheidet dieser dann, ob eine Leberbiopsie durchgeführt werden muss. Durch Umsetzung dieser Screening-Strategie wird die Anwendung der Leberbiopsie reduziert.11,12
Abb. 2: Algorithmus der Risikostratifikation (adaptiert nach Kanwal et al., 2021, und European Association for the Study of the Liver, 2021)11, 12
Therapie
Gewichtsreduktion
Wir können feststellen, dass wir im Begriff sind, die Epoche hinter uns zu lassen, in der die NAFLD eine Krankheit ohne Behandlung war. Der Eckpfeiler der Behandlung ist aber nach wie vor die Gewichtsreduktion. In einer prospektiven Studie mit 293 Patienten mit histologisch diagnostizierter NASH hat eine Intervention, die das Ziel verfolgte, standardisierte Massnahmen zur Anpassung der Lebensweise umzusetzen, nach 52 Wochen zu einer signifikanten Besserung der pathologisch-anatomischen Parameter geführt. 25% der Patienten erreichten eine Rückbildung der NASH, 47% eine Reduktion des histologischen Entzündungsscores (NAS) und 19% eine Rückbildung der Fibrose. Die besten Ergebnisse wurden bei einem Verlust von mindestens 10% des Ausgangsgewichts verzeichnet.13 Die Ergebnisse nach bariatrischer Operation sind beeindruckend. In den 2000er-Jahren unterzogen sich in Frankreich 190 Patienten mit histologisch diagnostizierter NASH einer Magenbypass-Operation. 12 Monate nach der Operation stellten die Autoren in 85% der histologischen Proben ein Verschwinden der NASH fest, während gleichzeitig Reduktionen mehrerer Entzündungs- und Fibrosescores beobachtet wurden.14
Medikamentöse Therapie
Was die Wirksamkeit von Antidiabetika bei NAFLD anbelangt, führt Metformin, die Erstlinientherapie für Patienten mit Typ-2-Diabetes, nicht zu einer histologischen Besserung der entzündlichen Formen und scheint ein Jahr nach der Behandlung sogar mit einer Verschlechterung der lobulären Entzündung verbunden zu sein.15 DPP4-Inhibitoren haben einen relativ schwachen reduzierenden Effekt auf die Leberverfettung, und bisher gibt es keine Studien, die eine positive Wirkung auf die Leberhistologie bestätigen.
Interessanter sind die SGLT2-Inhibitoren, die in mehreren bildgebenden Studien mit Magnetresonanztomografie mit einer signifikanten Fettreduktion im Leberparenchym assoziiert waren. Auch mit Blick auf die Reduktion bestimmter Serum-Entzündungsparameter und Fibrosemarker haben sie gute Ergebnisse gezeigt. So wurde in einer kleinen japanischen Studie mit Patienten mit Typ-2-Diabetes und NAFLD kürzlich beobachtet, dass die 72-wöchige Behandlung mit Ipragliflozin in 66,7% der Fälle zu einer Rückbildung der NASH führte.16 Bevor diese Klasse von Arzneimitteln in die Therapiestrategien für die NAFLD aufgenommen werden kann, sind jedoch noch weitere Studien nötig.
Mehr Aufmerksamkeit wird aktuell den GLP-1-Rezeptor-Agonisten (GLP-1-RA), den dualen GLP-1-GIP-RA sowie den PPAR(«peroxisome proliferator-activated receptors»)-Agonisten zuteil. Hinsichtlich der ersten Gruppe wurden in einer aktuellen Übersichtsarbeit mehrere bildgebungsgestützte Studien mit einer Dauer von mindestens 24 Wochen und einer Teilnehmerzahl von mindestens 50 Patienten betrachtet. Dabei wurde bei Behandlung mit Liraglutid oder Dulaglutid eine signifikante Reduktion des Leberfettgehalts beobachtet.17 Zwei wichtige histologische Studien ergaben eine Rückbildung der NASH: Armstrong et al. randomisierten 52 Patienten mit Übergewicht und NASH (histologisch diagnostiziert) und konnten zeigen, dass die mit 1,8mg Liraglutid täglich behandelten Patienten nach 48 Wochen der Behandlung in 39% der Fälle eine Rückbildung der NASH erreicht hatten und das Fortschreiten der Fibrose verlangsamt wurde.18 In einer anderen randomisierten klinischen Phase-II-Studie von Newsome et al. mit 320 Patienten mit bioptisch diagnostizierter NASH, von denen 62% an Typ-2-Diabetes litten und die 72 Wochen mit 0,1mg, 0,2mg oder 0,4mg Semaglutid täglich oder Placebo behandelt wurden, führte der GLP-1-RA in jeder der angewendeten Dosierungen zu einer signifikanten Regression der NASH. Eine signifikante Besserung der Leberfibrose wurde jedoch nicht beobachtet.19
Tirzepatid, ein dualer GLP-1-GIP-RA, führte in einer aktuellen klinischen Studie bei Patienten mit Typ-2-Diabetes und Übergewicht nach 52 Wochen der Behandlung zu einer signifikanten Senkung des Leberfettgehalts und des viszeralen und subkutanen Fettgewebevolumens.20
Die PPAR-Agonisten sind im Gegensatz zu den beiden anderen pharmazeutischen Gruppen, die indirekt auf die Leber wirken, indem sie die periphere Insulinresistenz reduzieren und die Gewichtsreduktion unterstützen, durch ihre Wirkung auf das Adipokingleichgewicht in der Lage, die Qualität des Fettgewebes zu verbessern und die hepatische Lipotoxizität zu mindern. Pioglitazon, ein Alpha- und Gamma-Agonist, hat histologisch ein erhebliches Vermögen zur Reduktion der Fibrose von fortgeschrittenen Stadien hin zu weniger schweren (von F3–4 auf F0–2) sowie zur Verbesserung verschiedener Entzündungsscores gezeigt.21 Lanifibranor, ein Pan-PPAR-Agonist, hat bei Patienten mit per Biopsie diagnostizierter NASH nach 24 Wochen der Behandlung zu einer signifikanten Reduktion mehrerer histologischer Entzündungsscores geführt.22 Somit ist festzuhalten, dass PPAR-Agonisten ein probates Mittel sind, das uns für die Behandlung fortgeschrittener Formen der NAFLD zur Verfügung steht. Angesichts der unerwünschten Wirkungen in Bezug auf Körpergewicht und Herzinsuffizienz könnte künftig eine Kombination mit GLP-1-RA oder SGLT2-Inhibitoren in Betracht kommen.
Weitere Therapien, die sich aktuell in der Pipeline befinden, zielen entweder darauf ab, die Insulinsensitivität zu steigern (z.B. duale GLP-1-Glukagon-RA) oder die intraparenchymatöse Triglyzeridproduktion zu blockieren (z.B. Fettsäure-Synthase-Inhibitoren). Auch antioxidative Substanzen (z.B. NOX-Inhibitoren) und Gentherapien können künftig eine Rolle spielen.
In Erwartung der weiteren Entwicklungen sieht unsere therapeutische Strategie für Patienten mit Typ-2-Diabetes und NAFLD im Moment Folgendes vor: Wenn sie eine NAFL oder NASH ohne signifikante Fibrose aufweisen, bleibt die antidiabetische Therapie unverändert. Ist die Fibrose jedoch signifikant, sollte auf GLP-1-Rezeptor-Agonisten und Pioglitazon zurückgegriffen werden. Bei Bestehen einer Zirrhose (F4) ist allerdings eine multidisziplinäre Personalisierung der therapeutischen Strategie nötig.11
Literatur:
1 European Association for the Study of the Liver (EASL); European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol 2016; 64: 1388-402 2 Younossi ZM et al.: The global epidemiology of NAFLD and NASH in patients with type 2 diabetes: A systematic review and meta-analysis. J Hepatol 2019; 71: 793-801 3 Goossens N et.: Nonalcoholic fatty liver disease burden − Switzerland 2018-2030. Swiss Med Wkly 2019; 149: w20152 4 Stefan N, Cusi K: A global view of the interplay between non-alcoholic fatty liver disease and diabetes. Lancet Diabetes Endocrinol 2022; 10: 284-96 5 Budd J, Cusi K: Role of agents for the treatment of diabetes in the management of nonalcoholic fatty liver disease. Curr Diab Rep 2020; 20: 59 6 Byrne CD, Targher G: NAFLD: a multisystem disease. J Hepatol 2015; 62(Suppl 1): 47-64 7 Tilg H et al.: NAFLD and diabetes mellitus. Nat Rev Gastroenterol Hepatol 2017; 14: 32-42 8 Nascè A et al.: NADPH oxidases connecting fatty liver disease, insulin resistance and type 2 diabetes: current knowledge and therapeutic outlook. Antioxidants 2022; 11: 1131 9 Angulo P et al.: Liver fibrosis, but no other histologic features, is associated with long-term outcomes of patients with nonalcoholic fatty liver disease. Gastroenterology 2015; 149: 389-97 10 Sanyal AJ et al.: Prospective study of outcomes in adults with nonalcoholic fatty liver disease. N Engl J Med 2021; 385: 1559-69 11 Kanwal F et al.: Preparing for the NASH epidemic: a call to action. Diabetes Care 2021; 44: 2162-72 12 European Association for the Study of the Liver: EASL Clinical Practice Guidelines on non-invasive tests for evaluation of liver disease severity and prognosis − 2021 update. J Hepatol 2021; 75: 659-89 13 Vilar-Gomez E et al.: Weight loss through lifestyle modification significantly reduces features of nonalcoholic steatohepatitis. Gastroenterology 2015; 149: 367-78 14 Lassailly G et al.: Bariatric surgery reduces features of nonalcoholic steatohepatitis in morbidly obese patients. Gastroenterology 2015; 149: 379-88 15 Said A, Akhter A: Meta-analysis of randomized controlled trials of pharmacologic agents in non-alcoholic steatohepatitis. Ann Hepatol 2017; 16: 538-47 16 Takahashi H et al.: Ipragliflozin improves the hepatic outcomes of patients with diabetes with NAFLD. Hepatol Commun 2022; 6: 120-32 17 Patel Chavez C et al.: The emerging role of glucagon-like peptide-1 receptor agonists for the management of NAFLD. J Clin Endocrinol Metab 2022; 107: 29-38 18 Armstrong MJ et al.: Liraglutide safety and efficacy in patients with non-alcoholic steatohepatitis (LEAN): a multicentre, double-blind, randomised, placebo-controlled phase 2 study. Lancet 2016; 387: 679-90 19 Newsome PN et al.: A placebo-controlled trial of subcutaneous semaglutide in nonalcoholic steatohepatitis. N Engl J Med 2021; 384: 1113-24 20 Gastaldelli A et al.: Effect of tirzepatide versus insulin degludec on liver fat content and abdominal adipose tissue in people with type 2 diabetes (SURPASS-3 MRI): a substudy of the randomised, open-label, parallel-group, phase 3 SURPASS-3 trial. Lancet Diabetes Endocrinol 2022; 10: 393-406 21 Musso G et al.: Thiazolidinediones and advanced liver fibrosis in nonalcoholic steatohepatitis: a meta-analysis. JAMA Intern Med 2017; 177: 633-40 22 Francque SM et al.: A randomized, controlled trial of the pan-PPAR agonist lanifibranor in NASH. N Engl J Med 2021; 385: 1547-58
Das könnte Sie auch interessieren:
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...
Neue Studiendaten zu Typ-2-Diabetes und Lebensstil
Dass gesunde Ernährung und Bewegung das Diabetesrisiko sowie verschiedene Risiken von Patienten mit Diabetes senken, ist seit Langem bekannt. Und das Detailwissen zur Bedeutung von ...
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...