Sheehan-Syndrom als postpartales Risiko
Autor:innen:
Dr. Clemens Harer
Priv.-Doz. Dr. Gerlies Treiber
Universitätsklinik für Innere Medizin
Abteilung für Endokrinologie und Diabetologie Medizinische Universität Graz
E-Mail: clemens.harer@medunigraz.at
Bei Patientinnen nach postpartaler Blutung ist in der klinischen Routine ein besonderer Umgang erforderlich. Für die rechtzeitige Diagnose eines Sheehan-Syndroms – einer postpartalen endokrinologischen Komplikation – müssen hinweisende Symptome erkannt sowie Patientinnen mit erhöhtem Risiko, wie z.B. Patientinnen mit mitochondrialem Diabetes mellitus, stratifiziert werden.
Keypoints
-
Das Auftreten eines Sheehan-Syndroms kann durch Vorhandensein von MIDD begünstigt sein.
-
Die m.3243A>G-Variante im MT-TL1-Gen der mitochondrialen DNA ist die häufigste Ursache für MIDD.
-
Im Rahmen eines Sheehan-Syndroms kann es zur erhöhten Insulinsensitivität oder zu Hypoglykämieneigung (Houssay-Phänomen) kommen.
-
Ein basaler Hormonstatus sollte bei vorhandener Prädisposition nach einer Post-partum-Blutung durchgeführt werden.
Mitochondrialer Diabetes mellitus ist eine genetische Erkrankung, bei der es aufgrund von Mutation oder Deletion der mitochondrialen DNA (mtDNA) zur Störung der Atmungskette in den Mitochondrien kommt. Da für die Synthese von Steroidhormonen sowie auch Peptidhormonen wie Insulin große Mengen an Energie (ATP) notwendig sind, kann es abhängig von der Krankheitsausprägung zur insuffizienten Hormonproduktion und somit Manifestation endokrinologischer Erkrankungen kommen. Die Entstehung von MIDD („Maternally Inherited Diabetes and Deafness“) ist vor allem durch Punktmutationen in der mtDNA wie z.B. in den Genen MT-TL1, MT-TK, MT-TS2 oder MT-TE bedingt. Die bei 80% mit dieser Krankheit am häufigsten vorliegende Variante ist m.3243A>G im MT-TL1-Gen, die typischerweise zur Innenohrschwerhörigkeit in jungen Jahren in Kombination mit Diabetes mellitus führt.1,2 MIDD wird häufig unterdiagnostiziert, obwohl die Prävalenz geschätzt bis zu 2,8% aller Diabetesformen ausmacht. Obgleich ca. 0,14% der Bevölkerung diese Variante tragen, erkranken nur jene mit erhöhtem Heteroplasmiegrad (Verteilung und Menge betroffener Zellen bzw. Gewebe mit mutierter mitochondrialer DNA).3
Die Variante m.3243A>G ist auch die Ursache für das MELAS(„Mitochondrial Encephalopathy, Lactacidosis and Stroke-like episodes“)-Syndrom, welches typischerweise charakterisiert ist durch erhöhte Laktatwerte, Enzephalopathie und/oder Epilepsie und Schlaganfall-ähnliche Symptome (MRT-Läsionen, die nicht den gefäßtypischen Regionen entsprechen). Aber auch andere, sich teils mit MIDD überschneidende Symptome, wie Gangstörungen sowie weitere renale (Nephropathie) oder kardiale Manifestationen (Hypertrophie) unabhängig vom Diabetes mellitus, können bestehen.4
Hintergrund des Sheehan-Syndroms
Das Sheehan-Syndrom,benannt nach seinem Entdecker,wurde erstmals 1937 beschrieben als Hypopituitarismus nach hämorrhagischem Schock oder Blutung mit Hypotension während oder nach der Geburt.5 Postpartale Blutungen sind auch heute noch die Hauptursache für maternalen Tod (10/100000 in westlichen Ländern). Die Inzidenz für das Sheehan-Syndrom in westlichen Ländern beträgt mittlerweile nur noch 2–5/100000 Einwohner,6 anders als in Entwicklungsländern, wo die Inzidenz bis zu 100-fach höher sein kann.7 Im Mittel dauert es neun Jahre, bis dieses Syndrom diagnostiziert wird.8
Die typischen Symptome gehen mit eingeschränkter Laktation sowie mit fehlendem Wiederbeginn der Menstruation der Mutter einher. Je nach betroffener Hormonachse (totale oder partielle Hypophyseninsuffizienz) können aber auch andere Symptome wie Müdigkeit, Abgeschlagenheit sowie laborchemisch eine Hyponatriämie oder Hypoglykämie ein frühes diagnostisches Zeichen sein. Als mögliche Ursachen werden Vergrößerung des Hypophysenvorderlappens, seltener des Hypophysenhinterlappens, Vasospasmus, Einblutung, Gefäßkompression oder Thrombose im Bereich der Hypophyse vermutet. Auch wenn das Sheehan-Syndrom nicht mit anderen Autoimmunerkrankungen assoziiert ist, können Hypophysenantikörper positiv sein.
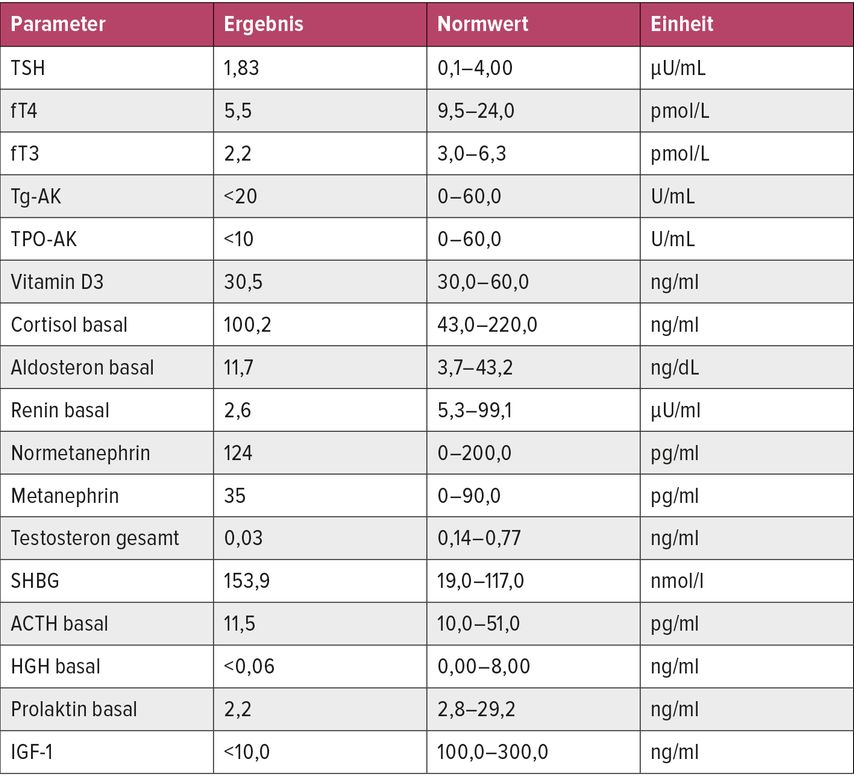
Bei klinischem Verdacht sollte in erster Linie ein basaler Hormonstatus mit fT3, fT4, TSH, Cortisol, ACTH, Prolaktin, FSH, LH, Estradiol und IGF-1 bestimmt werden. Eine weiterführende Bildgebung mittels MRT zeigt in der Akutphase eine vergrößerte, in der chronischen Phase meist eine kleine oder leere Hypophyse. Ergänzende diagnostische Tests wie beispielsweise ein GH-Stimulationstest sind im Zweifel sinnvoll.9
Eine frühzeitige Diagnose von MIDD ist wichtig, da es abhängig vom Anteil der mutierten mtDNA in den verschiedenen Zellen zu unterschiedlichen Einschränkungen der Energieproduktion kommen kann und die jeweilige Organfunktion beeinträchtigt wird. Bei Frauen mit MIDD kommt es daher zu einer erhöhten Rate an Aborten sowie zu einem erhöhten Risiko für Gestosen.10 Dass insbesondere Frauen mit MIDD bei postpartalen Blutungen vulnerabler sein können, ein Sheehan-Syndrom zu entwickeln, zeigt der folgende Fall:
Patientenkasuistik
Praxistipp
Aufgrund der eingeschränkten Energieproduktion bei Mitochondriopathien können mehrere Organfunktionen beeinträchtigt sein, weshalb eine frühzeitige Diagnose bei Verdacht auf MIDD wichtig ist.Eine 39-jährige Patientin (BMI: 18kg/m2) mit vorbestehendem insulinpflichtigem Diabetes mellitus (DM) seit ca. 10 Jahren gab in der postpartalen Kontrolle vermehrte Müdigkeit und Schwindel an. Wegen rezidivierender Hypoglykämien wurde die Insulintherapie seit Geburt ihres Kindes bereits pausiert. Die Schwangerschaft und die Geburt selbst waren komplikationsreich mit Blutungen, Zervixinsuffizienz sowie Gestose, worauf es zur Entbindung in der 37. Schwangerschaftswoche kam. Die Geburt erfolgte mit Vakuumextraktion. Aufgrund notwendiger manueller Plazentalösung kam es zu einem substitutionspflichtigen Blutverlust. Im Laborbefund sowie im initialen Hormonstatus (Tab. 1) zeigte sich eine partielle Hypophyseninsuffizienz, im MRT des Schädels eine kleine Hypophyse – vereinbar mit Zustand nach postpartaler Einblutung ohne Hinweis auf ein Adenom. Es wurde ein Sheehan-Syndrom mit (initial partieller) Hypophyseninsuffizienz diagnostiziert und eine entsprechende Substitution eingeleitet. Im Rahmen der Abklärung des DM zeigten sich mehrfach DM-Typ-1(T1D)-negative Autoantikörper sowie ein noch erhaltenes C-Peptid. Eine genetische Abklärung auf bekannte MODY-Gene (HNF1A, GCK, HNF4A sowie HNF1B) war negativ. Aufgrund einer progredienten Innenohrschwerhörigkeit erfolgte dann eine weitere genetische Untersuchung auf MIDD. Eine m.3243A>G-Variante im MT-TL1-Gen der mitochondrialen tRNALEU(UUR) in heteroplasmischer Form bestätigte das Vorliegen von MIDD.11
Houssay-Phänomen
Da sich beim dargestellten Fall initial eine Erhöhung der Insulinsensitivität mit konsekutiven rezidivierenden Hypoglykämien und Absetzen der Insulintherapie als Folge zeigte, sei an dieser Stelle auch das Houssay-Phänomen erwähnt. Beim Auftreten einer (partiellen) Hypophyseninsuffizienz, bei der es in erster Linie zu verringerter Freisetzung von ACTH und/oder GH kommt, kann der Wegfall dieser Hormone einen geringeren Insulinbedarf bewirken.12 Obwohl das Houssay-Phänomen zuerst im Tiermodell beobachtet wurde, konnte es in einigen Fallberichten beschrieben werden und könnte bei Patientinnen mit DM wegweisend für die Diagnose eines Sheehan-Syndroms sein.13–16
Schlussfolgerung
Das Sheehan-Syndrom stellt eine postpartale Komplikation dar, die meist verzögert mit einer (partiellen) Hypophyseninsuffizienz einhergeht. Mitochondriale Erkrankungen wie MIDD können in diesem Zusammenhang das Auftreten eines Sheehan-Syndroms aufgrund prädisponierender Vulnerabilität in hormonproduzierenden Zellen begünstigen. Bei Patientinnen mit vorbekanntem DM sowie Hypakusis ist zudem an eine alternative Diabetesdiagnose, wie MIDD, zu denken. Diese Patientinnen haben in der Schwangerschaft wie auch postpartal erhöhte Risiken und bei Blutungskomplikationen während oder nach der Geburt somit eine höhere Wahrscheinlichkeit für eine Beeinträchtigung der Hypophyse. In der Diagnostik sind zwingend die Bestimmung eines basalen Hormonstatus und bei entsprechendem Verdacht ein MRT der Hypophyse durchzuführen.
Literatur:
1 Schaefer AM et al.: Endocrine disorders in mitochondrial disease. Mol Cell Endocrinol 2013; 379(1-2): 2-11 2 Chow J et al.: Mitochondrial disease and endocrine dysfunction. Nat Rev Endocrinol 2017; 13(2): 92-104 3 Elliott HR et al.: Pathogenic mitochondrial DNA mutations are common in the general population. Am J Hum Genet 2008; 83(2): 254-60 4 El-Hattab AW et al.: Glucose metabolism derangements in adults with the MELAS m.3243A>G mutation. Mitochondrion 2014; 18: 63-9 5 Sheehan HL: Post-partum necrosis of the anterior pituitary. Trans Edinb Obstet Soc 1938; 58: 13-28 6 Karaca Z et al.: Sheehan syndrome. Nat Rev Dis Primers 2016; 2: 16092 7 Subtil D et al.: Postpartum hemorrhage: frequency, consequences in terms of health status, and risk factors before delivery. J Gynecol Obstet Biol Reprod (Paris) 2004; 33(8): 4S9-16 8 Ramiandrasoa C et al.: Delayed diagnosis of Sheehan’s syndrome in a developed country: a retrospective cohort study. Eur J Endocrinol 2013; 169(4): 431-8 9 Kelestimur F: Sheehan’s syndrome. Pituitary 2003; 6(4): 181-8 10 Say RE et al.: Mitochondrial disease in pregnancy: a systematic review. Obstet Med 2011; 4(3): 90-4 11 Harer C et al.: Sheehan-Syndrom als postpartales Risiko bei mitochondrialem Diabetes mellitus. Journal für Klinische Endokrinologie und Stoffwechsel 2023; 16(1): 29 12 Harvey JC, De Klerk J: The Houssay phenomenon in man. Am J Med 1955; 19(3): 327-36 13 Hadithi M et al.: The Houssay phenomenon, another clue to Sheehan’s syndrome in a diabetic. Diabet Med 2002; 19(9): 795 14 Pramanik S et al.: Lesson of the month 2: Houssay phenomenon - hypopitutarism leading to remission of diabetes. Clin Med (Lond) 2016; 16(3): 294-6 15 Gaffar Mohammed M et al.: Recurrent hypoglycemia in diabetic patient with hypopituitarism: the Houssay phenomenon. Cureus 2021; 13(2): e13422 16 Rizwan T et al.: Hypopituitarism presenting as recurrent episodes of hypoglycemia: Houssay phenomenon. Cureus 2023; 15(4): e37530
Das könnte Sie auch interessieren:
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...
Neue Studiendaten zu Typ-2-Diabetes und Lebensstil
Dass gesunde Ernährung und Bewegung das Diabetesrisiko sowie verschiedene Risiken von Patienten mit Diabetes senken, ist seit Langem bekannt. Und das Detailwissen zur Bedeutung von ...
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...