Eine neue Medikamentenklasse für Typ-2-Diabetes
Bericht:
Dr. med. Norbert Hasenöhrl
Medizinjournalist
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mit Tirzepatid steht nun erstmals ein dualer Inkretinagonist als injizierbare Therapie des Typ-2-Diabetes vor der Zulassung. Im SURPASS-Studienprogramm erwies sich Tirzepatid als signifikant besser als Placebo, Semaglutid und Insulin degludec. In SURPASS-3 senkte Tirzepatid das HbA1c stärker als das Insulinanalogon und führte im Gegensatz zu diesem auch zu erheblichen Gewichtsabnahmen.
Das «glucose-dependent insulinotropic polypeptide» (GIP) ist, ebenso wie GLP-1, ein Inkretinhormon, das in den K-Zellen des Duodenums gebildet wird und bei gesunden Menschen für den Grossteil der insulinotropen Inkretineffekte verantwortlich ist.1 GIP reguliert die Insulinsekretion abhängig vom Glukosespiegel; bei Hyperglykämie unterdrückt es die Glukagonsekretion, während es diese bei normalen oder niedrigen Blutzuckerspiegeln anregt. Da GIP-Rezeptoren, im Gegensatz zu GLP-1-Rezeptoren, im Fettgewebe reichlich vorhanden sind, übt GIP auch weitere Effekte aus, wie eine Verbesserung der Insulinsensitivität, der Lipidhomöostase und des Energiemetabolismus.2,3
Tirzepatid
Bei Tirzepatid handelt es sich um ein (noch nicht zugelassenes) synthetisches Polypeptid aus 39 Aminosäuren, das sowohl an den GLP-1- als auch an den GIP-Rezeptoren agonistisch wirkt und somit eine duale Wirkung aufweist.4 Seine Halbwertszeit liegt bei fünf Tagen, was eine Verabreichung einmal wöchentlich erlaubt. Das SURPASS-Studienprogramm evaluiert Tirzepatid in Phase III. Die SURPASS-1-Studie zeigte die Überlegenheit von Tirzepatid gegenüber Placebo.5 In der Studie SURPASS-2 wurde Tirzepatid mit dem GLP-1-Rezeptor-Agonisten Semaglutid verglichen.6 Hier zeigte sich nach 40 Wochen bezüglich der HbA1c-Veränderung nicht nur Nichtunterlegenheit gegenüber Semaglutid, sondern sogar Überlegenheit. Zudem zeigte sich in diesen beiden Studien eine Assoziation von Tirzepatid mit einer Reduktionen von Blutdruck sowie Triglyzerid- und VLDL-Konzentration und ein Anstieg der HDL-Konzentration.5,6
Die SURPASS-3-Studie
Auch die am EASD-Kongress 2021 präsentierte und gleichzeitig in «Lancet» publizierte Studie SURPASS-3 war eine Phase-III-Studie. In diesem Fall wurden drei Dosierungen von Tirzepatid (5mg, 10mg, 15mg), jeweils einmal wöchentlich verabreicht und mit einmal täglich gegebenem Insulin degludec (einem Insulinanalogon mit langer Wirkdauer) verglichen.7
SURPASS-3 war eine multizentrische, randomisierte, aktiv kontrollierte, offene Parallelgruppenstudie, die an 122 Zentren in 13 Ländern durchgeführt wurde. Eingeschlossen wurden mindestens 18 Jahre alte, Patienten mit einem schlecht eingestellten Typ-2-Diabetes (T2D) (HbA1c 7,0–10,5%), die zuvor kein Insulin erhalten hatten. Sie mussten sich mindestens drei Monate lang unter einer stabilen Therapie mit Metformin ± einem SGLT2-Hemmer (SGLT2-I)befunden haben. Ihr BMI musste ≥25kg/m2 betragen und die letzten drei Monate stabil geblieben sein (keine Schwankungen des Körpergewichts von mehr als 5%).7
Die wichtigsten Ausschlusskriterien waren Typ-1-Diabetes, Pankreatitis, proliferative Retinopathie bzw. Makulopathie in der Anamnese und eine glomeruläre Filtrationsrate (eGFR) <45ml/min/1,73m2.
Die Teilnehmer wurden randomisiert im Verhältnis 1:1:1:1 einer der drei Tirzepatid-Dosierungen oder Insulin degludec zugeteilt. Bei der Randomisierung erfolgte eine Stratifizierung bezüglich Land, Ausgangs-HbA1c (≤8,5% vs. >8,5%) und oraler Medikation (Metformin allein vs. Metformin plus SGLT2-I). Von einer Verblindung wurde wegen der unterschiedlichen Applikations- und Titrationsschemata und der unterschiedlichen Injektionsgeräte für Tirzepatid bzw. Insulin degludec abgesehen.
Tirzepatid wurde einmal wöchentlich subkutan verabreicht. Dabei betrug die Anfangsdosis für die ersten vier Wochen 2,5mg. Diese wurde dann alle vier Wochen um 2,5mg gesteigert, bis die jeweilige Zieldosis erreicht war. Wenn eine geplante Dosis aufgrund von gastrointestinalen Nebenwirkungen trotz Gegenmassnahmen (z.B. kleinere Mahlzeiten, symptomatische Medikation) nicht vertragen wurde, oblag es dem jeweiligen Behandler, den Patienten mit der höchsten vertragenen Tirzepatid-Dosis zu behandeln. Insulin degludec wurde einmal täglich subkutan mittels eines Pens injiziert. Die Initialdosis betrug 10E und wurde wöchentlich auf einen Nüchternblutzucker (NBZ) von <5mmol/l hin titriert.
Die Verwendung anderer blutzuckersenkender Medikamente, ausser Metformin, SGLT2-I und den Studienmedikamenten, war nur zu Notfallzwecken erlaubt.
Der primäre Endpunkt war die mittlere HbA1c-Veränderung von Studienbeginn bis Woche 52, um die Nichtunterlegenheit von 10mg bzw. 15mg Tirzepatid gegenüber Insulin degludec nachzuweisen. Dafür wurde ein Grenzwert von 0,3% festgelegt. Die sekundären Endpunkte umfassten u.a. die Veränderung des Körpergewichts, den Anteil der Patienten, die zu Woche 52 ein HbA1c <7% erreichten, die Veränderung des NBZ zu Woche 52, den Anteil der Patienten, die ein HbA1c <6,5% bzw. <5,7% erreichten, und den Anteil der Patienten, die ≥5%, ≥10% resp. ≥15% ihres Körpergewichts verloren. Exploratorische Endpunkte waren Lipidveränderungen (Gesamtcholesterin, LDL, HDL, VLDL und Triglyzeride), Bauchumfang und BMI.
Die Sicherheitsendpunkte umfassten alle unter Therapie aufgetretenen unerwünschten Wirkungen (UAW), frühen Studienabbruch wegen UAW, pankreatische UAW, Veränderungen des Serum-Calcitonins, allergische und Überempfindlichkeitsreaktionen, Auftreten von Antikörpern gegen Tirzepatid, Veränderungen von Herzfrequenz, systolischem und diastolischem Blutdruck, hypoglykämische Ereignisse (≤3,9mmol/l) einschliesslich schwerer Hypoglykämien.7
Tirzepatid überlegen
Von den ursprünglich 1947 gescreenten Teilnehmern wurden schliesslich 1444 randomisiert. Die mITT-Population («modified intention to treat») bestand aus 1437 Teilnehmern (die zumindest eine Dosis einer Studienmedikation erhalten hatten). 1325 Teilnehmer (92% von 1437) beendeten die Studie, 1230 (85% von 1437) erhielten die vollständige Behandlung.
Das durchschnittliche Alter lag knapp über 57 Jahren; Männer waren mit 56% leicht in der Überzahl. Das Ausgangs-HbA1c betrug im Durchschnitt 8,17%, wobei 70% ein HbA1c ≤8,5% aufwiesen, 30% ein HbA1c >8,5%. Die durchschnittliche Krankheitsdauer betrug 8,4 Jahre. Der mittlere Ausgangs-NBZ lag bei 9,4mmol/l. 68% erhielten Metformin als Monotherapie, 32% zusätzlich einen SGLT2-I. Das durchschnittliche Körpergewicht lag bei 94,3kg, der durchschnittliche BMI bei 33,5kg/m2. Der mittlere Blutdruck betrug 132/79mmHg, die mittlere Pulsfrequenz 75/min. Die durchschnittliche eGFR lag bei 94,1ml/min/1,73m2; nur 4% hatten eine eGFR <60ml/min/1,73m2.
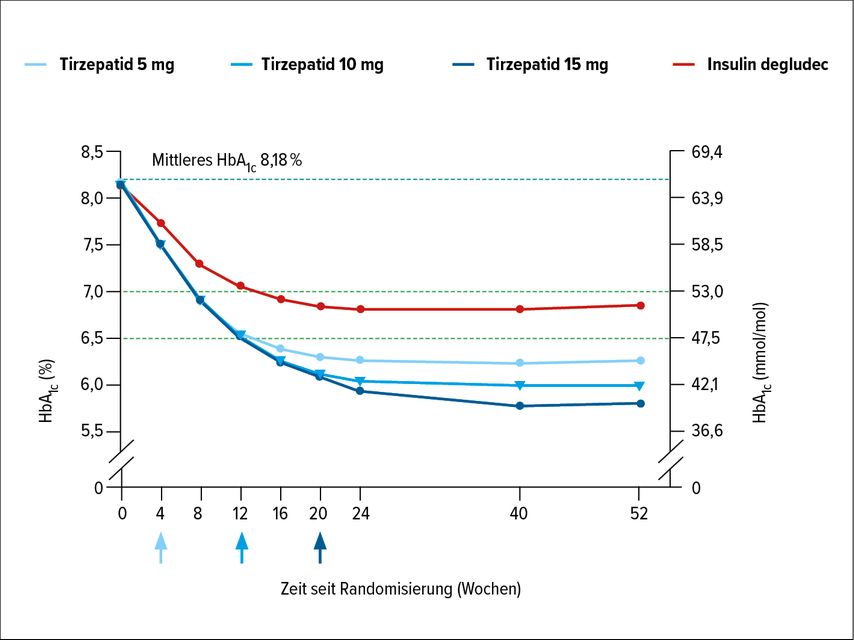
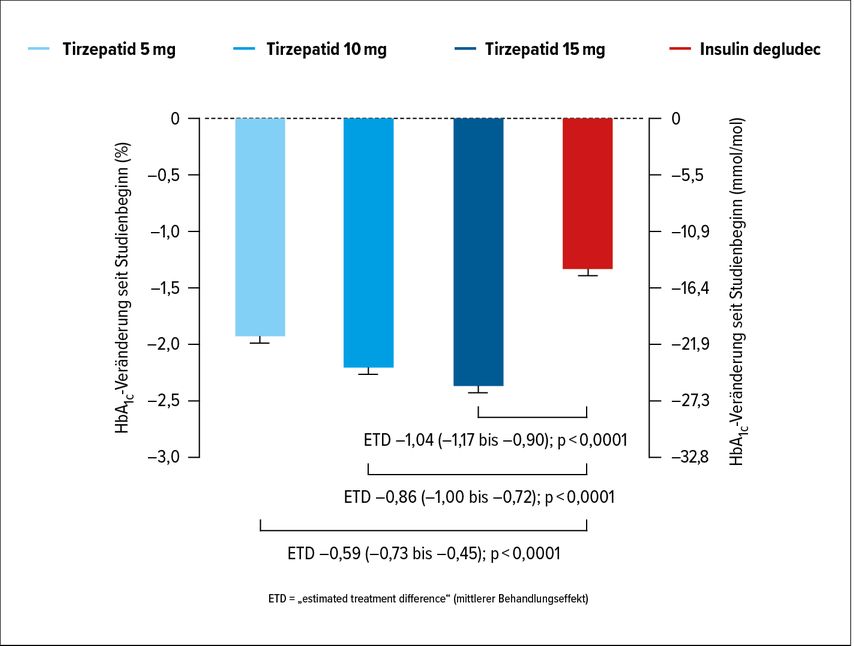
Abbildung 1 zeigt den primären Endpunkt. Nach 52 Wochen hatte sich der durchschnittliche HbA1c-Wert unter Tirzepatid 5mg um 1,93% verringert, unter Tirzepatid 10mg um 2,20%, unter Tirzepatid 15mg um 2,37% und unter Insulin degludec um 1,34% (Abb. 2).7 Sämtliche Unterschiede zwischen Tirzepatid und Insulin degludec waren statistisch signifikant (Abb. 2). Für Tirzepatid 10 und 15mg wurde statistisch nicht nur Nichtunterlegenheit, sondern Überlegenheit gegenüber Insulin degludec festgestellt. Zwischen der Gruppe, die eine Metformin-Monotherapie erhalten hatte, und jener mit der Kombination Metformin/SGLT2-I fand sich kein Unterschied hinsichtlich des HbA1c zu Woche 52.
Ein HbA1c <7,0% erreichten unter Tirzepatid 5mg 82% der Teilnehmer, unter Tirzepatid 10mg 90%, unter Tirzepatid 15mg 93% und unter Insulin degludec 61%. Die analogen Raten für das Ziel eines HbA1c ≤6,5% betrugen 71%, 80%, 85% und 44%, für das Ziel eines HbA1c <5,7% lagen sie bei 26%, 39%, 48% und 5%. Auch hier waren alle Vergleiche jeglicher Tirzepatid-Gruppe mit Insulin degludec statistisch signifikant.
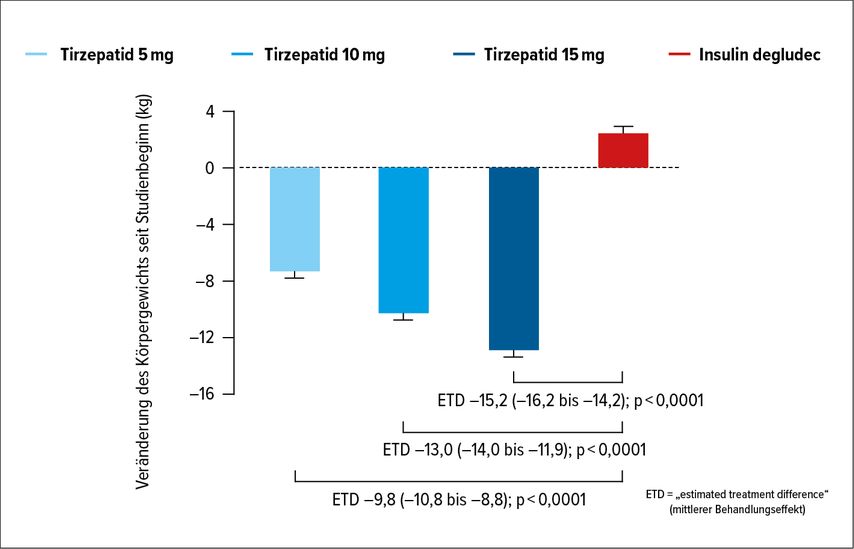
Der NBZ verringerte sich bis Woche 52 unter Tirzepatid 5mg um 2,68mmol/l, unter Tirzepatid 10mg um 3,04mmol/l, unter Tirzepatid 15mg um 3,29mmol/l und unter Insulin degludec um 3,09mmol/l.7 Das Körpergewicht sank bis Woche 52 unter Tirzepatid 5mg um 7,5kg, unter Tirzepatid 10mg um 10,7kg, unter Tirzepatid 15mg um 12,9kg, während es unter Insulin degludec um 2,3kg anstieg (Abb. 3).Auch in diesem Fall war der Vergleich zwischen den Tirzepatid-Gruppen und Insulin degludec jeweils statistisch signifikant.
Tirzepatid 10mg und 15mg senkten die Triglyzeride und das VLDL-Cholesterin signifikant und stärker als Insulin degludec. Alle Tirzepatid-Dosen erhöhten das HDL-C signifikant, während Insulin degludec hier keinen messbaren Effekt hatte. Das Gesamtcholesterin und das LDL-C verhielten sich nicht verschieden im Vergleich der Gruppen.
Tirzepatid bewirkte auch signifikante Senkungen des systolischen (–4,9 bis –6,6mmHg) und diastolischen Blutdrucks (–1,9 bis –2,5mmHg), während Insulin degludec hier keine Wirkung zeigte.7
Unerwünschte Wirkungen
Die häufigsten UAW unter Tirzepatid waren leichte bis mittelschwere gastrointestinale Störungen, die im Lauf der Zeit abnahmen. UAW, die unter Tirzepatid häufiger auftraten als unter Insulin degludec, waren Nausea (12–24% vs. 2%), Diarrhö (15–17% vs. 4%), verminderter Appetit (6–12% vs. 1%) und Erbrechen (6–10% vs. 1%).
Schwere Hypoglykämien (BZ <3mmol/l) wurden in den Tirzepatid-Gruppen bei 1%, 1% resp. 2% berichtet, unter Insulin degludec bei 7%.
Behandlungsabbrüche wegen UAW traten in den Tirzepatid-Gruppen häufiger auf als unter Insulin degludec. Es gab in der Studienpopulation insgesamt fünf Todesfälle, von denen jedoch keiner mit der Studienmedikation in Verbindung gebracht werden konnte.7
Kommentar von Erstautor Prof. Dr. med. Bernhard Ludvik
Mit Tirzepatid steht nun in vermutlich absehbarer Zeit der erste duale Rezeptoragonist zur Behandlung des Typ-2-Diabetes zur Verfügung. Der Vergleich mit dem Basisinsulin Degludec zeigt eindrucksvoll die Überlegenheit in Bezug auf Diabeteseinstellung, Körpergewichtsreduktion und Sicherheit, vor allem hinsichtlich des Auftretens von Hypoglykämien. Bei Tirzepatid handelt es sich um das bisher am stärksten wirkende Antidiabetikum. Das Nebenwirkungsprofil entspricht dem von GLP-1-Rezeptoragonisten und ist somit akzeptabel. Natürlich fehlen noch die Ergebnisse der kardiovaskulären Endpunktstudie, in welcher Trizepatid mit Dulaglutid verglichen wird, zu dem ja bereits eine positive Endpunktstudie existiert. Aufgrund der günstigen Wirkung nicht nur auf den Blutzucker, sondern auch auf Blutdruck und Lipide ist bezüglich eines positiven Ergebnisses Zuversicht durchaus angebracht.
Besonders eindrucksvoll ist die Tatsache, dass bei einem Kollektiv mit langer Diabetesdauer (8,4 Jahre) und einer schlechten Diabeteseinstellung (HbA1c 8,17%) bei der Hälfte der Studienteilnehmer nach einem Jahr eine «Diabetesremission», d.h. ein HbA1c von <5,7%, erreicht werden konnte. Diese Daten kommen der Effizienz von bariatrischen Eingriffen hinsichtlich der Stoffwechsellage schon ziemlich nahe. Während konkrete, allgemein gültige HbA1c-Zielwerte bereits aus den Leitlinien eliminiert wurden, legen diese Ergebnisse nahe, dass wir durchaus das ambitionierte Ziel einer normoglykämischen Stoffwechseleinstellung medikamentös zumindest bei einem Teil der Menschen mit Typ-2-Diabetes erreichen können und daher auch anstreben sollten. Da sich dies auch in einer Reduktion von Folgeerkrankungen niederschlagen wird, ist mit einer vorteilhaften Kosten-Nutzen-Relation zu rechnen.
Quelle:
57th EASD Annual Meeting, 27. September bis 1. Oktober 2021
Literatur:
1 Gasbjerg LS et al.: Evaluation of the incretin effect in humans using GIP and GLP-1 receptor antagonists. Peptides 2020; 125: 170183 2 Nauck MA und Meier JJ: Incretin hormones: Their role in health and disease. Diabetes Obes Metab 2018; 20(Suppl 1): 5-21 3 Asmar M et al.: Insulin plays a permissive role for the vasoactive effect of GIP regulating adipose tissue metabolism in humans. J Clin Endocrinol Metab 2016; 101: 3155-62 4 Coskun T et al.: LY3298176, a novel dual GIP and GLP-1 receptor agonist for the treatment of type 2 diabetes mellitus: From discovery to clinical proof of concept. Mol Metab 2018; 18: 3-14 5 Rosenstock J et al.: Efficacy and safety of a novel dual GIP and GLP-1 receptor agonist tirzepatide in patients with type 2 diabetes (SURPASS-1): a double-blind, randomised, phase 3 trial. Lancet 2021; 398: 143-55 6 Frías JP et al.: Tirzepatide versus semaglutide once weekly in patients with type 2 diabetes. N Engl J Med 2021; 385: 503-15 7 Ludvik B et al.: Once-weekly tirzepatide versus once-daily insulin degludec as add-on to metformin with or without SGLT2 inhibitors in patients with type 2 diabetes (SURPASS-3): a randomised, open-label, parallel-group, phase 3 trial. Lancet 2021; 398: 583-98
Das könnte Sie auch interessieren:
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...
Neue Studiendaten zu Typ-2-Diabetes und Lebensstil
Dass gesunde Ernährung und Bewegung das Diabetesrisiko sowie verschiedene Risiken von Patienten mit Diabetes senken, ist seit Langem bekannt. Und das Detailwissen zur Bedeutung von ...
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...