
Moderne Diabetestherapie – Umsetzung im Praxisalltag
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mit den modernen Antidiabetika, wie den SGLT2-Hemmern und den GLP-1-Rezeptoragonisten, hat sich die Behandlung des Diabetes mellitus stark verändert. Der Endokrinologe und Diabetologe Dr. med. Stefan Fischli, Co-Chefarzt am Kantonsspital Luzern, erläuterte das Vorgehen anlässlich eines Vortrages mit Fallvorstellungen am FomF Update Refresher Hausarztmedizin.
Der Referent ging zunächst auf einige Aspekte bei einem neu diagnostizierten Diabetes mellitus ein. Zur Veranschaulichung präsentierte er dazu einen ersten Fall.
Der 48-jährige Patient leidet seit vier Wochen unter intermittierenden Beinkrämpfen, Polydipsie, Polyurie und Nykturie und hat zudem 10kg Gewicht verloren. Die Blutzuckermessung beim Hausarzt ergab eine Hyperglykämie mit einem postprandialen Blutzuckerwert am Morgen von 21mmol/l und einem HbA1c von 12,7%.
Wie Fischli ausführte, kann bei diesem Mann aufgrund der Zuckerwerte die Diagnose eines Diabetes mellitus gestellt werden. Bei Blutzuckerwerten ab 11mmol/l, Symptomen und einem HbA1c >6,5% steht die Diagnose fest.
Weil der Patient normalgewichtig ist und auch keine Zeichen für ein metabolisches Syndrom zeigt, vermutet der Hausarzt einen Typ-1-Diabetes (DM1).
«Für die Unterscheidung zwischen einem Typ-1- und einem Typ-2-Diabetes ist primär die Klinik massgebend, nicht die Antikörper», so Fischli. Das Alter spielt für die Differenzierung keine Rolle. Typischerweise geht ein DM1 mit einem akuten Beginn, Gewichtsverlust einher. Ausserdem fehlen Zeichen für ein metabolisches Syndrom, die Familienanamnese ist häufig negativ und und es kann sich eine Ketoazidose ausbilden. Gemäss Fischli stellt dieser Patient ein Paradebeispiel für die Frage dar, wann bei einem neu diagnostizierten Diabetes mellitus mit einer Insulintherapie begonnen werden sollte.
«Für Insulin bestehen stoffwechselabhängige und -unabhängige Indikationen», so der Referent. Stoffwechselabhängig basiert die Insulinindikation auf dem HbA1c-Wert. Für eine stoffwechselunabhängige Indikation muss eine Situation mit einem Insulinmangel vorliegen. In diesem Fall sollte auch bei einem Typ-2-Diabetes die Behandlung primär immer mit Insulin gestartet werden.
Ist Insulin indiziert, wird mit einem Basalinsulin gestartet. Basalinsulin hat von allen Insulinen das geringste Hypoglykämierisiko und verursacht die geringste Gewichtszunahme. Bei Insulin-naiven Patienten wird in der Regel mit 0,1–0,2E/kgKG begonnen und die Dosis nach dem Start zügig erhöht (alle zwei bis drei Tage um 2–4E/kgKG).
Der Patient im Fallbeispiel ist schlank und nicht insulinresistent. Deshalb kann bei ihm gleich von Anfang an mit einer höheren Dosis – in der Regel mit 10–12E/kgKG subkutan – gestartet werden.
«Ist bei einem neu diagnostizierten Typ-2-Diabetes Insulin indiziert, kann die Behandlung von Beginn weg mit Metformin und ggf. mit einem zweiten oralen Antidiabetikum kombiniert werden», erläuterte Fischli. Sinken dann im Verlauf der initialen Insulintherapie die akut erhöhten Blutzuckerwerte, erholt sich bei DM2 meistens auch die Pankreasfunktion, sodass das Insulin wieder gestoppt werden kann.
Metformin ist nach wie vor Standardtherapie
Metformin ist zusammen mit Lebensstil-Modifikationen nach wie vor die Standardtherapie bei DM2. Das Antidiabetikum ist sehr gut wirksam, hat einen leicht gewichtsreduzierenden Effekt, ist kosteneffektiv und vor allem auch sicher – auch bei eingeschränkter Nierenfunktion, hier muss allerdings die Dosis angepasst werden. Vor dem Behandlungsstart sollten die Patienten immer über die «sick day rules» informiert werden. Sie müssen wissen, dass sie Metformin in akuten Situationen – perioperativ und wenn sie dehydrieren, wie beispielsweise bei einer Gastroenteritis – stoppen müssen. Die Metformin-assoziierte Laktatazidose ist ein sehr seltenes Ereignis. Bei einer Langzeittherapie sollte der Vitamin-B12-Spiegel regelmässig kontrolliert werden, da Metformin die intestinale Absorption des Vitamins hemmt.1 Aufpassen heisst es mit Metformin bei Patienten mit einer Leberzirrhose und bei schwerem Alkoholkonsum. Bei Diabetikern mit einem Magenband ist die Bioverfügbarkeit erhöht, weshalb diese Patienten meistens weniger Metformin brauchen (in der Regel 2x 500mg/d).
«Liegt das HbA1c 1,5% über dem Zielbereich, kann schon initial eine duale Therapie evaluiert werden», erklärte Fischli. Eine kombinierte antidiabetische Behandlung bringe im Vergleich zur Monotherapie allerdings lediglich eine zusätzliche HbA1c-Reduktion von 0,5–0,6%.2 Sind die Patienten hochmotiviert, spräche denn auch nichts dagegen, initial nur auf Metformin und Lebensstilmodifikationen zu setzen. Daten zur Frage, wann eher mit einer Monotherapie und wann mit einer Zweierkombination begonnen werden sollte, gibt es kaum.
HbA1c-Zielwert ist die Richtschnur
Generell spielt der HbA1c-Zielwert im Diabetesmanagement eine zentrale Rolle. «Er ist unsere Richtschnur bei der Einstellung unserer Patienten und der Wahl der Antidiabetika», führte der Referent aus. Der Zielwert wird für jeden Patienten individuell festgelegt und richtet sich nach Diabetesdauer, Lebenserwartung, Komorbiditäten und Hypoglykämierisiko. Wird der Zielbereich nicht erreicht, muss die Therapie ausgebaut werden, wie der Referent an einem zweiten Fallbeispiel erläuterte.
Dieser Patient ist 51-jährig, hat ein metabolisches Syndrom und einen BMI von 31kg/m2. Nach einem Herzinfarkt erhält er als Sekundärprophylaxe ASS Cardio, einen ACE-Hemmer und ein Statin. Vor zwei Jahren wurde die Diagnose eines DM2 gestellt und der Patient nimmt seither Metformin und Sitagliptin ein. Unter dieser dualen antidiabetischen Therapie beträgt der HbA1c-Wert aktuell 8,1% und liegt somit deutlich über dem Zielwert von 7%.
Zusatznutzen beeinflusst Therapiewahl
«Der HbA1c-Zielwert von 7% sollte bei diesem Patienten nicht nur wegen des Herzens erreicht werden», kommentierte Fischli. Der Mann ist noch jung, hat eine Lebenserwartung von 20 bis 30 Jahren und wird in dieser Zeit, wenn das HbA1c hoch bleibt, mikrovaskuläre Komplikationen entwickeln. Diese gilt es mit der antidiabetischen Therapie zu vermeiden. Ausserdem sollte die Behandlung möglichst keine Gewichtszunahme verursachen. «Der Mann ist zudem ein kardiovaskulärer Hochrisikopatient, weshalb die antidiabetische Behandlung möglichst auch das kardiovaskuläre Risiko und die Komorbiditäten günstig beeinflussen sollte. «Mit den modernen Antidiabetika lassen sich diese Ziele heute tatsächlich auch erreichen», betonte Fischli. Diese Medikamente sind hochpotent und bringen Zusatznutzen (Tab. 1).
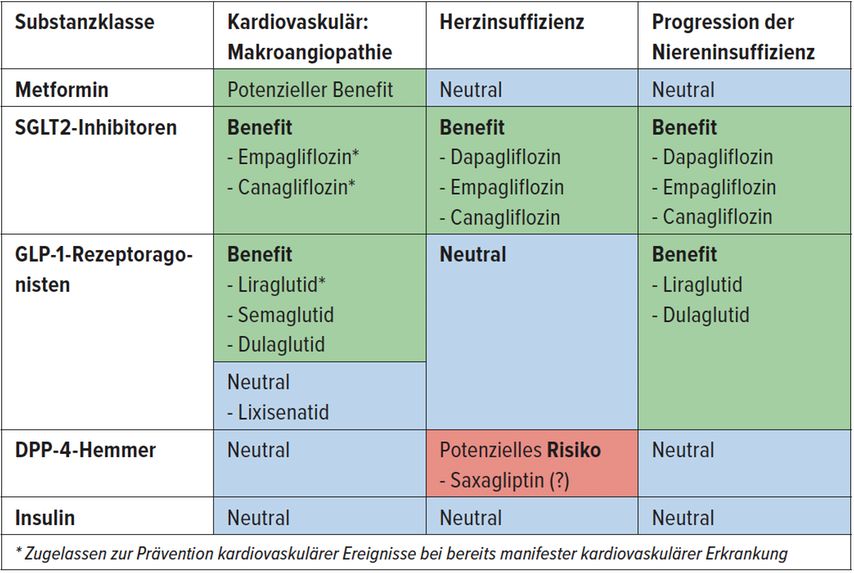
Tab. 1: Zusatznutzen der wichtigsten Antidiabetika
«In der modernen Diabetestherapie geht es denn auch darum, die verschiedenen Therapieprinzipien und Zusatznutzen geschickt miteinander zu kombinieren, um Synergien zu schaffen», erklärte der Diabetologe. Ein synergistischer Effekt kann zum Beispiel erzielt werden, indem Insulin und ein GLP-1-Rezeptoragonist (GLP-1-RA) miteinander kombiniert werden. Das Insulin senkt die Blutzuckerwerte sehr effektiv und der GLP-1-RA verhindert zusätzlich, dass der Patient unter dem Insulin Gewicht zunimmt. «Oder wir behandeln mit einer Kombination gleichzeitig die Insulinresistenz und vermindern die renale Glukosereabsorption», so Fischli.
Fast alle Antidiabetika lassen sich miteinander kombinieren. Nicht zugelassen ist die Kombination GLP-1-RA plus DPP-4-Hemmer, da mit dieser Kombination kein zusätzlicher Effekt erzielt werden kann. Und für die Kombination SGLT2-Hemmer (SGLT2-I) plus GLP-1-RA muss aktuell noch eine Kostengutsprache eingeholt werden. Für diese Kombination bestehen aber bereits belastbare Daten. Einmal zugelassen, dürfte sie laut der Einschätzung des Experten künftig die potenteste Kombination sein.
Welche Therapie ist für meinen Patienten die beste?
In der modernen Diabetestherapie werden die Zusatznutzen der einzelnen Präparate gezielt genutzt. In der Praxis helfen deshalb bei der Therapiewahl folgende drei Fragen weiter:
1. Braucht der Patient Insulin?
2. Hat er eine Niereninsuffizienz oder eine Nephropathie?
3. Hat er ein hohes kardiovaskuläres Risiko, eine kardiovaskuläre Erkrankung
oder eine Herzinsuffizienz?
Vor allem viszerales Fett geht verloren
Die jüngsten oralen Antidiabetika für die Behandlung von DM2 sind die SGLT2-I. Sie fördern die Glukoseausscheidung über die Nieren, indem sie die renale Glukosereabsorption hemmen. Zusätzlich zur Senkung des Blutzuckerspiegels kommt es auch zu einem Gewichtsverlust von 2–3kg.3 Verloren geht dabei primär viszerales Fett. Die SGLT2-I senken nachweislich auch die kardiovaskuläre Morbidität und Mortalität. Für Dapagliflozin und Empagliflozin wurde ausserdem gezeigt, dass sie bei Herzinsuffizienzpatienten die kardiovaskuläre Mortalität und das Risiko für Herzinsuffizienz-bedingte Hospitalisationen senken, und dies unabhängig davon, ob der Patienten einen Diabetes hat oder nicht.4, 5 Dapagliflozin ist deshalb seit Kurzem als erster SGLT2-I auch für die Behandlung von Herzinsuffizienzpatienten ohne Diabetes mellitus zugelassen.
Einen weiteren Zusatznutzen bringen die SGLT2-I für die Nieren. Sie senken den intraglomerulären Druck, was die Nieren schützt. Aufgrund einer positiven renalen Endpunktstudie6 hat Canagliflozin vor Kurzem eine Indikationserweiterung erfahren und ist heute auch zur Senkung des Risikos der Progression einer diabetischen Nieren-
erkrankung bei erwachsenen Patienten mit DM2 und Makroalbuminurie zugelassen.
Die Verträglichkeit der SGLT2-I ist gemäss Fischli in der Regel gut, Nebenwirkungen sind selten. Leicht erhöht ist das Risiko für Infekte, insbesondere für Genitalmykosen, sowie für Ketoazidosen und eine Volumendepletion. «Diese können klinisch vor allem bei älteren Patienten relevant werden, wenn sie zusätzlich Schleifendiuretika einnehmen», erklärte Fischli. SGLT2-I müssen wie Metformin bei akuten Erkrankungen und perioperativ gestoppt werden.
GLP-1-RA auch als Tablette zum Schlucken
Schon etwas älter unter den neuen oralen Antidiabetika sind die GLP-1-RA. In der Schweiz sind Präparate erhältlich, die täglich (Exenatid, Liraglutid, Lixisenatid) oder wöchentlich (Exenatid LAR, Dulaglutid, Semaglutid) appliziert werden. Die unterschiedlichen Halbwertszeiten haben auch Einfluss auch die Wirkung. «So verursachen kurz wirksame GLP-1-RA eher eine Magenentleerungshemmung und beeinflussen deshalb vor allem den postprandialen Blutzucker, während die lang wirksamen Präparate eher einen Effekt auf den Nüchternblutzucker haben», erklärte Fischli.
Auch GLP-1-RA können mit Insulin kombiniert werden. Einige Kombinationen sind auch offiziell zugelassen. Auf dem Markt erhältlich sind zudem Fixkombinationen (z.B. Liraglutid + Insulin Degludec, Lixisenatid + Insulin Glargin). Semaglutid ist als einziger wöchentlich applizierbarer GLP-1-RA neu auch in Kombination mit Basalinsulin zugelassen. Seit wenigen Wochen ist Semaglutid zudem auch als erster GLP-1-RA in peroraler Formulierung auf dem Markt. Die Wirksamkeit der Tabletten ist vergleichbar mit dem subkutan applizierbaren GLP-1-RA.
«SGLT2-I und GLP-1-RA sind zusammen mit Metformin die Substanzen, die heute in der modernen Diabetestherapie in erster Linie eingesetzt werden», so Fischli. Kaum mehr verordnet werden die Sulfonylharnstoffe. Sie senken zwar wie Insulin das HbA1c sehr effektiv, haben aber unangenehme Nebenwirkungen wie eine Gewichtszunahme und Hypoglykämien. Die DPP-4-Inhibitoren werden nach wie vor häufig verschrieben. Sie sind punkto Blutzuckersenkung vergleichbar gut wie die SGLT2-I, haben aber keinen günstigen Effekt auf das Gewicht.
Für den Therapieausbau kommt beim Patienten im zweiten Fallbeispiel Insulin wegen des Risikos einer Gewichtszunahme nicht infrage. Wegen seines kardiovaskulären Risikos wird ein Antidiabetikum gewählt, das auch kardioprotektiv wirkt. Infrage kommen die beiden SGLT2-I Empagliflozin und Canagliflozin sowie der GLP-1-RA Liraglutid. Alle drei Medikamente sind für die Prävention von kardiovaskulären Ereignissen bei Typ-2-Diabetikern und einer bereits manifesten Herz-Kreislauf-Erkrankung zugelassen (Abb. 1).
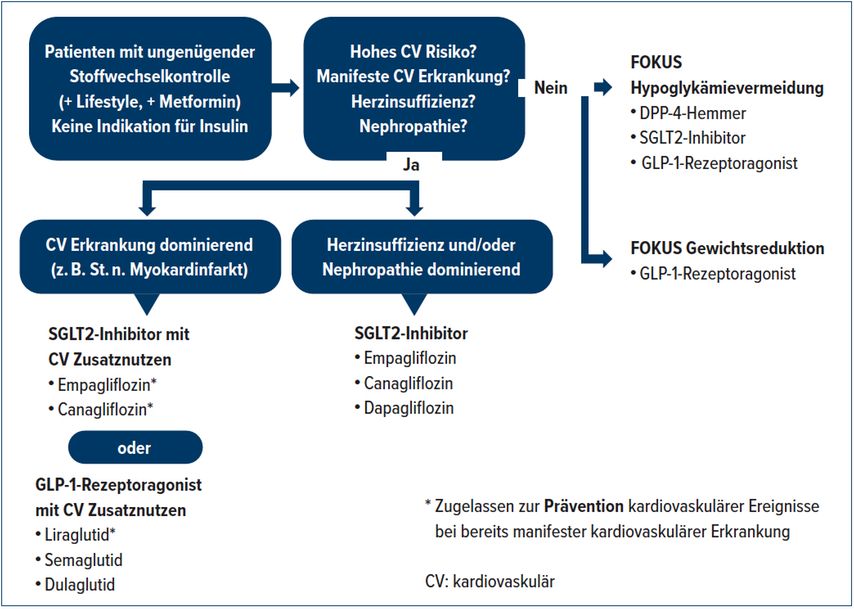
Abb. 1: Wahl des Antidiabetikums
Ausbau der Behandlung nach den oralen Antidiabetika
Bei lang andauerndem DM2 kommt es vor, dass auch mit zwei oder drei ausdosierten oralen Antidiabetika der Blutzucker nicht mehr genügend kontrolliert werden kann. «Früher hätte man in dieser Situation automatisch Insulin verordnet», so der Experte. Zwischenzeitlich habe jedoch ein Paradigmenwechsel stattgefunden. Erfüllen die Patienten die Insulinkriterien nicht, erhalten sie heute primär einen GLP-1-RA. Erst wenn dieser ausdosiert ist, wird zusätzlich ein Basalinsulin verordnet. Umgekehrt wird, wenn ein Patient die Insulinkriterien erfüllt, das Basalinsulin ab einer Dosis von 0,5E/kgKG heute nicht mehr weiter gesteigert, sondern mit einem GLP-1-RA kombiniert. Wie Studien gezeigt haben, reduziert die Kombination aus GLP-1-RA und Basisinsulin das HbA1c stärker als Insulin allein.7 «Zudem wird mit der Kombination eine Gewichtszunahme verhindert und es kann Insulin eingespart werden, wodurch das Hypoglykämierisiko sinkt», so Fischli.
Bericht:
Claudia Benetti
Medizinjournalistin
Quelle:
FomF Hausarzt Fortbildungstage, 18. und 19. September 2020, Luzern (Livestream)
Literatur:
1 Aorda VR et al.: Long-term metformin use and vitamin B12 deficiency in the diabetes prevention program outcomes study. J Clin Endocrinol Metab 2016; 101: 1754-61 2 Maruthur NM et al.: Diabetes medications as monotherapy or metformin-based combination therapy for type 2 diabetes: a systematic review and meta-analysis. Ann intern Med 2016; 164: 740-51 3 Zelniker TA et al.: Cardiac and renal effects of sodium-glucose co-transporter 2 inhibitors in diabetes: JACC state-of-the-art review. J Am Coll Cardiol 2018; 72: 1845-55 4 McMurray JJV et al.: Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med 2019; 381: 1995-2008 5 Packer M et al.: Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med 2020; 383: 1413-24 6 Perkovic V et al.: Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. NEJM 2019; 380: 2295-306 7 Eng C et al.: Glucagon-like peptide-1 receptor agonist and basal insulin combination treatment for the management of type 2 diabetes: a systematic review and meta-analysis. Lancet 2014; 384: 2228-34
Das könnte Sie auch interessieren:
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...
Neue Studiendaten zu Typ-2-Diabetes und Lebensstil
Dass gesunde Ernährung und Bewegung das Diabetesrisiko sowie verschiedene Risiken von Patienten mit Diabetes senken, ist seit Langem bekannt. Und das Detailwissen zur Bedeutung von ...
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...


