Medikamentöse Therapie der Adipositas
Autor:
Assoc. Prof. Priv.-Doz. Dr. Florian Kiefer
Abteilung für Endokrinologie und Stoffwechsel
Universitätsklinik für Innere Medizin III
Medizinische Universität Wien
E-Mail: florian.kiefer@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Rezente Berichte in sozialen Medien, laut denen Prominente mithilfe von Abnehm-Medikamenten wieder ihr Idealgewicht erreicht haben sollen, führten zu einer deutlich erhöhten Nachfrage, aber auch zur missbräuchlichen Verwendung medikamentöser Therapien zur Gewichtsreduktion. Der Artikel gibt eine Übersicht über den Stateofthe Art in der Pharmakotherapie der Adipositas sowie über den korrekten Einsatz im Kontext des multimodalen Therapiekonzeptes des Gewichtsmanagements.
Keypoints
-
Wenn durch Lebensstilmaßnahmen keine ausreichende/anhaltende Gewichtsreduktion erzielt werden kann, sollte zusätzlich eine Pharmakotherapie in Erwägung gezogen werden.
-
Eine medikamentöse Therapie zur Gewichtsreduktion ist ab einem BMI ≥30kg/m2 oder einem BMI ≥27kg/m2 bei gleichzeitigem Vorliegen von übergewichtsassoziierten Begleiterkrankungen zugelassen.
-
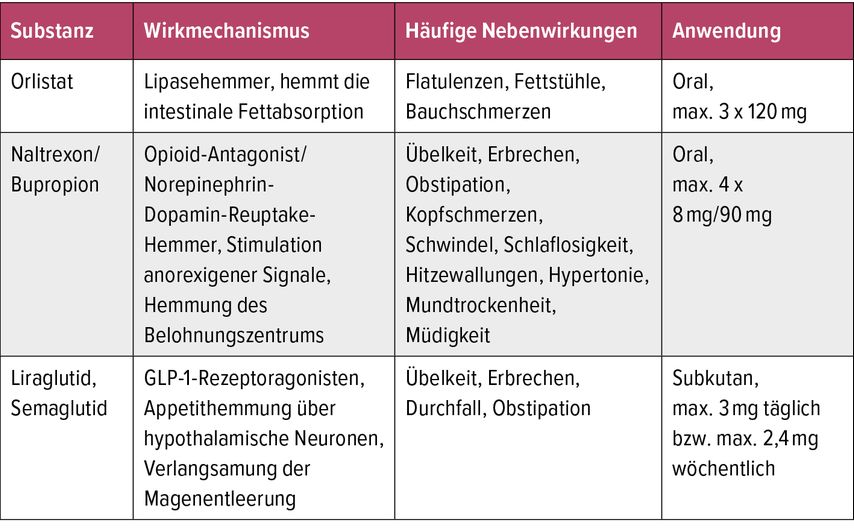
Derzeit sind vier pharmakologische Therapieoptionen in der EU zugelassen: Orlistat, Naltrexon/Bupropion, Liraglutid, Semaglutid.
-
Vor Therapieeinleitung ist eine ausführliche Anamnese inklusive Erhebung von Ernährungsgewohnheiten, Bewegungsausmaß und etwaiger psychischer Erkrankungen bzw. Essstörungen erforderlich.
Jo-Jo-Effekt
Zahlreiche Studien zeigen, dass bei Adipositas eine langfristige Gewichtsreduktion nach alleiniger Lebensstilintervention schwierig ist und es nach Beendigung des kontrollierten Studienablaufs häufig wieder zu einer Gewichtszunahme kommt („Jo-Jo-Effekt“), wie auch aus der täglichen Praxis bekannt ist. Zahlreiche Mechanismen dürften an der Entstehung des Jo-Jo-Effekts beteiligt sein: Einerseits kommt es nach einem Gewichtsverlust zu einer vermehrten Ausschüttung sogenannter orexigener Hormone wie Ghrelin, welche appetitfördernd wirken, andererseits werden anorexigene Hormone wie Leptin unterdrückt, und damit das Sättigungsgefühl. Diese physiologischen Signale stimulieren somit den Hunger. Darüber hinaus führt ein Gewichtsverlust nicht nur zu einer Abnahme der Fettmasse, sondern auch des Muskelanteils, insbesondere wenn die Gewichtsabnahme sehr rasch erfolgt ist und nicht durch ausreichend körperliche Aktivität unterstützt wurde. Eine Reduktion der Muskelmasse wiederum ist mit einem geringeren Ruhe-Energieverbrauch assoziiert, was ebenfalls eine neuerliche Gewichtszunahme begünstigt. Aus diesen Gründen ist eine alleinige Lebensstilintervention oft nicht ausreichend, um eine anhaltende Gewichtsreduktion zu erzielen; in solchen Fällen kann eine Kombination mit medikamentöser Therapie hilfreich sein.
Ziele der Adipositastherapie
Die wichtigsten Ziele der Adipositastherapie sind die Verhinderung von Folgeerkrankungen bzw. die Behandlung etwaiger bereits bestehender Komorbiditäten, die Entstigmatisierung sowie die Förderung eines positiven Körper- und Selbstbewusstseins. Sollten diese Ziele durch Lebensstilmaßnahmen wie Anpassung der Ernährungsgewohnheiten, regelmäßiges körperliches Training sowie gegebenenfalls psychologische Betreuung nicht erreicht werden, sollte auch eine Pharmakotherapie in Erwägung gezogen werden.
Pharmakotherapie der Adipositas
Ab einem Body-Mass-Index (BMI) ≥30kg/m2 oder einem BMI ≥27kg/m2 bei gleichzeitigem Vorliegen von übergewichtsassoziierten Begleiterkrankungen kann der Einsatz medikamentöser Therapie zusätzlich zu Lebensstilmaßnahmen indiziert sein. Zu den übergewichtsassoziierten Begleiterkrankungen zählen Prädiabetes, Typ-2-Diabetes (T2D), Hypertonie, Hyperlipidämie oderObstruktive-Schlafapnoe-Syndrom. Der Therapieerfolg sollte 12–16 Wochen nach Therapiebeginn ärztlich evaluiert werden. Ein ausreichendes Therapieansprechen ist gegeben, wenn ein Gewichtsverlust von mindestens 5% des Ausgangsgewichts eingetreten ist. Pharmakotherapie zur Gewichtsreduktion sollte nicht in der Schwangerschaft oder während der Stillzeit eingesetzt werden.
Aktuell sind vier medikamentöse Therapieoptionen in der EU und somit auch in Österreich für Erwachsene zugelassen: der Lipasehemmer Orlistat, das Kombinationspräparat Naltrexon/Buprenorphin und die beiden Glucagon-like-Peptide-1-Rezeptoragonisten (GLP-1-RA) Liraglutid und Semaglutid, wobei Semaglutid in Österreich derzeit nur in einer Darreichungsform zur Behandlung für Menschen mit T2D zur Verfügung steht. Vor Einleitung einer Therapie sollte der/die behandelnde Arzt/Ärztin klären, ob eine pharmakologische Therapie überhaupt sinnvoll ist und welche Therapieform für den Patienten/die Patient*in am besten geeignet ist. Hierfür ist eine ausführliche Anamnese inklusive Erhebung der Ernährungsgewohnheiten, des Bewegungsausmaßes und etwaiger zugrundeliegender psychischer Erkrankungen erforderlich.
Orlistat
Orlistat ist ein selektiver Inhibitor der pankreatischen Lipase und hemmt dadurch die intestinale Fettabsorption. Es werden nur etwa zwei Drittel der Nahrungsfette aus dem Darm aufgenommen. Das restliche Fett verlässt unverdaut den Körper, weshalb Orlistat in Kombination mit einer fettarmen Ernährung zu den Mahlzeiten eingenommen werden sollte. Orlistat ist in Form von 60-mg- und 120-mg-Kapseln verfügbar, wobei die maximale Tagesdosis 3x 120mg beträgt. Häufigste Nebenwirkungen sind Flatulenzen, Fettstühle und Bauchschmerzen. In schweren Fällen kann es auch zur Malabsorption von fettlöslichen Vitaminen kommen. Orlistat darf bei Malabsorptionssyndrom und Cholestase nicht angewendet werden. Aufgrund der beträchtlichen Nebenwirkungen und des verhältnismäßig geringen Gewichtsverlusts wird diese Therapie kaum noch eingesetzt.
Naltrexon/Bupropion
Naltrexon und Bupropion sind zwei zentral wirksame Substanzen, die bereits einzeln in unterschiedlicher Indikation zugelassen sind. Naltrexon ist ein Opioid-Antagonist, welcher in der Therapie der Alkohol- und Opiatabhängigkeit eingesetzt wird. Bupropion wirkt als Norepinephrin-Dopamin-Reuptake-Inhibitor und wird zur Raucherentwöhnung und zur Behandlung von Depressionen eingesetzt. Es wird vermutet, dass die gewichtsreduzierenden Effekte der Naltrexon-Bupropion-Kombination durch eine anhaltende Aktivierung anorexigener Neuronen im Hypothalamus zustande kommen. Die Fixkombination liegt in Österreich in einer Dosierung von Naltrexon 8mg/Bupropion 90mg vor, wobei die maximale Tagesdosis 2 x 2 Tabletten beträgt. Die häufigsten Nebenwirkungen sind Übelkeit, Erbrechen, Obstipation, Kopfschmerzen und Schwindel. Gegenanzeigen sind Hypertonie, Krampfanfälle, Tumoren des Zentralnervensystems, bipolare Störungen, frühere Bulimie oder Anorexie, schwere Leber- und Nierenfunktionsstörungen, chronische Opiatabhängigkeit sowie akuter Opiat-, Alkohol- oder Benzodiazepinentzug.
Liraglutid
Liraglutid ist ein Agonist am humanen GLP-1-Rezeptor. GLP-1 ist ein Hormon, das von enteroendokrinen Zellen vor allem im Jejunum nach der Nahrungsaufnahme ins Blut sezerniert wird und glukoseabhängig die Insulinfreisetzung in der Bauchspeicheldrüse stimuliert sowie die Freisetzung des Insulingegenspielers Glukagon hemmt. Physiologisches GLP-1 wird im Blut innerhalb weniger Minuten durch das Enzym DDP-4 abgebaut. Der synthetische GLP-1-Rezeptor-Agonist(RA) Liraglutid hingegen weist nach einmal täglicher subkutaner Gabe eine Halbwertszeit von rund 13 Stunden auf. Liraglutid wird sowohl zur Behandlung von T2D (Victoza®) als auch zur Therapie von Übergewicht oder Adipositas eingesetzt (Saxenda®).
Praxistipp
Gewichtsverlust führt nicht nur zu einer Abnahme der Fettmasse, sondern auch des Muskelanteils, insbesondere wenn die Abnahme sehr rasch erfolgt und nicht durch ausreichend körperliche Aktivität unterstützt wird.Bei Patient*innen mit T2D und vorbestehender atherosklerotischer Erkrankung reduziert Liraglutid zudem die Mortalität und das Risiko für kardiovaskuläre Ereignisse. Die Höchstdosis in der Indikation T2D liegt bei 1,8mg täglich, in der Indikation Adipositas bei 3,0mg. Die gewichtssenkenden Effekte sind in erster Linie auf eine Hemmung des Appetits sowie eine Stimulation von Sattheit zurückzuführen, was durch die Aktivierung von GLP-1-Rezeptor-exprimierenden Neuronen in den Appetitzentren des Gehirns vermittelt wird. In Studien hat sich gezeigt, dass ein Gewichtsverlust von durchschnittlich etwa 10% möglich ist. Darüber hinaus liegen Daten vor, dass bei Patient*innen mit Prädiabetes das Auftreten eines T2D verhindert werden kann. Außerdem kommt es zu einer Reduktion von Blutdruck und Lipiden. Die Dosis wird in wöchentlichen Intervallen gesteigert (0,6mg – 1,2mg – 1,8mg – 2,4mg – 3,0mg), um eine bessere Verträglichkeit zu gewährleisten. Die häufigsten Nebenwirkungen, die unter der Therapie auftreten können, betreffen den Verdauungstrakt. Insbesondere in der Anfangsphase kann es zu Übelkeit kommen. Liraglutid sollte nicht angewendet werden, wenn eine Anamnese für Pankreatitis, Cholezystitis oder ein medulläres Schilddrüsenkarzinom besteht.
Semaglutid
So wie Liraglutid ist auch Semaglutid ein GLP-1-Rezeptoragonist, der sowohl bei der Behandlung von T2D (Ozempic®) als auch bei Übergewicht oder Adipositas (Wegovy®) zum Einsatz kommt. Aufgrundder deutlich längeren Halbwertszeit muss Semaglutid nur einmal wöchentlich subkutan verabreicht werden. Die Dosis wird in 4-Wochen-Intervallen gesteigert, wobei die Initialdosis 0,25mg beträgt, gefolgt von 0,5mg, 1,0mg, 1,7mg und 2,4mg. In der Indikation T2D beträgt die wöchentliche Höchstdosis 1,0mg, während bei der Behandlung von Adipositas bis zu 2,4mg verabreicht werden können. Derzeit ist in Österreich jedoch nur Ozempic® am Markt. Mit einer durchschnittlichen Gewichtsreduktion von ca. 15% gegenüber 10% ist Semaglutid 2,4mg der Höchstdosis von Liraglutid 3,0mg überlegen. Das Nebenwirkungsprofil von Semaglutid entspricht in etwa dem von Liraglutid, wobei ebenfalls Übelkeit die häufigste berichtete Nebenwirkung darstellt. Es bestehen die gleichen Kontraindikationen wie bei Liraglutid.
Literatur:
• Kiefer FW. Arzt und Praxis 2020 • Mann T et al.: Medicare‘s search for effective obesity treatments: diets are not the answer. Am Psychol 2007; 62: 220-33 • Rubino DM et al.: Effect of weekly subcutaneous semaglutide vs daily liraglutide on body weight in adults with overweight or obesity without diabetes: The STEP 8 randomized clinical trial. JAMA 2022; 327(2): 138-50 • Schwartz A, Doucet E: Relative changes in resting energy expenditure during weight loss: a systematic review. Obes Rev 2010; 11: 531-47 • Secher A et al.: The arcuate nucleus mediates GLP-1 receptor agonist liraglutide-dependent weight loss. J Clin Invest 2014; 124: 4473-88 • Sumithran P et al.: Long-term persistence of hormonal adaptations to weight loss. N Engl J Med 2011; 365: 1597-604
Das könnte Sie auch interessieren:
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...
Neue Studiendaten zu Typ-2-Diabetes und Lebensstil
Dass gesunde Ernährung und Bewegung das Diabetesrisiko sowie verschiedene Risiken von Patienten mit Diabetes senken, ist seit Langem bekannt. Und das Detailwissen zur Bedeutung von ...
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...