Magnetresonanzspektroskopie und Bildgebung in der Stoffwechselforschung
Autoren:
Dr. Martin Krššák
Univ.-Prof. Dr. Michael Krebs
Dr. Thomas Scherer
Klinische Abteilung für Endokrinologie und Stoffwechsel, Universitätsklinik für Innere Medizin III, MUW
E-Mail: martin.krssak@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Nicht invasive Bildgebungsmethoden dienen der gezielten Darstellung einzelner Körperteile und Gewebestrukturen, aber auch der Beschreibung von organspezifischen Stoffwechselprozessen. Magnetresonanztomografie (MRT) und die verwandte Magnetresonanzspektroskopie (MRS) kommen ohne ionisierende Strahlung oder Kontrastmittel aus und können somit gefahrlos wiederholt eingesetzt werden.
Keypoints
-
Die Entstehung von Insulinresistenz und Typ-2-Diabetes ist durch organspezifische Veränderungen des Lipid- und Glukosestoffwechsels sowie der Energieumwandlung in den Mitochondrien charakterisiert.
-
Protonenmagnetresonanztomografie (MRT) und Magnetesonanzspektroskopie (MRS) erlauben die exakte Quantifizierung der Ganzkörperfettverteilung und die Messung der Fettablagerung und Fettsäurensättigung in einzelnen Organen.
-
Der Glukose/Glykogenstoffwechsel und die Energieumwandlung im Muskel und in der Leber können mittels 13C- und 31P-MRS noninvasiv beobachtet werden.
Stoffwechselveränderungen in einzelnen Organen und Geweben verursachen oder begleiten die Entstehung von Insulinresistenz und Typ-2-Diabetes. So kann z.B. die verminderte Glukoseaufnahme in den Muskel zur Umverteilung von Substraten und erhöhter Lipidsynthese, Fettakkumulation und Ausscheidung in der Leber führen. Solche Mechanismen tragen zu vermehrter (ektoper) Lipidspeicherung außerhalb des weißen Fettgewebes in Organen wie der Leber, der Skelettmuskulatur und dem Herzen bei und können zusammen mit einer gesteigerten Lipolyse im Fettgewebe durch den Prozess der Lipotoxizität, der die Insulinresistenz befeuert, zu einer Erhöhung von Blutzucker und Blutfettwerten mit den bekannten Langzeitschäden führen.1
Die in der klinischen Praxis bisher üblichen Blutanalysen zeigen den Zustand des gesamten Organismus, erlauben aber keine Aussagen über mögliche Funktionsstörungen in bestimmten Organen, z.B. Muskeln oder Leber. In diesem Bezug kann die MRT/S mit der Fähigkeit, die Signalinformation genau auf ein Organ oder ein Gewebe einzugrenzen bzw. organspezifische Stoffwechselinformationen fast simultan zu untersuchen, einen großen Beitrag zur Diagnose oder Erforschung der Erkrankungsprozesse liefern.
MRT bestimmt Fettverteilung in verschiedenen Organen
Die MRT spielt bereits heute eine große Rolle bei der Bestimmung der Fettverteilung in unterschiedlichen Fettkompartimenten im gesamten Körper. Eine mittlerweile automatisierte Untersuchung und Auswertung dieser Daten können sehr genau den Fettanteil im subkutanen, viszeralen und z.B. perikardialen Bereich bestimmen. Auch die Unterscheidung der einzelnen Fettdepots kann mit großer Genauigkeit erfolgen. So haben nicht zuletzt diese Messungen die zentrale Rolle des viszeralen Fettgewebes bei der Entstehung des metabolischen Syndrom aufgezeigt (Abb. 1) und können auch zur Verfolgung von Therapieeffekten von Medikamenten, Diäten oder Lifestyle-Interventionen eingesetzt werden.2
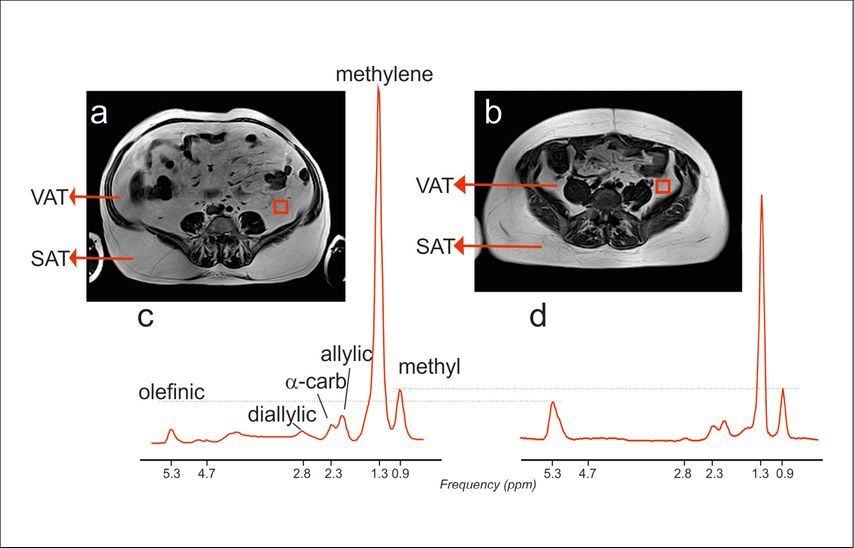
Abb. 1: Unterschiede in der Körperfettverteilung und Fettsäurensättigung zwischen insulinresistenten (links: a, c) und insulinsensitiven Menschen (rechts). T1-gewichtete MRT-Schnittbilder zeigen die Verteilung der Körperfette (hell) und Muskeln bzw. inneren Organen (dunkel) im Abdomen auf der Höhe von Wirbelkörper L3–L4. Dabei kann ein großer Unterschied im Verhältnis von viszeralem (VAT) zu subkutanem Fettgewebe (SAT) festgestellt werden (a, b). Dieser Unterschied geht einher mit einer ungünstigen Verteilung von ungesättigten und gesättigten Fettsäuren. In-vivo-1H-MR-Spektren (rote Linien: c, d) vom VAT (rotes Viereck) zeigen den größeren Anteil der olefinischen (ungesättigten) Fettverbindungen (5,3 ppm) bei insulinsensitiven Menschen (links). Die Intensität der Spektren wurde auf die Methylgruppen-Signalintensität (0,9 ppm) normiert
In den Organen, die im gesunden Zustand wenig Fett speichern (Leber, Muskeln, Herz, Pankreas), können schon leichte Erhöhungen dieser ektopen Fettakkumulation mit der Protonen(1H)-MRS oder mit speziellen quantitativen MRT-Methoden bestimmt werden.3,4 Im Allgemeinen kann man sagen, dass erhöhte ektope Lipidakkumulation mit Insulinresistenz und/oder Typ-2-Diabetes verbunden ist (Abb. 2). Die einzige Ausnahme bilden hier die Muskeln von ausdauertrainierten Athleten.5,6 Paradoxerweise zeigen diese auch erhöhte intramuskuläre Lipidwerte, wobei die Beschaffenheit dieser Lipide (Tröpfchengröße, intrazelluläre Position und Stoffwechseldynamik) in den Muskeln von Athleten eine viel effizientere Verbrennung in den Mitochondrien als bei Diabetikern erlaubt.
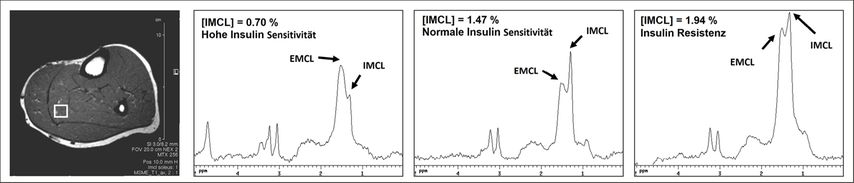
Abb. 2: Unterschiede in der Akkumulation von Muskelzelllipide (IMCL) in Abhängigkeit von der Insulinsensitivität in normal aktiver gesunder Population. Single-voxel-1H-MRS-Daten aufgenommen bei einer Magnetfeldstärke von 3T. Das linke Paneel zeigt ein MR-Schnittbild vom Unterschenkel mit der typischen Position der Signalaufnahme im M. soleus. Die drei folgenden Paneele zeigen die aufsteigende Konzentration der Muskelzelllipide (IMCL). Das Signal der extramyozellulären Lipide (EMCL) ist in allen drei Fällen sehr gut getrennt und nicht direkt mit der Insulinresistenz verbunden.
Zusammensetzung der Lipide mit gängigen MRT-Geräten bestimmbar
In diesem Sinne ist auch die chemische Zusammensetzung der Gewebelipide wichtig. Mithilfe von 1H-MRS kann der Grad der Sättigung und Nichtsättigung dieser Lipide direkt in der Leber, im Muskel oder natürlich auch im subkutanen oder viszeralen Fettgewebe bestimmen (Abb. 1 c, d). Hier hat sich gezeigt, dass ein erhöhter Anteil von gesättigten Fettsäureketten mit der unterschiedlichen organspezifischen Insulinresistenz und letztlich metabolischen Erkrankungen wie Typ-2- Diabetes zusammenhängt.7,8 Alle bis jetzt genannten Messungen können prinzipiell in jedem klinisch einsetzbaren MR-Gerät durchführt werden, wobei eine höhere Magnetfeldstärke (3T) und ein mit der Durchführung der Messungen vertrauter Untersucher speziell für die MRS-Untersuchungen von Vorteil sind.
Spezielle Möglichkeiten der MRS in der Diabetesforschung
Abgesehen von diesen Methoden bietet die MRS auch die Möglichkeit, den Glukose- und Energiestoffwechsel direkt im Gewebe zu untersuchen. Hier kommen Messungen mit anderen Radio-Frequenzen Frequenzen zum Einsatz, um die Isotope Kohlenstoff (13C) und Phosphor (31P) zu bestimmen. Kombinierte Messungen mit 13C- und 31P-MRS konnten zur Entschlüsselung der für die verminderten Glukoseaufnahme in die insulinresistente Muskulatur verantwortlichen Mechanismen wesentlich beitragen. Studien an diabetischen Populationen, aber auch an den direkten Nachfahren diabetischer Elternteile haben gezeigt, dass schon die initialen Stoffwechselschritte der Glukoseaufnahme und Verarbeitung in der Muskelzelle gestört sind.9
Experimentelle Studien an jungen Gesunden konnten auch zeigen, dass schon eine einmalige übermäßige Gabe von anderen Nährstoffen (Fett- und Aminosäuren) zu vergleichbaren Defekten des Muskelglukosestoffwechsel führt.10,11 Diese Mängel im Glukose- und Lipidstoffwechsel führen dann auch zu einer Verminderung der Kapazität der Muskelmitochondrien im basalen wie auch in belasteten Zustand. Auch zur Aufklärung dieser Mechanismen haben mehrere 31P-MRS-Studien wesentliche Beiträge geleistet.
Leberglukosestoffwechsel gut bestimmbar
Die wesentliche Rolle der 13C-MRS bei der Untersuchung der Leber besteht in der einzigartigen Möglichkeit, die Konzentration von Glykogen wiederholt direkt im Lebergewebe ohne Gewebebiopsie zu messen. Nach dem Essen speichert die gesunde Leber die überschüssige Glukose in Form von Glykogen. Wenn der Mensch fastet – zum Beispiel während der Nacht –, wird in der Leber die zur Versorgung (des Gehirns) notwendige Glukose aus Kohlehydratbruchstücken produziert und aus dem Glykogenspeicher freigesetzt. MRS-Studien konnten zeigen, dass bei Diabetikern die postprandiale Glykogenspeicherung vermindert und die Glukoseproduktion mit Abgabe in das Blut erhöht ist bzw. beide Vorgänge auf die erhöhte Insulinkonzentration im Blut nach dem Essen weniger stark als bei den Gesunden reagieren.12 Mithilfe dieser Messungen konnten einige molekularphysiologische Ziele zukünftiger Diabetestherapien identifiziert werden. In anderen Fällen konnte der Wirkmechanismus diverser medikamentöser Therapien besser entschlüsselt werden.13 So wurde auch gezeigt, dass eine langfristige engmaschige Insulintherapie bei Typ-1-Diabetes auch zur Verbesserung des Leberstoffwechsels führt.14,15
Praxistipp
Breit zur Verfügung stehende 3T-MR-Geräte reichen für Stoffwechselmessungen bereits aus und 1H-MRT/S sind auch im klinischen Setup möglich. Für 13C- und 31P-MR-Messungen ist eine technische Erweiterung nötig. Zu beachten ist, dass die Messungen relativ zeitintensiv sind.Die Defekte des Leberglukosestoffwechsels sind nicht nur mit erhöhten Leberfettablagerungen, sondern auch mit einer verminderten und/oder ineffizienten Energieumwandlung verbunden. Hier konnte die 31P-MRS mit der direkten Messung von Adenosin-Triphosphat (ATP) und der Synthese von ATP im hepatischen Gewebe einen wichtigen Beitrag leisten.16 Es ist besonders hervorzuheben, dass die schonende, nicht invasive und nicht ionisierende Natur der MR-Messungen einen wiederholbaren Einsatz über kleinere oder größere Zeitintervalle und eine Kombination von MRT und MRS an mehreren Organen innerhalb eines Experimentes ermöglicht. So können die Stoffwechselvorgänge in Muskeln, Leber und/oder Herz und Hirn unter kontrollierten Bedingungen einer definierten Glukose/Insulin-Infusion oder auch unter physiologischeren Bedingungen eines Mixed-Meal-Tests über einige Stunden wiederholt während des Tages beobachtet werden. Diese Messungen des Interorganzwischenspiels zeigten, dass die oben genannte gleichzeitige Verminderung der Muskelglukoseaufnahme mit Umverteilung der Substrate und folgender Erhöhung der Leberlipidspeicherung in der Leber bei insulinresistenten und/oder älteren Personen, aber auch bei Menschen mit nicht alkoholischer Fettleber beobachtet werden kann.17,18
Einsatz im Alltag möglich und Erkenntnisse für die Forschung
Aus technischer Sicht ist anzumerken, dass die breit zur Verfügung stehenden MR-Geräte mit einer Feldstärke von 3T für diese Messungen grundsätzlich ausreichen. Allerdings ist eine technische Erweiterung für die 13C und 31P-MR-Messungen nötig. Weiters sind die genannten Messungen noch relativ zeitintensiv. Aus diesen Gründen wurden sie bis jetzt, im Gegensatz zu 1H-MRT- und -MRS-Studien, hauptsächlich bei Forschungsfragen an relativ kleinen, gut definierten Gruppen von Patienten und Freiwilligen eingesetzt. Diese Studien konnten bereits wichtige Erkenntnisse zur Entstehung von Insulinresistenz und dem metabolischen Syndrom bzw. Diabetes mellitus Typ 2 liefern, molekulare oder physiologische Therapieziele definieren und die Wirkung der experimentellen Therapieansätze bzw. Lifestyle-Interventionen verfolgen.
Literatur:
1 Krssak M, Roden M: The role of lipid accumulation in liver and muscle for insulin resistance and type 2 diabetes mellitus in humans. Rev Endocr Metab Disord 2004 5(2): 127-34 2 Ludescher B et al.: Correlation of fat distribution in whole body MRI with generally used anthropometric data. Invest Radiol 2009 44(11): 712-9 3 Hollingsworth K.G. et al.: Pancreatic triacylglycerol distribution in type 2 diabetes. Diabetologia 2015; 58(11): 2676-8 4 Szczepaniak LS et al.: Measurement of intracellular triglyceride stores by H spectroscopy: validation in vivo. Am J Physiol 1999; 276(5 Pt 1): E977-E989 5 Thamer C et al.: Intramyocellular lipids: anthropometric determinants and relationships with maximal aerobic capacity and insulin sensitivity. J Clin Endocrinol Metab 2003; 88(4): 1785-91 6 Klepochova R et al.: Differences in muscle metabolism between triathletes and normally active volunteers investigated using multinuclear magnetic resonance spectroscopy at 7T. Front Physiol 2018; 9: 300 7 Machann J et al.: Fraction of unsaturated fatty acids in visceral adipose tissue (VAT) is lower in subjects with high total VAT volume - a combined (1) H MRS and volumetric MRI study in male subjects. NMR Biomed 2012; 26(2): 232-6 8 Roumans KHM et al.: Hepatic saturated fatty acid fraction is associated with de novo lipogenesis and hepatic insulin resistance. Nat Commun 2020; 11(1): 1891 9 Shulman GI Cellular mechanisms of insulin resistance. J Clin Invest 2000; 106(2): 171-6 10 Krebs M et al.: Mechanism of amino acid-induced skeletal muscle insulin resistance in humans. Diabetes 2002; 51(3): 599-605 11 Roden M et al.: Rapid impairment of skeletal muscle glucose transport/phosphorylation by free fatty acids in humans. Diabetes 1999; 48(2): 358-64 12 Krssak M et al.: Alterations in postprandial hepatic glycogen metabolism in type 2 diabetes. Diabetes 2004; 53(12): 3048-56 13 Hundal RS et al.: Mechanism by which metformin reduces glucose production in type 2 diabetes. Diabetes 2000; 49(12): 2063-9 14 Bischof MG et al.: Hepatic glycogen metabolism in type 1 diabetes after long-term near normoglycemia. Diabetes 2002; 51(1): 49-54 15 Bischof MG et al.: Effects of short-term improvement of insulin treatment and glycemia on hepatic glycogen metabolism in type 1 diabetes. Diabetes 2001; 50(2): 392-8 16 Schmid AI et al.: Liver ATP synthesis is lower and relates to insulin sensitivity in patients with type 2 diabetes. Diabetes Care 2011; 34(2): 448-53 17 Smajis S et al.: Metabolic effects of a prolonged, very-high-dose dietary fructose challenge in healthy subjects. Am J Clin Nutr 2020; 111(2): 369-77 18 Petersen KF et al.: The role of skeletal muscle insulin resistance in the pathogenesis of the metabolic syndrome. Proc Natl Acad Sci USA 2007; 104(31): 12587-94
Das könnte Sie auch interessieren:
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...
Neue Studiendaten zu Typ-2-Diabetes und Lebensstil
Dass gesunde Ernährung und Bewegung das Diabetesrisiko sowie verschiedene Risiken von Patienten mit Diabetes senken, ist seit Langem bekannt. Und das Detailwissen zur Bedeutung von ...
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...