Jahreskongress der Schweizerischen Gesellschaft für Endokrinologie und Diabetologie 2017
Mitte November 2017 haben sich die Schweizer Endokrinologen, Diabetologen und Osteologen wie gewohnt zum Jahreskongress in Bern getroff en. Aus den zahlreichen interessanten Themen haben wir zwei für Sie zusammengefasst: die Kontroverse «Metabolische Chirurgie oder medikamentöse Behandlung bei Diabetes?», die gar nicht so kontrovers diskutiert wurde, sowie die Empfehlungen zur Therapiedauer bei Osteoporose und zum Management nach Absetzen der Therapie.
Metabolische Chirurgie UND medikamentöse Behandlung bei Diabetes
Prof. Dr. med. Ralph Peterli, Stv. Chefarzt Viszeralchirurgie am St. Claraspital Basel, betonte zu Beginn seines Beitrags zur Pro-Kontra-Debatte «Bariatrische Chirurgie vs. neue medikamentöse Behandlung bei Diabetes», dass es nicht um «entweder oder» gehe, sondern dass Chirurg und Diabetologe zusammen für jeden Patienten die optimale Lösung finden müssten.
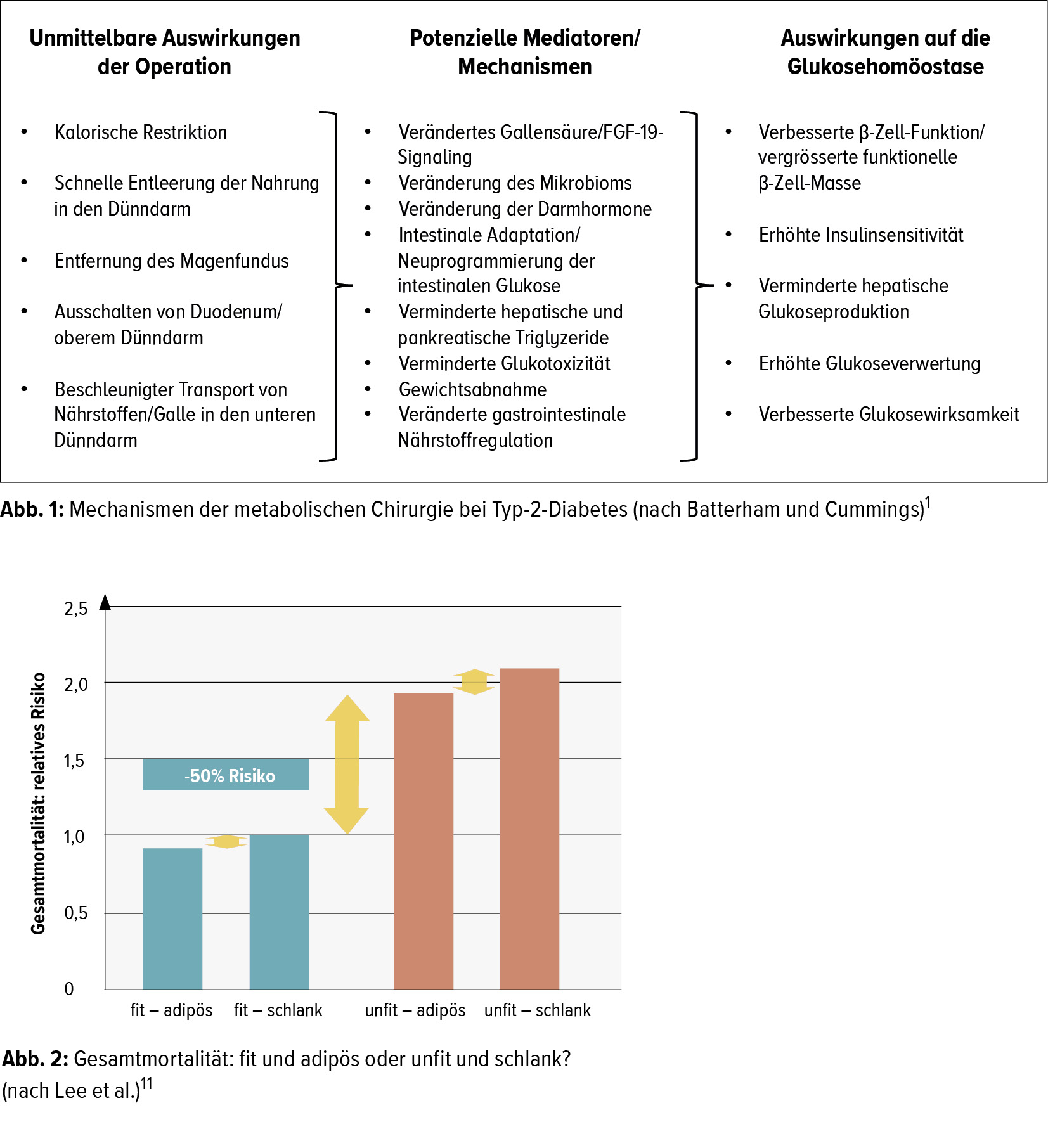
Bei der metabolischen Chirurgie geht es nicht nur um die Gewichtsabnahme. Unabhängig davon haben die bariatrischen Operationen auch einen Einfluss auf viele andere Organe und Systeme, wie z.B. die Darmmotilität, das Mikrobiom, das Herz-Kreislauf-System, das Inflammasom, die Nierenfunktion usw. Die bei Typ-2-Diabetes (T2DM) wichtigen Auswirkungen und Mechanismen sind in Abbildung 1 zusammengefasst. In zahlreichen randomisierten klinischen Studien wurde gezeigt, dass bei stark bis sehr stark übergewichtigen T2-Diabetikern (BMI ≥35kg/m2) mit der metabolischen Chirurgie eine sehr gute glykämische Kontrolle und eine Reduktion der kardiovaskulären (CV) Risikofaktoren erreicht werden können.2 Dabei war die Chirurgie der konservativen Therapie (medikamentös plus Lebensstiländerungen) in allen Studien überlegen.2 Interessanterweise war die T2DM-Remissionsrate in diesen Studien auch bei weniger adipösen T2-Diabetikern (BMI <35kg/m2) gleich hoch wie bei den stärker übergewichtigen Patienten (72 % vs. 71 % ).3 Auch in Hinblick auf die Gesamtmortalität nach 5 und nach 10 Jahren schnitt die Chirurgie bei sehr adipösen T2-Diabetikern (BMI ≥40kg/m2) besser ab als die medikamentöse Therapie.4 Die bariatrische Chirurgie überzeugt auch im Hinblick auf die Langzeitresultate 20 Jahre nach der Intervention: Gewichtsverlust von 18 % (vs. 1 % mit Standardtherapie); Reduktion der Gesamtmortalität um 29 % und der Diabetesinzidenz um 83 % im Vergleich zur konservativen Therapie.5
Aufgrund dieser Ergebnisse kam eine internationale Expertengruppe von Diabetologen und Chirurgen am zweiten «Diabetes Surgery Summit» 2016 (DSS-II) zum Schluss, dass die metabolische Chirurgie zur Behandlung des T2DM bei Patienten mit einer Klasse-III-Adipositas (BMI ≥40kg/m2) in jedem Fall und bei solchen mit einer Klasse-II-Adipositas (BMI 35,0– 39,9kg/m2) empfohlen werden soll, falls die Hyperglykämie mit einer optimalen konservativen Therapie nicht genügend kontrolliert werden kann (Klasse-1A-Empfehlung).2 Auch bei Patienten mit einer Klasse-I-Adipositas (BMI 30,0–34,9kg/m2) sollte bei ungenügender glykämischer Kontrolle trotz optimaler konservativer Behandlung eine bariatrische Operation in Betracht gezogen werden (Klasse-1AEmpfehlung).2 Verschiedene nationale und internationale Gesellschaften, darunter auch die SMOB («Swiss Society for the Study of Morbid Obesity and Metabolic Disorders»), haben sich diesen Empfehlungen angeschlossen. «Das ‹Swiss Medical Board› stellte im Rahmen eines HTABerichts fest, dass die metabolische Chirurgie nicht nur wirksam, sondern auch kostensparend und kosteneffektiv ist, und kommt zu den exakt gleichen Empfehlungen wie die Experten am DSS-II»,6 so Peterli. Wie jede chirurgische Massnahme sind auch bariatrische Operationen mit gewissen Risiken behaftet, insgesamt ist das Benefit-Risiko-Verhältnis aber günstig. «Dabei ist es sehr wichtig, dass die Entscheidung zur Operation in einem interdisziplinären Team gefällt wird und die Patienten sorgfältig ausgewählt werden», betonte Peterli zum Schluss.
Prof. Dr. med. Roger Lehmann, Leiter Diabetologie am Universitätsspital Zürich, bestätigte, dass er mit Prof. Peterli vollkommen einig sei, dass es nun aber neue Medikamente zur Behandlung von Diabetes und Adipositas gebe. «Chirurgen sind Helden, sie retten Leben», sagte er. «Wenn wir als Endokrinologen mit ihnen konkurrieren wollen, müssen wir also auch Leben retten.» Und das ist, wie die LEADER- und die EMPAREG- OUTCOME-Studie zeigen, tatsächlich auch möglich: Reduktion der Gesamtmortalität um 15 % mit dem GLP-1-Rezeptoragonisten (GLP-1-RA) Liraglutid im Vergleich mit Placebo und um 32 % mit dem SGLT2-Hemmer Empagliflozin.7, 8
Aber es gibt auch andere Massnahmen, mit denen die Mortalität von Diabetikern drastisch reduziert werden kann. So zeigte beispielsweise die dänische ADDITION- Studie, dass mit einem Diabetesscreening und einer frühzeitigen intensiven multifaktoriellen Intervention, die nebst der medikamentösen Therapie (Zielwerte: HbA1c <7,0 % ; BD ≤135/85mmHg; LDL-C <4,5mmol/l) auch Lebensstiländerungen mit vermehrter körperlicher Aktivität umfasste, die Mortalität der T2-Diabetiker praktisch auf das Niveau der Gesamtbevölkerung gesenkt werden kann: Reduktion der Mortalität um 50 % im Vergleich mit der dänischen Diabetespopulation und um 9 % im Vergleich mit der Standardbehandlung.9, 10 «Ein ganz entscheidender Faktor ist auch die körperliche Fitness», betonte Lehmann. Vergleicht man nämlich unfitte adipöse Menschen mit unfitten schlanken, fällt auf, dass die Mortalität der adipösen nur leicht höher ist. Das gleiche Bild zeigt sich beim Vergleich von fitten adipösen Menschen mit fitten schlanken. Ein sehr grosser Unterschied besteht jedoch zwischen den Gruppen der unfitten und der fitten Menschen (Abb. 2).11 «Ich sage meinen Patienten deshalb immer, entscheidend ist nicht, dass ihr schlank werdet, entscheidend ist, dass ihr fit werdet», sagte Lehmann. Auch das Diabetesrisiko bei Adipositas kann mit Lebensstiländerungen signifikant reduziert werden: Ein systematischer Review randomisierter kontrollierter Studien zeigte, dass mit Lebensstiländerungen das absolute Risiko für das Auftreten eines T2DM um circa 14 % und das relative Risiko um 50–70 % reduziert werden kann.12 Dabei reicht eine Gewichtsabnahme von 1kg, um das Diabetesrisiko um 30 % zu reduzieren, und eine Abnahme von 5kg für eine Risikoreduktion von 60 % .13 Gleichzeitig hat jede Massnahme, die zu einer Gewichtsreduktion führt, auch einen günstigen Einfluss auf andere CV Risikofaktoren.14 «Erfreulicherweise gibt es auch Antidiabetika, die zu einer Gewichtsreduktion führen. Bei den SGLT2-Hemmern liegt sie bei circa 3–4kg, bei den GLP-1-RA abhängig von Dosis und Medikament bei 3–7kg», so Lehmann. Mit Semaglutid, das in der Schweiz noch nicht zugelassen ist, kann laut Mitteilung des Herstellers sogar eine Gewichtsabnahme von bis zu 17kg erreicht werden.15
Zusammenfassend sagte Lehmann: «Auch wenn die bariatrische Chirurgie die potentere Methode zur Behandlung von Adipositas und Diabetes ist als die konservative Therapie, haben wir Endokrinologen insgesamt doch die besseren Karten, weil wir mit unseren Methoden über 90 % der betroffenen Patienten behandeln können, während aus Kapazitätsgründen nur gerade 0,1 % von einer bariatrischen Operation profitieren können.»16, 17
Osteoporosetherapie: Dauer und Management nach dem Absetzen
erwiesenermassen wirksame Substanzen zur Behandlung der Osteoporose haben», stellte Prof. Dr. med. Christian Meier, Leitender Arzt Endokrinologie, Diabetologie und Metabolismus am Universitätsspital Basel, fest. «Die schlechte Nachricht ist, dass wir diese Medikamente nicht einsetzen. Weltweit werden immer weniger Patienten gegen Osteoporose behandelt.» So zeigte beispielsweise eine grosse amerikanische Studie, dass die Rate an Patienten, die ein Jahr nach einer Hüftfraktur eine Osteoporosemedikation bekamen, von 40,2 % im Jahr 2002 auf 20,5 % im Jahr 2011 gesunken ist.18 Gründe dafür sind gemäss Meier die immer noch ungenügende Awareness für Osteoporose, mangelndes Wissen über die Therapie bei den behandelnden Ärzten sowie Unsicherheiten in Bezug auf die Behandlungsdauer und die Betreuung nach dem Absetzen.
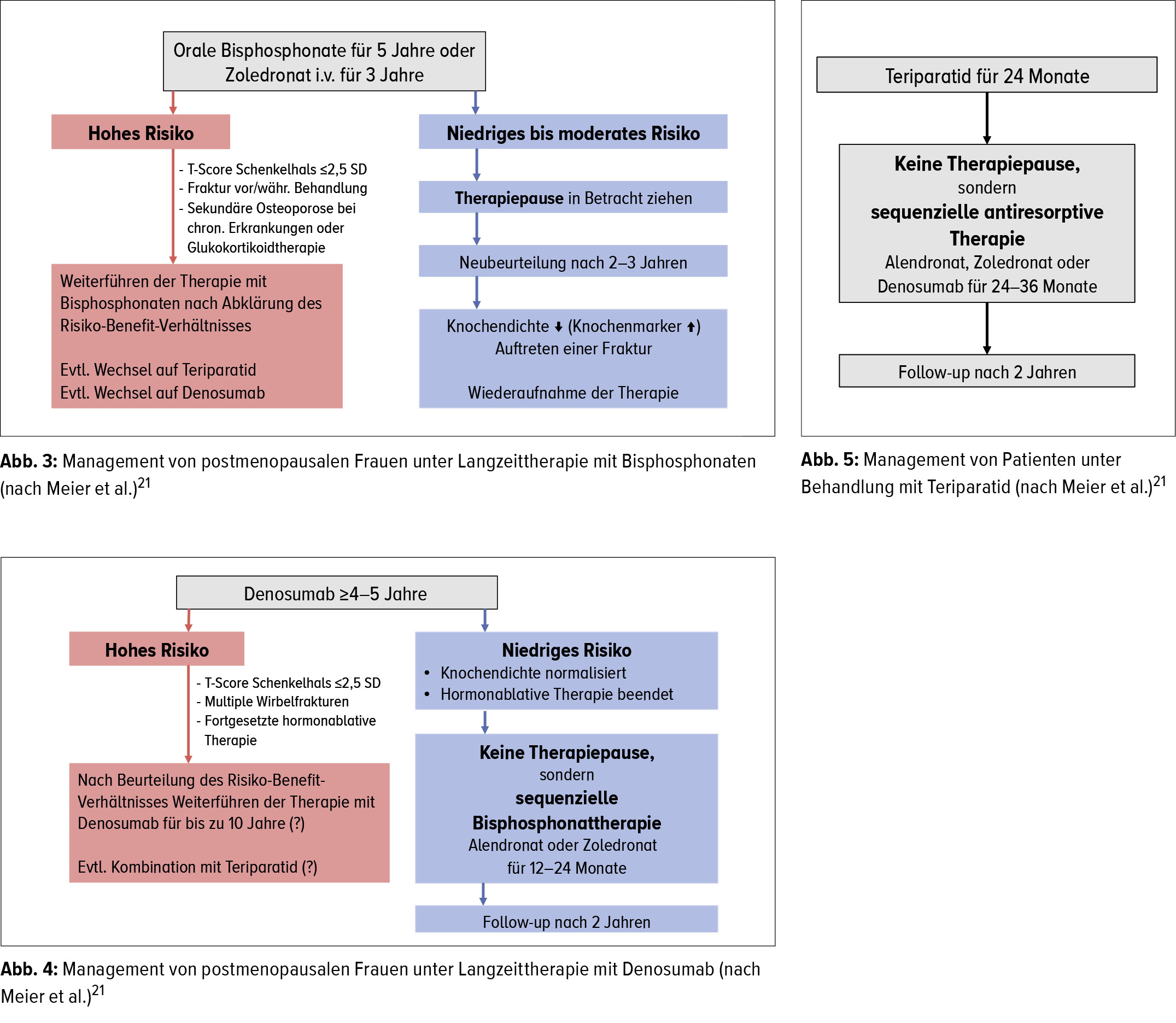
Für die Bisphosphonate (Alendronat, Risedronat, Zoledronat) wurde in verschiedenen Studien gezeigt, dass die Knochendichte nach dem Absetzen der Medikation über mehrere Jahre kaum abnimmt.19, 20 Nach einer 5-jährigen Behandlung mit oralen Bisphosphonaten resp. einer 3-jährigen Therapie mit Zoledronat i.v. kann bei postmenopausalen Patientinnen mit einem niedrigen bis moderaten Risiko gemäss den Empfehlungen der Schweizerischen Vereinigung gegen Osteoporose (SVGO) deshalb eine Therapiepause von 2–3 Jahren gemacht werden (Abb. 3).21 Bei Hochrisikopatientinnen – dazu zählen a) solche, die in den fünf Jahren vor oder während der Behandlung eine Hüft-, eine Wirbel- oder mehrere osteoporotische Frakturen erlitten haben, b) solche, die aufgrund der klinischen Beurteilung oder wegen Komorbiditäten weiterhin ein hohes Frakturrisiko haben, sowie c) solche mit einer immer noch niedrigen Knochendichte – muss die Behandlung weitergeführt oder je nach Risiko- Benefit-Konstellation allenfalls ein Wechsel auf Teriparatid oder Denosumab in Betracht gezogen werden (Abb. 3).
Die Bisphosphonate sind aber die einzigen Osteoporosemedikamente, deren Wirkung nach dem Absetzen noch weiter anhält. Bei allen anderen kommt es nach dem Absetzen zu einer raschen Abnahme der Knochendichte. Für Denosumab wurde beispielsweise gezeigt, dass die Marker für den Knochen-Turn-over nach dem Absetzen im Sinne eines Rebound-Effekts stark ansteigen und dass die Knochendichte unabhängig von der Behandlungsdauer innerhalb von ein bis zwei Jahren auf die Ausgangswerte absinkt.22 Gleichzeitig nimmt die Inzidenz von Wirbelfrakturen stark zu.23 «Davon betroffen sind vorwiegend Patientinnen, die schon vor der Behandlung mit Denosumab Wirbelfrakturen erlitten haben, solche mit einer geringen Knochendichte bei Therapiebeginn, therapienaive Patientinnen und solche mit einer schlechten Compliance»,24, 25 erklärte Meier. Die SVGO empfiehlt deshalb für die Therapie mit Denosumab eine Dauer von mindestens 4–5 Jahren, bei Hochrisikopatientinnen bis zu 10 Jahren (Abb. 4).21 Soll Denosumab abgesetzt werden, z.B. bei Patientinnen mit einem niedrigen Risiko, muss für 1–2 Jahre eine Behandlung mit Bisphosphonaten angeschlossen werden.21 Bei Teriparatid muss nach dem Absetzen für 2–3 Jahre eine antiresorptive Behandlung mit Bisphosphonaten oder Denosumab durchgeführt werden (Abb. 5).21
Quelle: Jahreskongress der Schweizerischen Gesellschaft für Endokrinologie und Diabetologie, 16.–17. November 2017, Bern
1 Batterham RL, Cummings DE: Diabetes Care 2016; 39: 893-901 2 Rubino F et al.: Diabetes Care 2016; 39: 861-77 3 Panunzi S et al.: Ann Surg 2015; 261: 459-67 4 Arterburn DE et al.: JAMA 2015; 313: 62-70 5 Sjöström L: J Intern Med 2013; 273: 219-34 6 Swiss Medical Board: 2016 7 Marso SP et al.: N Engl J Med 2016; 375: 311-22 8 Zinman B et al.: N Engl J Med 2015; 373: 2117-28 9 Griffin SJ et al.: Lancet 2011; 378: 156-67 10 Carstensen et al.: Diabetologia 2008; 51: 2187-96 11 Lee CD et al.: Am J Clin Nutr 1999; 69: 373-80 12 Yoon et al.: Metabolism 2013; 62: 303-14 13 Hamman RF et al.: Diabetes Care 2006; 29: 2102-7 14 Zomer E et al.: Obes Rev 2 016; 1 7: 1001-11 15 Novo Nordisk: Press release, 23. 6. 2017 16 Angrisani L et al.: Obes Surg 2015; 25: 1822-32 17 IDF Diabetes Atlas. 7th ed. 2015 18 Solomon DH et al.: J Bone Miner Res 2014; 29: 1929-37 19 Black D et al.: JAMA 2006; 296: 2927-38 20 Black D et al.: J Bone Miner Res 2015; 30: 934 21 Meier C et al.: Swiss Med Wkl 2017; 147: w14484 22 Bone HG et al.: J Clin Endocrinol Metab 2011; 96: 972-80 23 Brown JP et al.: ASBMR 2016. Atlanta, Sept. 2016 24 Anastasilakis AD et al.: J Bone Miner Res 2017; 32: 1291-6 25 Cummings S et al.: J Bone Miner Res 2017 [epub ahead of print]
Das könnte Sie auch interessieren:
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...
Neue Studiendaten zu Typ-2-Diabetes und Lebensstil
Dass gesunde Ernährung und Bewegung das Diabetesrisiko sowie verschiedene Risiken von Patienten mit Diabetes senken, ist seit Langem bekannt. Und das Detailwissen zur Bedeutung von ...
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...


