Inkretinmimetika in klinischen Studien
Bericht:
Reno Barth
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Im Rahmen des EASD 2025 präsentierte Phase-III-Studien untersuchten die Wirksamkeit von Medikamenten, die an GLP-Rezeptorenangreifen. Unter anderem liegen nun direkte Vergleichsdatenzwischen dem dualen GIP- und GLP-1-Agonisten Tirzepatid und dem GLP-1-Analogon Dulaglutid vor. Mit dem oralen GLP1-Rezeptor-Agonisten Orforglipron wurde eine relevante Gewichtsreduktion erreicht. Neue GIP/GLP-1-Substanzen befinden sich in frühen klinischen Studien.
Keypoints
-
Tirzepatid erwies sich im Vergleich zu Dulaglutid als nicht unterlegen hinsichtlich des primären Endpunkts MACE-3.
-
Mit dem oralen GLP1-Rezeptoragonisten Orforglipron wurde in einer Phase-III-Studie signifikante Gewichtsreduktion erreicht.
-
Zahlreiche duale Inkretinmimetika werden in klinischen Studien untersucht.
-
Durch kombinierte Aktivierung der GLP-1- und GLP-2-Rezeptoren soll Gewichtsreduktion bei Zunahme der Muskelmasse erreicht werden.
Mit Spannung erwartet wurden die Ergebnisse von SURPASS-CVOT, der ersten kardiovaskulären Endpunktstudie mit Tirzepatid, einem dualen Agonisten an GIP- und GLP-1-Rezeptoren. Da GLP-1-Analoga zum „standard of care“ bei Typ-2-Diabetes zählen, konnte die Studie aus ethischen Überlegungen nicht placebokontrolliert, sondern nur mit einer aktiven Vergleichssubstanz durchgeführt werden. Zum Einsatz kam der GLP-1-Agonist Dulaglutid. Der kardiovaskuläre Nutzen von Dulaglutid wurde in der Studie REWIND nachgewiesen, wobei Dulaglutid den kombinierten Endpunkt von Myokardinfarkt, Schlaganfall und kardiovaskulärer Mortalität signifikant um 12% reduzierte.1 Für SURPASS-CVOT wurden 13165 Patient:innen in 30 Ländern rekrutiert und über einen Zeitraum von rund 4 Jahren beobachtet. Die Studienpopulation stand unter ausgezeichneter kardiovaskulärer Begleittherapie mit 86 % der Personen unter Statin- und 30 % unter SGLT2i-Therapie.
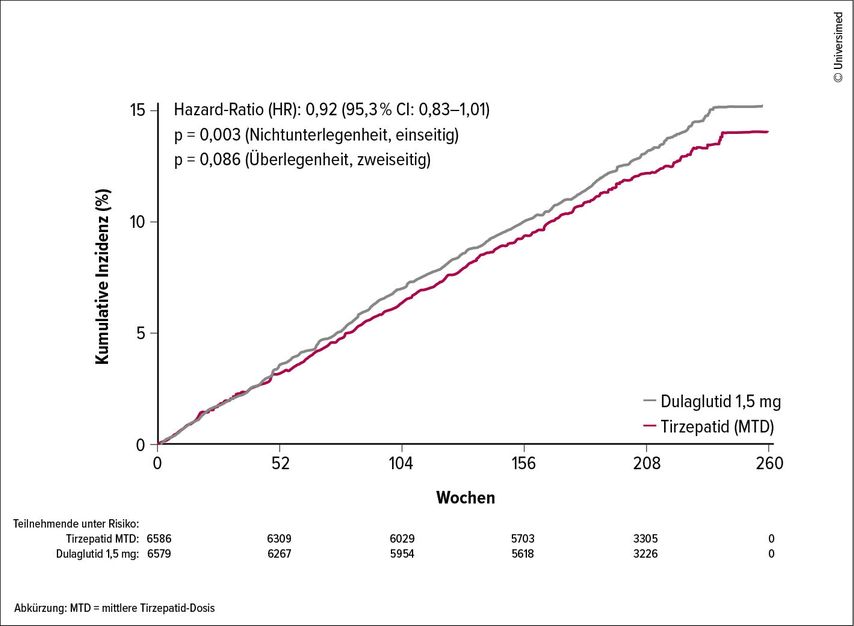
SURPASS-CVOT: Tirzepatid zeigt Nichtunterlegenheit vs. Dulaglutid
Auf dem EASD 2025 präsentierte Prof. Dr. Stephen Nicholls von der Monash University in Melbourne, Australien, die Resutate von SURPASS-CVOT: Tirzepatid erwies sich im Vergleich zu Dulaglutid als nicht unterlegen im Hinblick auf den primären kombinierten Endpunkt (MACE-3) aus Myokardinfarkt, Schlaganfall und kardiovaskulärem Tod (HR 0,92; CI 95%: 0,83–1,01). Die Nichtunterlegenheit war durch alle Komponenten des primären Endpunkts konsistent. Der zweite primäre Endpunkt, die Überlegenheit, konnte mit einem p-Wert von 0,086 hingegen nicht demonstriert werden. Während hinsichtlich der kardiovaskulären Mortalität Nichtunterlegenheit gezeigt wurde, ergab eine exploratorische Analyse eine Reduktion der Gesamtmortalität unter Tirzepatid im Vergleich zu Dulaglutid um 16%, was auf eine Reduktion nichtkardiovaskulärer Todesfälle, insbesondere Infektionen, zurückzuführen sein dürfte.
Abb. 1: SURPASS-CVOT – primärer Endpunkt 3-Punkt-MACE kardiovaskulärer Tod, Herzinfarkt oder Schlaganfall. Tirzepatid zeigt sich Dulaglutid nicht unterlegen. Tirzepatid war Dulaglutid jedoch nicht überlegen (Nicholls S et al., EASD 2025)
Da REWIND eine placebokontrollierte Studie war, konnte ein Vergleich von Tirzepatid mit einem fiktiven Placeboarm errechnet werden. Dieser ergab eine Reduktion des MACE-3-Risikos um 28% (HR 0,72; CI95%: 0,55–0,94) und der Gesamtmortalität um 39% (HR: 0,61; CI 95%: 0,45–0,82). Nicholls: „Dies bestätigt die kardioprotektive Wirkung von Tirzepatid.“ Hinsichtlich mehrerer metabolischer Endpunkte erwies sich Tirzepatid im Vergleich zu Dulaglutid als signifikant überlegen. So ging das HbA1c von einem Ausgangswert von 8,39% unter Tirzepatid um 1,73% zurück, im Vergleich zu 0,9% unter Dulaglutid. Die Gewichtsreduktion war mit Tirzepatid ausgeprägter als mit Dulaglutid. In der Subgruppe der Patient:innen mit chronischer Nierenerkrankung nahm die eGRF in der Dulaglutid-Gruppe signifikant deutlicher ab als in der Tirzepatid-Gruppe.
Die Verträglichkeit war gut, mit gastrointestinalen Ereignissen als häufigster unerwünschter Wirkung. Tirzepatid wurde wenn möglich auf eine Dosis von 15mg auftitriert. Nach 3 Jahren wurden 72,7% der Patient:innen mit dieser Dosis behandelt. Therapieabbrüche wegen unerwünschten Ereignisse gab es bei 13,3 % unter Tirzepatid und 10,2 % unter Dulaglutid.
ATTAIN-1: Oraler GLP-1 Rezeptor-Agonist bewährt sich in der Phase III
Eine weitere Session widmete die EASD ATTAIN-1, der ersten Phase-III-Studie mit Orforglipron, einem oralen GLP-1-Rezeptor-Agonisten.2 Orforglipron ist ein Small Molecule, das – ebenso wie die als GLP-1-Analoga eingesetzten modifizierten Peptidhormone – als Agonist an den GLP1-Rezeptor bindet, was zu verstärkter Insulinfreisetzung bei erhöhtem Blutzucker, Hemmung der Glukagonsekretion, verlangsamter Magenentleerung und gesteigertem Sättigungsgefühl führt. In ATTAIN-1 wurde Orforglipron nicht in der Indikation Typ-2-Diabetes, sondern zur Gewichtsreduktion untersucht.
ATTAIN-1 war eine multinationale, randomisierte, doppelblinde Phase-III-Studie, die Orforglipron in den Dosierungen 6 mg, 12mg oder 36mg, jeweils einmal täglich, mit Placebo verglich.2 Zusätzlich wurden die Patient:innen angewiesen, sich gesund zu ernähren und Bewegung zu machen. Alle Teilnehmer:innen waren adipös, hatten jedoch keinen Diabetes. Der primäre Endpunkt war der Gewichtsverlust in Prozent über 72 Wochen. 3127 Patient:innen in neun Ländern wurden randomisiert.
ATTAIN-1 erreichte den primären Endpunkt. Die Probandinnen nahmen mit Orforglipron 7,5% (6mg), 8,4% (12mg) bzw. 11,2% (36mg) ab – im Vergleich zu 2,5% in der Placebogruppe. Von den Patient:innen in derGruppe mit Orforglipron 36mg erreichte mehr als die Hälfte (54,6%) eine Gewichtsreduktion um 10%, 18,4% der Proband:innen in der Verumgruppe nahmen um mindestens 20% ab. Damit verbesserten sich auch andere Endpunkte wie der Taillenumfang, der systolische Blutdruck sowie das Non-HDL-Cholesterin.
Das Nebenwirkungsprofil war typisch für GLP-1-Rezeptor-Agonisten, mit gastrointestinalen Beschwerden als häufigster unerwünschter Wirkung. Zwischen 5,3% und 10,3% der Patient:innen in den Verumgruppen und 2,7% in der Placebo-gruppe brachen die Therapie wegen Unverträglichkeit ab. „Nach 72 Wochen Theapie hatten alle Patient:innen in den drei Orforglipron-Gruppen signifikant und in klinisch relevantem und dosisabhängigem Ausmaß abgenommen“, so Dr. Sean Wharton von der McMaster University in Hamilton, Kanada. Er weist darauf hin, dass ab einem Gewichtsverlust von 10% relevante kardiometabolische Benefits zu erwarten sind. Die Tatsache, dass es sich bei Orforglipron um eine orale Therapie handelt, könnte dazu beitragen, dass eine Adipositastherapie mit GLP1-Rezeptor-Agonisten für eine größere Zahl von Patient:innen verfügbar wird.
Experimentelle Therapie: Agonisten am GLP2-Rezeptor
Weitere neue Substanzen aus der Gruppe der Inkretinmimetika werden aktuell in klinischen Studien untersucht. Bei vielen handelt es sich um duale Agonisten, die neben GLP1 noch an weiteren Rezeptoren aktiv sind. PG-102 ist ein bispezifischer GLP-1/GLP-2-Agonist, der in Korea entwickelt wurde. Die Wirkung am GLP2-Rezeptor soll helfen, die Muskelmasse trotz Gewichtsreduktion zu erhalten, indem die Aufnahme von Energie und Nährstoffen in den Muskel sowie dessen Insulinsensitivität verbessert werden. Dies soll den Verlust an Muskelmasse unter Therapie mit GLP1-Analoga verhindern. Im Rahmen des EASD 2025 wurden 2 Arbeiten zu PG-102 als Late Breaking Abstracts vorgestellt. Bei einer handelt es sich um eine Studie im Tiermodell, bei der zweiten um den ersten Einsatz bei Menschen.
Im Mausmodell führte PG-102 in Kombination mit dem Myostatin-Inhibitor Bimagrumab im Vergleich zu Semaglutid (kombiniert mit Bimagrumab) zu einer vergleichbaren Gewichtsreduktion. In Monotherapie blieb die Muskelmasse der Tiere unter Behandlungmit PG-102einmal wöchentlichim Vergleich zu täglichem Semaglutid zu einer um rund 5% besser erhaltenen Muskelmasse. In Kombination mit Bimagrumab nahmen die Mäuse unter PG-102 rund 5% an Muskelmasse zu, während es unter Semaglutid plus Bimagrumab zu einer Abnahme der Muskelmasse um 4% kam. Auch erste Ergebnisse einer Phase-Ic-Studie am Menschen mit 34 Proband:innen wurde beim EASD präsentiert. In dieser Studie wurden wöchentliche Dosen bis 80 mg gut vertragen. Gastrointestinale Nebenwirkungen traten auf, waren aber zumeist mild. Es wurden keine Therapieunterbrechungen oder Abbrüche erforderlich. Im Vergleich zu Placebo nahmen die Proband:innen in den Verum-Gruppen über 4 Wochen 2,4% (unter 60mg) bzw. 4,8% (unter 80mg) ab, womit eine Dosis-Wirkungs-Beziehung bestätigt werden konnte. Der Taillenumfang ging dosisabhängig zurück, die Glukosetoleranz verbesserte sich. Dieses Ergebnis rechtfertigt nach Ansicht der Autor:innen die weitere klinische Entwicklung von PG-102.
Quelle:
EASD 2025 Sessions „Comparison of tirzepatide and dulaglutide on major adverse cardiovascular events in participants with type 2 diabetes and atherosclerotic cardiovascular disease: SURPASS-CVOT“, „ATTAIN-1, the first phase 3 clinical trial investigating orforglipron for obesity management“ und „Is there a life after GLP-1?“,17. und 18. September 2025, Wien
Literatur:
1 Gerstein HC et al.: Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet 2019; 394(10193): 121-30 2 Wharton S et al.: Orforglipron, an oral small-molecule GLP-1 Receptor agonist for obesity treatment. N Engl J Med. 2025 Sep 16. Online ahead of print 3 Lee SA et al.: Weekly PG-102 plus bimagrumab enhances net muscle gain compared to daily semaglutide-based regimens. EASD 2025, Late Breaking Abstract LBA 16 4 Yang SI et al.: PG-102, a bispecific GLP-1/GLP-2 Fc fusion protein, outperforms dual-function peptide and combination therapy in preclinical models and induces dose-dependet weight loss in obese subjects. EASD 2025, Late Breaking Abstract LBA 18
Das könnte Sie auch interessieren:
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...
Neue Studiendaten zu Typ-2-Diabetes und Lebensstil
Dass gesunde Ernährung und Bewegung das Diabetesrisiko sowie verschiedene Risiken von Patienten mit Diabetes senken, ist seit Langem bekannt. Und das Detailwissen zur Bedeutung von ...
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...