Diabetes und Auge
Bericht:
Claudia Benetti
Medizinjournalistin
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Ophthalmologische Erkrankungen gehören zu den gefürchteten Komplikationen des Diabetes. Rechtzeitige und regelmässige augenärztliche Kontrollen sind für Menschen mit Diabetes essenziell. Die Kontrollen ermöglichen das frühzeitige Erkennen von Retinaveränderungen und deren rechtzeitige Therapie, wie Dr. med. Patrik Kloos, Augenzentrum Ost in Wil, am FOMF Diabetes Update Refresher erläuterte.
Diabetes kann am Auge zu einer diabetischen Retinopathie, einem diabetischen Makulaödem sowie zu einem frühzeitigen Auftreten einer Katarakt führen. Der diabetischen Retinopathie (DRP) und dem Makulaödem liegen pathophysiologisch mikrovaskuläre Veränderungen zugrunde, die beiden Krankheitsbilder unterscheiden sich jedoch in puncto Lokalisation, Symptomen, Therapie und Prognose, weshalb es sich um zwei verschiedene Entitäten handelt. «Typisch für das Makulaödem sind Veränderungen im Zentrum der Retina, während bei der Retinopathie die Peripherie betroffen ist», erklärte Kloos. Die Diagnostik besteht bei der DRP in einer Funduskopie – eine Angiografie ist nur für die detaillierte Betrachtung der mikrovaskulären Veränderung nötig. Das Makulaödem kann ebenfalls mittels Funduskopie diagnostiziert werden, heutzutage ist jedoch die OCT (optische Kohärenztomografie) die Standarduntersuchung.
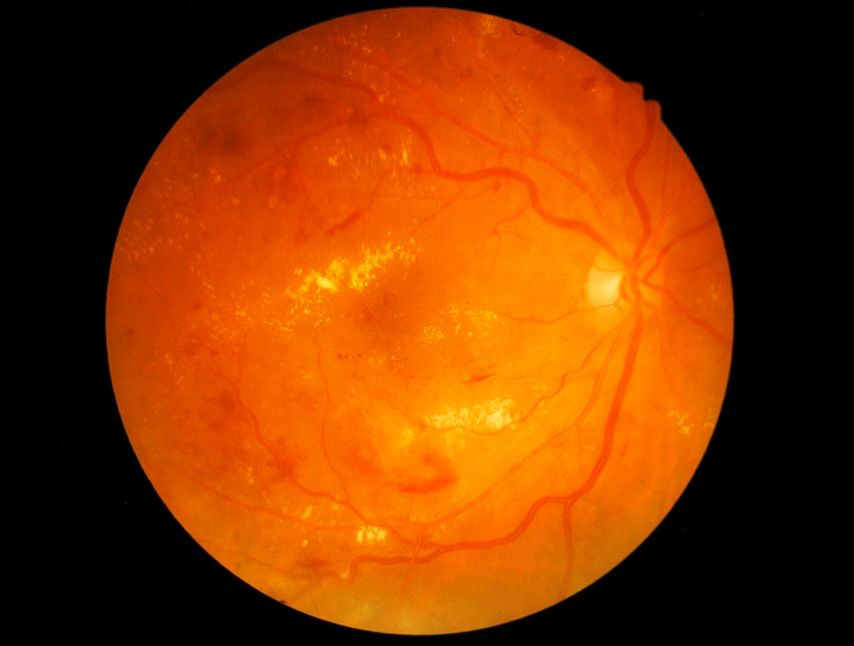
Bei der DRP unterscheidet man nichtproliferative und proliferative Stadien. «In der nichtproliferativen Phase lassen sich funduskopisch zu Beginn Fleckblutungen, Mikroaneurysmen, Exsudate als Zeichen einer Gefässleckage und Cotton-Wool-Herde als Ischämiezeichen feststellen», erläuterte der Ophthalmologe (Abb. 1). Im proliferativen Stadium entstehen Proliferationen (=Neovaskularisationen) auf der Netzhaut, die in einem späteren Stadium Traktionsmembranen bilden, die zu Glaskörperblutungen und Netzhautablösungen führen können. Die DRP ist in unseren Breitengraden die häufigste Ursache für eine Erblindung bei Menschen im erwerbsfähigen Alter. «Proliferative Stadien sind oft Endstadien und Zeichen einer sehr schlechten Stoffwechsellage bei einem langjährigen Diabetes. Diese Stadien sollten wir eigentlich gar nie sehen, sofern das Screening, die Adhärenz und die Therapie adäquat sind», so der Referent. In proliferativen Stadien kann zudem ein neovaskuläres Glaukom auftreten, das schwer beherrschbar ist und innert weniger Jahre zur Erblindung führt und mit einer deutlich erhöhten Mortalität einhergeht.1
Abb. 1: Funduskopie bei diabetischer Retinopathie mit Fleckblutungen, «red dots» und Cotton-Wool-Herden
Ohne Symptome erblinden
Die DRP verursacht in der Regel sehr lange keine Beschwerden. Was Symptome verursacht, ist das Makulaödem. Seine Inzidenz steigt mit der Schwere der Retinopathie, aber 30% der Betroffenen haben auch im Spätstadium der DRP kein Makulaödem und sind symptomfrei. Ohne regelmässige Funduskontrollen kann es also vorkommen, dass ein Patient erblindet, ohne je Visusprobleme gehabt zu haben. «Deshalb sind die regelmässigen Kontrollen absolut zwingend», betonte Kloos.
Pathophysiologisch führt die Hyperglykämie wie in anderen Organen auch in der Netzhaut zu pathologischen Gefässwandveränderungen, die eine retinale Hypoxie verursachen. Dies führt zur Ausschüttung von angiogenen Wachstumsfaktoren wie dem vasoendothelialen Wachstumsfaktor (VEGF) und in weiterer Folge zu Neovaskularisationen, Vasodilatation und Hyperpermeabilität.2 Neuerdings wird auch eine neuronale Dysfunktion als zusätzlicher pathophysiologischer Mechanismus diskutiert, der allerdings noch nicht verstanden wird.3 «Man hat beobachtet, dass zum Teil schon lange vor den vaskulären Veränderungen Degenerationen in den Netzhautschichten beginnen, die über einen anderen Mechanismus ausgelöst werden müssen», erklärte Kloos.
Die Symptome des Makulaödems und damit Warnzeichen, die auf eine Netzhautablösung hinweisen können, sind Visusstörungen wie eine Verschlechterung der Sehschärfe, Leseschwierigkeiten, Farbsinnstörungen und verzerrtes Sehen.4 «Zur Erinnerung: Ein Drittel der Betroffenen ist auch im Spätstadium symptomfrei», betonte der Referent.
In der Schweiz leiden 20–25% der Menschen mit Diabetes an einer DRP und etwa 5% an einem diabetischen Makulaödem.
HbA1c-Senkung reduziert langfristig das Progressionsrisiko
Der Hauptrisikofaktor für eine DRP ist die Diabetesdauer. Nach 20 Jahren Krankheitsdauer haben bei Typ-1-Diabetes (T1D) 80% der Betroffenen eine DRP, bei Typ-2-Diabetes (T2D) sind es 50%.5 «Diese Zahlen stammen aus dem Jahr 1984, sind aber trotz der inzwischen besseren Diabetesbehandlung heute immer noch gültig. Dies zeigt deutlich, dass die Diabetesdauer der wichtigste Faktor für die Entwicklung einer DRP ist», erklärte Kloos. Das Risiko für die Progression der DRP korreliert hingegen eng mit der Hyperglykämie und eine verbesserte Stoffwechsellage reduziert langfristig das Progressionsrisiko.4 Als Faustregel gilt: Eine Senkung des HbA1c um 1% halbiert das Progressionsrisiko und bei HbA1c-Werten unter 6,5% besteht praktisch kein Risiko für eine Progression. Allerdings senkt eine Reduktion des HbA1c das Progressionsrisiko nicht sofort.6 «In den ersten drei Jahren einer besseren Blutzuckereinstellung steigt das Progressionsrisiko sogar noch an und sinkt erst danach deutlich ab. Der genaue Mechanismus dahinter bleibt unklar», erläuterte der Ophthalmologe.
Weitere Risikofaktoren für eine DRP sind die Hypertonie, welche auch ein wichtiger Risikofaktor für das Makulaödem ist, und die Nephropathie.4 Die Albuminurie ist ein Indikator für die DRP und geht dieser fast immer voraus. Das Ausmass der Albuminurie korreliert mit dem Schweregrad der DRP.
Wann sind augenärztliche Kontrollen angezeigt?
Rechtzeitige und regelmässige ophthalmologische Untersuchungen sind bei Diabetes essenziell. Die Deutsche Diabetes Gesellschaft (DDG) empfiehlt bei T2D eine erste augenärztliche Kontrolle bei Diagnosestellung und bei T1D fünf Jahre nach der Diagnosestellung.7 Für die weiteren Kontrollen empfiehlt die DDG ein Intervall von einem Jahr, wenn keine DRP, aber eine Risikokonstellation vorliegt, und ein Intervall von zwei Jahren bei geringem Risiko (HbA1c <7,5%, Diabetesdauer <10 Jahren, keine Hypertonie).7 In der Schweiz besteht – angelehnt an die Empfehlungen der American Academy of Ophthalmology – zunehmend der Konsens, unabhängig von der Risikokonstellation jährliche augenärztliche Kontrollen zu empfehlen. Dies unter anderem deshalb, weil es im praktischen Alltag oft nicht einfach ist, das DRP-Risiko genau zu beurteilen, und weil die Adhärenz bei jährlichen Kontrollen höher ist als bei einem längeren Intervall.
Es gibt auch Bestrebungen, die Einschätzung des DRP-Risikos mittels digitaler Hilfsmittel zu vereinfachen. Das Retina-Risk-Online-Tool beispielsweise, ein Online-Tool zur Selbstkontrolle, berechnet auf der Basis von HbA1c, Diabetesdauer und Blutdruck das individuelle DRP-Risiko und soll es künftig erlauben, das Kontrollintervall individuell anzupassen. Unter Studienbedingungen konnte die Kontrollfrequenz damit um etwa 60% reduziert werden.8,9 Grosses Potenzial hat im DRP-Screening auch die Anwendung von künstlicher Intelligenz (KI). Multizentrische Studien zeigen, dass KI Fundusbilder sehr zuverlässig beurteilt. Beim Stellen der Diagnose einer DRP wiesen Allgemeinophthalmologen eine Sensitivität von 20% auf und Netzhautspezialisten eine von 60% versus 97% mit dem automatisierten KI-Screening.10,11
Für die Überweisung zur augenärztlichen Untersuchung empfiehlt der Referent das standardisierte elektronische Anmeldeformular der Schweizerischen Ophthalmologischen Gesellschaft (SOG), das unter www.medforms.ch heruntergeladen oder direkt online ausgefüllt und eingeschickt werden kann.
Laserkoagulation und Anti-VEGF-Injektionen
Bei einer DRP im proliferativen Stadium ist die Laserkoagulation der Goldstandard. Dabei werden die ischämischen Areale verödet, wodurch die VEGF-Ausschüttung reduziert und die Bildung von Proliferationen gestoppt wird. «Die Behandlung ist sehr effektiv. Sie senkt das Risiko für eine Erblindung um den Faktor 10 und führt in den meisten Fällen zu einer Stabilisierung der Situation», so Kloos.
Beim diabetischen Makulaödem besteht die Standardtherapie in der intravitrealen Injektion von VEGF-Hemmern. In der Schweiz sind vier Anti-VEGF-Antikörper zugelassen: Ranibizumab (Lucentis®), Aflibercept (Eylea®), Brolucizumab (Beovu®) und Faricimab (Vabysmo®). Die Präparate weisen eine gute und vergleichbare Wirksamkeit auf.12 Bevacizumab (Avastin®), das ebenfalls gut wirkt, kann nur «off-label» verwendet werden, da es für die Anwendung in der Ophthalmologie keine Zulassung hat. Die Injektionen verbessern die Sehkraft auf der Visustafel im Schnitt um zwei Linien mit insgesamt zehn Buchstaben. «Das ist ein hervorragender Erfolg», sagte der Referent. «Es ist aber wichtig, sich zu vergegenwärtigen, dass auch die Visusstabilisierung bereits ein Therapieerfolg ist. Der natürliche Verlauf des Makulaödems bedeutet nämlich eine stetige Abnahme des Visus.»
Die Anti-VEGF-Behandlung wird mit drei Injektionen im Abstand von je einem Monat begonnen. Anschliessend kann reaktiv oder proaktiv weiterbehandelt werden. Bei der reaktiven Therapie wird das Auge, solange die Makula trocken ist, monatlich kontrolliert. Tritt erneut ein Makulaödem auf, werden wieder drei Injektionen in monatlichem Abstand verabreicht und anschliessend wird wieder monatlich nachkontrolliert, bis eine erneute Behandlung nötig ist. Bei der proaktiven Therapie, die vorwiegend bei Patient:innen zur Anwendung kommt, die häufige Injektionen benötigen, werden auch bei trockener Makula in grösseren Intervallen regelmässig Erhaltungsdosen verabreicht. Während der ersten drei Behandlungsjahre werden im Schnitt 7 bis 8 Injektionen pro Jahr benötigt, danach nimmt der Bedarf ab. «Entscheidend für den Erfolg der Behandlung ist, dass die Kontroll- und Therapieintervalle strikt eingehalten werden. Eine gute Compliance ist zwingend», betonte Kloos. Gleichzeitig muss darauf geachtet werden, dass der Diabetes gut eingestellt ist. Bei schlechter Stoffwechselkontrolle ist die Injektions-Behandlung deutlich weniger wirksam.
Die Kosten einer Anti-VEGF-Behandlung belaufen sich in der Schweiz unabhängig vom Präparat auf ungefähr CHF 13000.– pro Jahr.13 Unter Berücksichtigung der gesamten sozioökonomischen Kosten ist die Behandlung jedoch deutlich günstiger als die Folgekosten eines unbehandelten diabetischen Makulaödems mit Verlust von Arbeitsfähigkeit, Mobilität und Selbstständigkeit und der daraus folgenden verminderten Lebensqualität.14
Quelle:
FOMF Diabetes Update Refresher, 7. bis 9. November 2024, Zürich
Literatur:
1 Lee R et al.: Epidemiology of diabetic retinopathy, diabetic macular edema and related vision loss. Eye Vis (Lond) 2015; 2: 17 2 Tomita Y et al.: Updates on the current treatments for diabetic retinopathy and possibility of future oral therapy. J Clin Med 2021; 10: 4666 3 Ricca AM et al.: New thinking on diabetes and the retina. The process of retinal neurodegeneration precedes microvascular disease. Retina Specialist 2016 [Internet] 4 Ziemssen F et al.: Nationale Versorgungsleitlinie (NVL) Diabetische Retinopathie. 2. Auflage der NVL zur Therapie der diabetischen Retinopathie. Ophthalmologe 2016; 113: 623-38 5 Klein BE, Klein R: Gravidity and diabetic retinopathy. Am J Epidemiol 1984; 119: 564-9 6 Bain SC et al.: Worsening of diabetic retinopathy with rapid improvement in systemic glucose control: a review. Diabetes Obes Metab 2019; 21: 454-66 7 Deutsche Diabetes Gesellschaft: Nationale Versorgungsleitlinie: Prävention und Therapie von Netzhautkomplikationen bei Diabetes. 2015; AWMF-Register-Nr.: nvl-001b 8 Van der Heijden A et al.: Validation of a model to estimate personalised screening. Diabetologia 2014; 57: 1332-8 9 Aspelund T et al.: Individual risk assessment and information technology to optimise screening frequency for diabetic retinopathy. Diabetologia 2011; 54: 2525-32 10 Lim JI et al.: Artificial intelligence detection of diabetic retinopathy. Ophthalmol Sci 2022; 3: 100228 11 Kim TN et al.: Comparison of automated and expert human grading of diabetic retinopathy using smartphone-based retinal photography. Eye (Lond) 2021; 35: 334-42 12 The Diabetic Retinopathy Clinical Research Network: Aflibercept, bevacizumab, or ranibizumab for diabetic macular edema. N Engl J Med 2015; 372: 1193-203 13 Schmid MK et al.: Comparison of outcomes and costs of ranibizumab and aflibercept treatment in real-life. PLoS One 2015; 10: e0135050 14 Pershing S et al.: Cost-effectiveness of treatment of diabetic macular edema. Ann Intern Med 2014; 160: 18-29
Das könnte Sie auch interessieren:
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...
Neue Studiendaten zu Typ-2-Diabetes und Lebensstil
Dass gesunde Ernährung und Bewegung das Diabetesrisiko sowie verschiedene Risiken von Patienten mit Diabetes senken, ist seit Langem bekannt. Und das Detailwissen zur Bedeutung von ...
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...