Therapeutisches Drug-Monitoring (TDM) in der Neuropsychopharmakologie: von der Theorie zur klinischen Routine
Autoren:
Prof. Dr. med. Georgios Schoretsanitis, PhD1–4
Dr. med. Maxim Kuzin5
1 Unit of Pharmacogenetics and Clinical Psychopharmacology, Centre de neurosciences psychiatriques, Centre hospitalier universitaire vaudois (CHUV), Université de Lausanne
2 Psychiatrische Universitätsklinik Zürich
3 The Zucker Hillside Hospital, Department of Psychiatry Research, Northwell Health, Glen Oaks, New York, USA
4 Department of Psychiatry, Zucker School of Medicine at Hofstra/Northwell, Hempstead, NY, USA
5 Oberberg Fachklinik Rhein-Jura,Privatklinik für Psychiatrie, Psychosomatik und Psychotherapie
Bad Säckingen
Korrrespondierender Autor:
Prof. Dr. med. Georgios Schoretsanitis, PhD
E-Mail: george.schor@gmail.com
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Therapeutisches Drug-Monitoring (TDM) verbindet angewandte Pharmakokinetik mit der klinischen Praxis und stellt damit ein wertvolles Instrument der Präzisionsmedizin dar. Absorption, Verteilung, Metabolisierung und Ausscheidung sind wesentliche Phasen der Pharmakokinetik, die eine grosse klinische Bedeutung haben und entscheidend für die Entwicklung der Wirkstoff-konzentrationen sind. Eine individuell angepasste Dosierung verbessert nicht nur die Wirksamkeit der psychopharmakologischen Behandlung, sondern erhöht auch die Arzneimittelsicherheit.
Keypoints
-
TDM ist kein Luxus, sondern ein wertvolles klinisches Instrument und gilt vor allem als Standard bei Psychopharmaka mit engem therapeutischem Fenster (z. B. Lithium, Clozapin).
-
Denken Sie an TDM bei jeder klinischen Herausforderung: Polypharmazie, Nieren-/Leberfunktionsstörungen, unklares Ansprechen auf die Therapie oder Verdacht auf Adhärenzprobleme.
-
Eine fundierte Beurteilung der psychopharmakologischen Behandlung erfordert im klinischen Kontext die Integration zweier zentraler Ansätze: TDM und der psychopathologischen Längsschnittbeurteilung.
Therapeutisches Drug-Monitoring
TDM beschäftigt sich mit der Messung von Arzneistoffen in Körperflüssigkeiten, am häufigsten im Blutplasma/Serum. Die Präzision der Spiegelmessung wird durch verschiedene Faktoren beeinflusst, wie z.B. den Zeitpunkt der Blutabnahme und der Verabreichung, den Steady-State oder die Halbwertszeit des Pharmakons. Die gemessenen Konzentrationen erlauben eine individuell abgestimmte Anpassung der Tagesdosis, sodass eine optimale therapeutische Wirkung erzielt werden kann. Somit ist TDM ein Vorreiter der personalisierten Medizin, zu welcher auch die Pharmakogenetik gehört. Ausserdem ist TDM in zahlreichen Leitlinien fest verankert, wie z.B. in der Nationalen VersorgungsLeitlinie Unipolare Depression1 oder der S3-Leitlinie Schizophrenie.2 Aktuell sprechen bis zu 50% der Patient:innen nicht ausreichend auf Psychopharmaka3 an, hierbei kann TDM wesentliche Abhilfe schaffen.
Konzept des «therapeutischen Referenzbereichs»
Das Ziel der TDM-gesteuerten Psychopharmakotherapie ist, für jedes Medikament den individuellen therapeutischen Referenzbereich zu erreichen. In diesem Bereich haben die Patient:innen die höchste Wahrscheinlichkeit, von der psychopharmakologischen Behandlung zu profitieren und idealerweise der angestrebten Vollremission der Symptomatik einen Schritt näher zu kommen. Für jedes Pharmakon gilt basierend auf Bevölkerungsdaten ein therapeutischer Referenzbereich, welcher für die individuelle Dosisanpassung als Orientierungsinstrument gilt. Deutlich unterhalb der definierten Untergrenze des therapeutischen Referenzbereichs (subtherapeutisch) ist das therapeutische Ansprechen auf die initiierte psychopharmakologische Behandlung unwahrscheinlich. Konzentrationen oberhalb der festgelegten Obergrenze bzw. supratherapeutische Spiegelwerte sind mit einer erhöhten Wahrscheinlichkeit für Nebenwirkungen assoziiert, wobei eine weitere klinische Verbesserung weniger wahrscheinlich erscheint. Als toxischer Referenzbereich gilt der Konzentrationsbereich oberhalb vom Zweifachen der Obergrenze des therapeutischen Referenzbereichs, mit Ausnahme von einigen Medikamenten mit einem weniger günstigen Sicherheitsprofil, wo der toxische Referenzbereich tiefer liegt, wie z.B. bei Clozapin. Bei Erreichen dieses Bereichs sollte insbesondere bei Auftreten von unerwünschten Nebenwirkungen eine Dosisreduktion in Erwägung gezogen werden.
Der therapeutische Referenzbereich dient als eine sogenannte Navigationshilfe im klinischen Kontext und ist nicht für alle unsere Patient:innen uneingeschränkt anwendbar. Eine fundierte Beurteilung erfordert im klinischen Kontext vielmehr die Integration von mindestens zwei Ansätzen, nämlich des TDM und der Psychopathologie in der Längsschnittbeurteilung. Es ist auch denkbar, dass einzelne Patient:innen eine optimale therapeutische Response ausserhalb des therapeutischen Referenzbereichs zeigen.4 Die Korrelation zur klinischen Wirkung ermöglicht es, ein individualisiertes TDM-Profil für die psychopharmakologische Behandlung abzuleiten.
Die Konsensus-Leitlinien zum TDM in der Neuropsychopharmakologie bestehen seit über zwanzig Jahren.4–6 Der Algorithmus für die Definition des therapeutischen Referenzbereiches war bis vor wenigen Jahren nicht erfasst. Der systematische Ansatz mit Berücksichtigung der PRISMA(«preferred reporting items for systematic reviews and meta-analyses»)-Leitlinien wurde 2021 veröffentlicht7 und fand bereits seine Anwendung in neuen Publikationen zu den therapeutischen Referenzbereichen z.B. von Escitalopram8 und Aripiprazol.9
Die Rolle der Pharmakokinetik: praktische Beispiele
Die Pharmakokinetik beschreibt die Prozesse, wodurch der Körper mit dem Arzneistoff interagiert,10 nämlich von der Einnahme bis zur Ausscheidung. Die Phasen dieser Interaktion werden durch die Abkürzung (L)ADME zusammengefasst und stehen für Absorption, Distribution, Metabolisierung und Exkretion. Liberation, auch als Freisetzung (konstante vs. nicht konstante Freisetzungsdynamik) bezeichnet, wird häufig als initialer Schritt in der Pharmakokinetik betrachtet. Zur Übersicht werden die ersten Phasen (L, A und D) als «Anfluten» und die letzten beiden Phasen (M und E) als «Abfluten» zusammengefasst.
Die wesentliche interindividuelle Heterogenität dieser vier Prozesse wird durch diverse Faktoren beeinflusst. Dazu gehören Alter, Geschlecht, bestehende Erkrankungen, Schwangerschaft, pharmakokinetischer Genotyp, Adhärenz, Arzneimittelinteraktionen, Ernährungsgewohnheiten sowie Tabakkonsum.4 Daher kann es im Verlauf der Behandlung erforderlich sein, die bestehende psychopharmakologische Medikation beispielsweise bei Arzneimittelinteraktionen entsprechend anzupassen. Das Risiko für Arzneimittelinteraktionen nimmt mit der Anzahl der verordneten Medikamente zu. Die Behandlung von Patient:innen mit Polypharmazie, meistens als gleichzeitige Einnahme von mindestens fünf verschiedenen Arzneimitteln definiert, stellt häufig eine Herausforderung in der klinischen Versorgung dar.11
Absorption
Warum die Einnahme mit der Mahlzeit entscheidend ist
Nach der Freisetzung erfolgt die Absorption, welche meist im Magen-Darm-Trakt beginnt. Bei den verfügbaren Schmelztabletten (z.B. Olanzapin, Lorazepam) findet die Absorption bereits über die Mundschleimhaut statt. Die Geschwindigkeit und das Ausmass, mit dem ein Wirkstoff aufgenommen wird, werden durch die Bioverfügbarkeit bestimmt. Diese gibt den Prozentsatz der unveränderten Substanz im systemischen Kreislauf an und variiert zwischen 5% und 100%.4 Die Bioverfügbarkeit kann durch verschiedene Faktoren beeinflusst werden, beispielsweise durch spezifische Vorgaben zur Einnahme mit Mahlzeiten oder durch veränderte anatomische Bedingungen.
Bei Lurasidon, einem atypischen Antipsychotikum, wird z.B. die Einnahme zusammen mit der Mahlzeit (mindestens 350 Kalorien) empfohlen,12 damit die niedrige Bioverfügbarkeit von 9–19% signifikant gesteigert werden kann.13 Die gesteigerte orale Bioverfügbarkeit bei gleichzeitiger Nahrungsaufnahme ist auf unterschiedliche Einflussfaktoren zurückzuführen, darunter z.B. eine verzögerte Magenentleerung, eine reduzierte hepatische Clearance, Veränderungen des Magen-pH-Werts sowie ein verstärkter Gallenfluss.14
Wieso die psychopharmakologische Behandlung bariatrischer Patient:innen eine Herausforderung sein kann
Veränderungen in der Physiologie oder Anatomie des Gastrointestinaltrakts, z.B. nach bariatrischen Eingriffen, können die Bioverfügbarkeit von Arzneimitteln erheblich beeinflussen, wobei diese Effekte oftmals nicht vorhersehbar sind. Trotz ihrer klinischen Bedeutung ist die Datenlage zum TDM nach bariatrischen Operationen weiterhin begrenzt.15–17 Postoperativ kann es zu erheblichen Schwankungen der Plasmaspiegel kommen. So wurde beispielsweise für Aripiprazol ein starker Abfall des Plasmaspiegels beschrieben,18 während im Fall von Lithium ein deutlicher Anstieg dokumentiert wurde.19 Diese Beobachtungen unterstreichen die Bedeutung einer sorgfältigen Pharmakovigilanz in der postoperativen Phase. Die aktuelle Datenlage liegt nur für einzelne Substanzen vor und lässt sich nicht auf die anderen Substanzen übertragen, auch nicht innerhalb einer Substanzklasse. Ein Überblick über die klinische Relevanz des TDM nach bariatrischen Operationen wurde in der letzten Ausgabe von Leading Opinions Neurologie & Psychiatrie detailliert dargestellt.20
Verteilung: Lipophilie und Proteinbindung im klinischen Alltag
Distribution bzw. Verteilung bedeutet die Verteilung der Psychopharmaka in unterschiedlichen Körpergeweben. Zwei Faktoren spielen dabei eine Rolle: die Lipophilie des Wirkstoffs und die Proteinbindungseigenschaften.
Die Lipophilie eines Wirkstoffs beschreibt dessen Fähigkeit, von fettreichen Strukturen aufgenommen zu werden. Die Proteinbindungseigenschaften bestimmen dagegen den Anteil des Wirkstoffs, der in freier und damit pharmakologisch aktiver Form vorliegt. In gebundener Form (z.B. meist an Albumin) sind die Wirkstoffe pharmakologisch inaktiv und werden zum jeweiligen Wirkort transportiert. Die resultierende Affinität des Pharmakons zu den Gewebestrukturen bestimmt seine Verteilung im Körper. Bei fettlöslichen Arzneistoffen erfolgt nicht nur eine gleichmässige Verteilung in Kompartimenten/Verteilungsräumen (Fettgewebe, Leber etc.), sondern auch die Anreicherung in Gewebestrukturen. Als Zentralkompartiment wird oft das Blut angenommen. Während des Verteilungsprozesses gleicht sich die freie Konzentration des Wirkstoffs im Plasma mit den freien Konzentrationen des Wirkstoffs in anderen Kompartimenten aus.21 Das Verteilungsvolumen ist eine weitere pharmakokinetische Kenngrösse, die das Ausmass der Verteilung eines Arzneistoffes im menschlichen Körper beschreibt. Die meisten Psychopharmaka haben hohe Verteilungsvolumina und werden dementsprechend im Gewebe gebunden. Damit liegt nur ein Bruchteil der verabreichten Dosis im Plasma in freier oder gebundener Form vor.21
Kompartimentsveränderungen und Schwankungen im Plasmaproteinstatus können die Wirkung und Verfügbarkeit von Psychopharmaka deutlich beeinflussen (siehe Fallbericht: Klinisch relevante Veränderungen der Clozapin-Serumkonzentrationen nach einer Brustverkleinerungsoperation).22
Metabolisierung: Leberfunktionund Arzneimittelinteraktionen
Die grosse Mehrheit von Psychopharmaka wird hepatisch metabolisiert. Die Ausnahmen schliessen z.B. substituierte Benzamide (Sulpirid und Amisulprid), Lithium und Memantin ein. Bei der Metabolisierung wird zwischen Phase-I- und Phase-II-Reaktionen differenziert.
Während der Phase-I-Reaktion erfährt das Pharmakon eine strukturelle Modifikation durch chemische Funktionalisierung. In dieser Phase stehen Biotransformationsmechanismen im Vordergrund und über das Cytochrom-P-450-System (CYP) entstehen aktive oder inaktive Metaboliten. Während der Phase-II-Reaktion wird ein aus der Phase I entstandener Metabolit durch Konjugation mit endogenen Substanzen weiterverarbeitet (aktivierte Glukuronsäure, Glyzin etc.).21 Die Phase I stellt eine notwendige Voraussetzung für die Phase II dar, die von einer anschliessenden Elimination gefolgt wird.
Für das P450-System wurden bislang 57 funktionale Gene identifiziert und basierend auf der primären Struktur (Aminosäurensequenz) in 18 CYP-Genfamilien (CYP1, CYP2, CYP3 etc.) und 43 Subfamilien (CYP1A, CYP2A, CYP2B etc.) unterteilt. Wechselwirkungen von Medikamenten auf der CYP-Ebene können die Verstoffwechselung entweder steigern (Induktion) oder verringern (Inhibierung). Dies kann dazu führen, dass die Therapie nicht wirkt oder es zu unerwünschten Nebenwirkungen beziehungsweise Vergiftungen kommt. TDM ermöglicht die Identifikation potenzieller Wechselwirkungen von Medikamenten, dadurch können notwendige Anpassungen innerhalb einer laufenden psychopharmakologischen Behandlung zeitnah und gezielt vorgenommen werden (siehe Fallbericht: Wechselwirkungen zwischen Medikamenten können zu nicht nachweisbaren Serumkonzentrationen von Quetiapin in Gegenwart von Carbamazepin führen).23
Exkretion: Anpassungen der Behandlung bei Niereninsuffizienz
Die Exkretion der Psychopharmaka in unveränderter Form oder als Metabolit erfolgt im Wesentlichen über die Niere, die biliäre Ausscheidung spielt eine zweitrangige Rolle. Die renale Exkretion stellt den abschliessenden Schritt des Eliminationsprozesses dar, der initial in der Leber (Steigerung der Hydrophilie, Phase-II-Reaktion) eingeleitet wird.
Der altersabhängige Rückgang der Nierenfunktion ist seit Langem bekannt.24 Dadurch können sich die Wirkstoffe im Körper anreichern, was das Risiko für Nebenwirkungen deutlich steigert und sogar zu Intoxikationen führen kann. Die glomeruläre Filtrationsrate und der renale Blutfluss nehmen dabei zunehmend ab, wobei das Ausmass dieser Veränderungen von Person zu Person unterschiedlich ist. Die Tagesdosierung sollte beispielsweise bei Lithium, Venlafaxin und Risperidon entsprechend der Nierenfunktion angepasst werden. Für Lithium existieren auch umfassende Empfehlungen zur Steuerung der pharmakologischen Therapie.25,26 Im Fall der Nierenersatztherapie (Dialyse) ist die Datenlage weiterhin sehr begrenzt, z.B. im Hinblick auf die relativen Vorteile und Nachteile der antidepressiven Behandlung.27
Indikationen für TDM
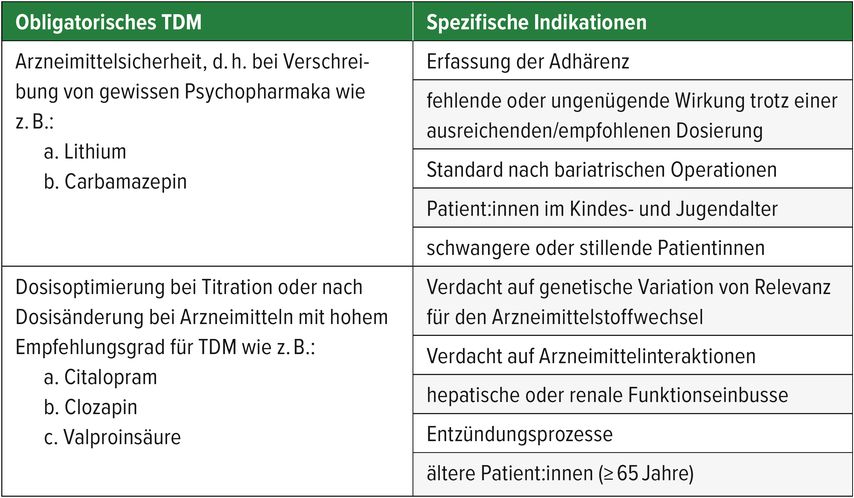
Gestützt auf die aktuelle Konsensus- Leitlinie für das therapeutische Drug-Monitoring in der Neuropsychopharmakologie lässt sich zwischen einem obligatorischen TDM und spezifischen Indikationen für die Anwendung von TDM unterscheiden.4 TDM gilt in der Behandlung mit einer kleinen Gruppe von Psychopharmaka wie z.B. Lithium oder Carbamazepin als obligatorisch, dabei handelt es sich um Medikamente mit einem engen therapeutischen Referenzbereich. Ebenfalls gilt TDM als obligatorisch für eine Dosisoptimierung während der Titration oder nach Dosisänderung bei Arzneimitteln mit robuster Evidenzlage bzgl. der Sinnhaftigkeit von TDM bzw. solchen mit hohem TDM-Empfehlungsgrad. Bei spezifischen Indikationen kann eine Reihe von klinischen Fragestellungen mittels TDM-Anwendung beantwortet werden, wie z. B. eine Rückfallprävention aufgrund unsicherer Medikamenteneinnahme oder Optimierung der Psychopharmakotherapie bei schwangeren oder stillenden Patientinnen. Tabelle 1 gibt einen Überblick über die möglichen Fragestellungen.
Tab. 1: Typische Indikationen für TDM als exemplarische Darstellung, modifiziert nach Hiemke et al.4
Fazit
Die Komplexität der Pharmakotherapie mit der damit assoziierten Polypharmazie ist in der alternden Bevölkerung seit mehreren Jahren ein fester Bestandteil in der klinischen Tätigkeit. TDM ist ein etabliertes und evidenzbasiertes Instrument der Präzisionsmedizin und eröffnet die Möglichkeit einer individualisierten pharmakologischen Behandlung. Bei sachgemässer Anwendung und Interpretation der Befunde unterstützt es Kliniker:innen dabei, spezifische Fragestellungen zu beantworten und die therapeutischen Konzepte gezielt zu optimieren. Jede Phase der Pharmakokinetik hat eine erhebliche klinische Bedeutung und kann massgeblich den Behandlungserfolg, das Risiko von Nebenwirkungen sowie das mögliche Therapieversagen beeinflussen. Ein fundiertes Verständnis dieser Prozesse ermöglicht es, die angewandte Pharmakokinetik mit der klinischen Praxis zu verknüpfen.
Fallbericht: Klinisch relevante Veränderungen der Clozapin-Serumkonzentrationen nach einer Brustverkleinerungsoperation22
Eine 57-jährige Patientin mit residualer Schizophrenie war in den letzten Jahren stabil mit ihrem Gewicht (Body-Mass-Index [BMI] von 38,75kg/m2). Die Medikation bestand aus Clozapin (325mg/Tag), Aripiprazol (15mg/Tag), Paroxetin (40mg/Tag) und Pirenzepin (100mg/Tag) und wurde bis auf eine Hypersalivation gut vertragen. Aufgrund einer beidseitigen Hypertrophie der Mamma mit orthopädischen Beschwerden unterzog sich die Patientin einer Brustverkleinerung. Insgesamt wurden 6450 Gramm an Brustgewebe entfernt, was zu einer deutlichen BMI-Reduktion führte (postoperativer BMI: 36,33kg/m2).
Im postoperativen Verlauf klagte die Patientin über Müdigkeit und Konzentrationsschwäche, wobei erhöhte Clozapin- und Norclozapin-Serumkonzentrationen gemessen wurden. Dementsprechend wurde die Tagesdosierung von Clozapin auf 300mg und später auf 250mg reduziert. Dennoch blieben in den nächsten Verlaufsuntersuchungen innerhalb von einem halben Jahr die erhöhten Clozapin- und Norclozapin-Konzentrationen bestehen (1192,0ng/ml und 530,0ng/ml, therapeutischer Referenzbereich für Clozapin 350–600ng/ml)
Kommentar:
Clozapin, ein atypisches Antipsychotikum, ist eine stark lipophile Substanz mit einer hohen Proteinbindung von über 97%.28 Die Verringerung des Verteilungs-volumens von Clozapin aufgrund der Reduzierung des Fettgewebes ist ein Erklärungsmodell für den demonstrierten klinischen Befund. Ärzte sollten sich der pharmakokinetischen Veränderungen nach Operationen zur Gewichtsreduktion bewusst sein.
Fallbericht: Klinisch relevante Veränderungen der Clozapin-Serumkonzentrationen nach einer Brustverkleinerungsoperation.22
Eine 57-jährige Patientin mit residualer Schizophrenie war in den letzten Jahren stabil mit Ihrem Gewicht (Body-Mass-Index (BMI) von 38,75kg/m2). Die Medikation bestand aus Clozapin (325mg/Tag), Aripiprazol (15mg/Tag), Paroxetin (40mg/Tag) und Pirenzepin (100mg/Tag) und wurde bis auf eine Hypersalivation gut vertragen. Aufgrund einer beidseitigen Hypertrophie der Mamma mit orthopädischen Beschwerden unterzog sie sich einer Brustverkleinerung. Insgesamt wurden 6.450 Gramm der Brustgewebe entfernt, was zu einer drastischen BMI-Reduktion führte (postoperativer BMI: 36,33kg/m2).
Im postoperativen Verlauf klagte die Patientin über Müdigkeit und Konzentrationsschwäche, wobei erhöhte Clozapin- und Norclozapin-Serumkonzentrationen gemessen wurden. Dementsprechend wurde die Tagesdosierung von Clozapin auf 300 mg und später auf 250mg reduziert. Dennoch blieben in den nächsten Verlaufsuntersuchungen innerhalb von einem halben Jahr die erhöhten Clozapin- und Norclozapin-Konzentrationen bestehen (1192,0 ng/ml und 530,0ng/ml, therapeutischer Referenzbereich für Clozapin 350–600ng/ml).
Kommentar:
Clozapin, ein atypisches Antipsychotikum, ist eine stark lipophile Substanz mit einer hohen Proteinbindung von über 97%.28 Die Verringerung des Verteilungsvolumens von Clozapin aufgrund der Reduzierung des Fettgewebes ist ein Erklärungsmodell für den demonstrierten klinischen Befund. Ärzte sollten sich der pharmakokinetischen Veränderungen nach Operationen zur Gewichtsreduktion bewusst sein.
Fallbericht: Wechselwirkungen zwischen Medikamenten können zu nicht nachweisbaren Serum-konzentrationen von Quetiapin in Gegenwart vonCarbamazepin führen23
Eine 44-jährige Frau mit einer schizoaffektiven Störung wurde aufgrund einer Verschlechterung ihrer psychotischen Symptome im Krankenhaus aufgenommen. Sie wurde mit 8mg/Tag Risperidon, 600mg Carbamazepin als Stimmungsstabilisator und 10mg Zolpidem behandelt.
Die psychopharmakologische Therapie wurde angepasst, wobei Risperidon abgesetzt und stattdessen Quetiapin verabreicht wurde. Sieben Tage nach dem Erreichen der Zieldosis von Quetiapin (700mg/Tag) war bei zwei Messungen keine Quetiapin-Konzentration im Serum feststellbar. Die Medikamenteneinnahme erfolgte stets unter Aufsicht des Pflegepersonals. Daraufhin wurden Risperidon, Carbamazepin und Zolpidem abgesetzt und es wurde eine Behandlung mit Lithium initiiert, ohne die Tagesdosierung von Quetiapin zu ändern. Unter dieser neuen Therapie war ein signifikanter Anstieg des Quetiapin-Spiegels zu verzeichnen. In den folgenden Wochen verbesserte sich der klinische Zustand der Patientin deutlich, sodass sie schliesslich entlassen werden konnte.
Kommentar:
Quetiapin ist ein atypisches Antipsychotikum, dessen primärer hepatischer Metabolismus über das Enzym CYP3A4 erfolgt. Carbamazepin, Antiepileptikum und ein Stimmungsstabilisator, ist ein starker Induktor von CYP3A4. Eine gleichzeitige Verschreibung von Carbamazepin und Quetiapin kann über die CYP3A4 induzierende Wirkung, selbst bei hoher Tagesdosierung von Quetiapin, zu einem Therapieversagen führen.
Interessenkonflikte
Georgios Schoretsanitis erhielt seit 2020/2021 Honorare für Referenten- und Beratungsleistungen von Dexcel Firma, HLS Therapeutics, Lundbeck, OM Suisse, Saladax und Thermo Fisher Scientific. Maxim Kuzin erhielt Reisehonorare von Sunovion Pharmaceutical (Basel, Schweiz) und Otsuka Pharmaceutical (Glattbrugg, Schweiz). Ausserdem erhielt er ein Honorar für die Teilnahme am Speakerboard von Lundbeck (Zürich, Schweiz).
Literatur:
1 Bundesärztekammer (BÄK) et al.: Nationale Versorgungs-Leitlinie Unipolare Depression – Langfassung, Version 3.2.2022, zuletzt aufgerufen am 22.9.2025 2 DGPPN e. V. (Hrsg.) für die Leitungsgruppe: S3-Leitlinie Schizophrenie. Kurzfassung, 2019, Version 1.0, zuletzt geändert am 15.3.2019 3 O‘Donoghue B et al.: Response rates to sequential trials of antipsychotic medications according to algorithms or treatment guidelines in psychotic disorders. A systematic review and meta-analysis. Schizophr Res 2024; 268: 193-204 4 Hiemke C et al.: Consensus guidelines for therapeutic drug monitoring in neuropsychopharmacology: Update 2017. Pharmacopsychiatry 2018; 51 (1-02): 9-62 5 Hiemke C et al.: AGNP Consensus guidelines for therapeutic drug monitoring in psychiatry: Update 2011. Pharmacopsychiatry 2011; 44(6): 195-235 6 Baumann P et al.: The AGNP-TDM expert group consensus guidelines: therapeutic drug monitoring in psychiatry. Pharmacopsychiatry 2004; 37(6): 243-65 7 Hart XM et al.: Therapeutic reference ranges for psychotropic drugs: a protocol for systematic reviews. Front Psychiatry 2021; 12: 787043 8 Eichentopf L et al.: Systematic review and meta-analysis on the therapeutic reference range for escitalopram: Blood concentrations, clinical effects and serotonin transporter occupancy. Front Psychiatry 2022; 13: 972141 9 Hart XM et al.: Therapeutic reference range for aripiprazole in schizophrenia revised: a systematic review and metaanalysis. Psychopharmacology (Berl) 2022; 239(11): 3377-91 10 Grogan S, Preuss CV: Pharmacokinetics. In StatPearls: Treasure Island (FL): StatPearls Publishing; 2025 11 Wolff J et al.: Polypharmacy and the risk of drug-drug interactions and potentially inappropriate medications in hospital psychiatry. Pharmacoepidemiol Drug Saf 2021; 30(9): 1258-68 12 Food and Drug Administration (FDA): Full prescribing information Latuda (lurasidone hydrochloride). 2010, Stand 01/2025 13 Caccia S et al.: Critical appraisal of lurasidone in the management of schizophrenia. Neuropsychiatr Dis Treat 2012; 8: 155-68 14 Miao Y et al.: Enhanced oral bioavailability of lurasidone by self-nanoemulsifying drug delivery system in fasted state. Drug Dev Ind Pharm 2016; 42(8): 1234-40 15 Brown CS et al.: Antiseizure medication use in gastric bypass patients and other post-surgical malabsorptive states. Epilepsy Behav Rep 2021; 16: 100439 16 Wallerstedt SM et al.: Serum concentrations of antidepressants, antipsychotics, and antiepileptics over the bariatric surgery procedure. Eur J Clin Pharmacol 2021; 77(12): 1875-85 17 Porat Det al.: Managing the unpredictable: mechanistic analysis and clinical recommendations for lamotrigine treatment after bariatric surgery. J Clin Med 2021; 10(23): 5627 18 Kuzin M et al.: Switching from aripiprazole tablets to oral suspension in a patient with Roux-en-Y Gastric Bypass: a case report. J Clin Psychopharmacol 2023; 43(3): 300-2 19 Ayub S et al.: Lithium toxicity following Roux-en-Y gastric bypass: mini review and illustrative case. Ment Health Clin 2022; 12(3): 214-8 20 Kuzin M et al.: Bariatrische Chirurgie und Psychopharmakologie: Welchen Beitrag kann therapeutisches Drug-Monitoring leisten? Leading Opinions Neurologie & Psychiatrie 2025; 3: 53-6 21 Riederer P, Laux G: Grundlagen der Neuro-Psychopharmakologie. Ein Therapiehandbuch. Wien, New York: Springer; 2010 22 Schoretsanitis G et al.: Clinically relevant changes in clozapine serum concentrations after breast reduction surgery. Aust N Z J Psychiatry 2017; 51(10): 1059-60 23 Nickl-Jockschat T et al.: Drug interaction can lead to undetectable serum concentrations of quetiapine in the presence of carbamazepine. Clin Neuropharmacol 2009; 32(1): 55 24 Guppy M et al.: Rate of decline in kidney function with age: a systematic review. BMJ Open 2024; 14(11): e089783 25 Tondo L et al.: Clinical use of lithium salts: guide for users and prescribers. Int J Bipolar Disord 2019: 7(1): 16 26 Malhi GS et al.: The use of lithium for the treatment of bipolar disorder: recommendations from clinical practice guidelines. J Affect Disord 2017; 217: 266-80 27 Palmer SC et al.: Antidepressants for treating depression in adults with end-stage kidney disease treated with dialysis. Cochrane Database Syst Rev 2016; 2016(5): CD004541 28 Food and Drug Administration (FDA). Prescribing information Clozaril. Stand 2/2020
Das könnte Sie auch interessieren:
Wie die Schwangerschaft Gehirn und Psyche beeinflusst
Eine Schwangerschaft verändert nicht nur den Körper, sondern auch das Gehirn und die Psyche einer Frau tiefgreifend. Diese Veränderungen markieren den Beginn einer eigenständigen ...
Blut-Hirn-Schranke im Fokus: neue Evidenz für ihre Durchlässigkeit bei Schizophrenie-Spektrum-Störungen
Die Blut-Hirn-Schranke (BHS) steht zunehmend im Zentrum der Forschung zu Schizophrenie-Spektrum-Störungen („schizophrenia spectrum disorders“, SSD).Eine aktuelle Studie der LMU München ...
Ketamin-augmentierte Psychotherapie
Das schnell wirksame Antidepressivum (S-)Ketamin wird bei therapieresistenten Patient:innen effektiv eingesetzt. Als zentrale Komponente eines biphasischen Wirkmechanismus wird für ...