Ketamin-augmentierte Psychotherapie
Autoren:
Univ.-Prof. Dr. med. Martin Walter
Leonard Marx
Universitätsklinik für Psychiatrie und Psychotherapie
Universitätsklinikum Jena
E-Mail: martin.walter@med.uni-jena.de
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das schnell wirksame Antidepressivum (S-)Ketamin wird bei therapieresistenten Patient:innen effektiv eingesetzt. Als zentrale Komponente eines biphasischen Wirkmechanismus wird für subanästhetische Dosen ein Neuroplastizitätsfenster vermutet, das psychotherapeutisch genutzt werden sollte, um rasche Symptomlinderung in anhaltende Response zu überführen.
Keypoints
-
Ketamin ist neben seiner etablierten anästhesiologischen Anwendung ein schnell wirksames Antidepressivum: Klinische Effekte setzen binnen Stunden ein, selbst bei therapieresistenten Patient:innen.
-
Etwa 24 Stunden nach Anwendung erzeugt Ketamin ein Neuroplastizitätsfenster, das psychotherapeutische Interventionen effektiver machen kann.
-
Für die Empfehlung spezifischer Ketamin-augmentierter Therapieverfahren fehlt bisher die Evidenz, weshalb repräsentative randomisierte, kontrollierte Studien notwendig sind.
Etwa dreißig Prozent aller depressiven Patient:innen erfüllen im Laufe ihrer Behandlung die Kriterien einer sogenannten therapieresistenten Depression (TRD), da sie auch nach zwei Therapieversuchen mit unterschiedlichen, adäquat (auf-)dosierten Antidepressiva verschiedener Wirkstoffklassen nicht remittieren.1 Neben der Augmentation mit Antipsychotika, Lithium oder der Kombination mit einem zweiten Antidepressivum kann hier in Übereinstimmung mit aktuellen Leitlinien (S-)Ketamin als Therapieoption erwogen werden.2
Ketamin: alte Substanz, neue Anwendungsgebiete
Damit ist das S-Enantiomer des NMDA-Rezeptorantagonisten Ketamin mehr als fünfzig Jahre nach dessen erstmaliger Zulassung als Anästhetikum und mehr als zwanzig Jahre nach der Entdeckung seiner antidepressiven Potenz mit der Folge eines zunehmenden Off-Label-Einsatzes seit etwa fünf Jahren offizieller Bestandteil der psychiatrischen Pharmakotherapie. Während für seine anästhetische Wirkung hohe Dosen notwendig sind, die eine Kombination mit einem Hypnotikum notwendig machen können, reichen für die antidepressive Behandlung subanästhetische Wirkstoffmengen aus, was das Nebenwirkungsprofil deutlich begünstigt. Im psychiatrischen Kontext birgt Ketamin überdies den Vorteil, dass es auch bei anderweitig therapieresistenten Patient:innen vergleichsweise hohe Ansprechraten zeigt – konventionelle Antidepressiva hingegen sind dafür bekannt, dass mit jeder Medikationsumstellung die Responserate sinkt.
Biphasisches Wirkmodell mit Neuroplastizitätsfenster
Der wohl größte Nutzen für die Behandlung der Depression liegt in der geringen Wirklatenz von Ketamin, weshalb es zur Klasse der schnell wirksamen Antidepressiva gehört. Damit unterscheidet es sich maßgeblich von monoaminergen Antidepressiva, deren Wirkung erst mit einer Latenz von Wochen einsetzt, obwohl sie unmittelbar zu biologisch erhöhten Serotonin-, Noradrenalin- bzw. Dopaminspiegeln führen. Das wiederum wirft Fragen bezüglich des exakten Wirkmechanismus konventioneller Antidepressiva auf und brachte zuletzt die Serotoninhypothese der Depression ins Wanken. Kritisch ist jedoch, dass bei allen bislang zugelassenen Antidepressiva ein anhaltender Plasmaspiegel der Substanz oder des aktiven Metaboliten verlangt wird.
Die Wirkweise von Ketamin hingegen unterscheidet sich fundamental von monoaminergen Therapeutika: Ketamin wirkt schnell, typischerweise zwei bis 24 Stunden nach Verabreichung – jedoch erst dann mit maximaler Effektstärke, wenn aufgrund der raschen Elimination kein aktiver Wirkspiegel mehr zu erwarten ist. Hintergrund dafür ist, dass eine Verabreichung meist nur über Minuten (Nasenspray) bis maximal eine Stunde (Infusion) durchgeführt wird und aufgrund der kurzen Halbwertszeit von ca. 180 Minuten sowie einer raschen Umverteilung die akute Wirkung meist auf diese Zeiträume beschränkt ist.
Diese Diskrepanz zwischen maximalem Wirkstoffspiegel und maximalem Wirkstoffeffekt lässt sich dadurch erklären, dass Ketamin akut allosterisch NMDA-Rezeptoren (NMDAR) – durch deren tonische Aktivität vermutlich bevorzugt an inhibitorischen Interneuronen – blockiert und so zu einer Disinhibition glutamaterger Synapsen mit nachfolgender AMPA-Rezeptoraktivierung führt. (S-)Ketamin hat dabei eine etwa viermal höhere Affinität zum NMDAR als das R-Enantiomer.3 Neben einer grundlegend erhöhten synaptischen Transmission löst dies die vermehrte Sekretion des Nervenwachstumsfaktors brain-derived neurotrophic factor (BDNF) aus, der durch Binden der Tropomyosinrezeptorkinase B (TrkB) zahlreiche Neuroplastizitätsvorgänge auslöst, die noch nach Elimination wirken. Dadurch erzielt Ketamin nicht nur eine akute Reorganisation der funktionellen Konnektivität, sondern durch Stärkung bestehender und Aussprossung neuer Synapsen auch neuroprotektive bzw. neuroplastische Effekte, die über die Halbwertszeit des Medikaments hinaus anhalten.4
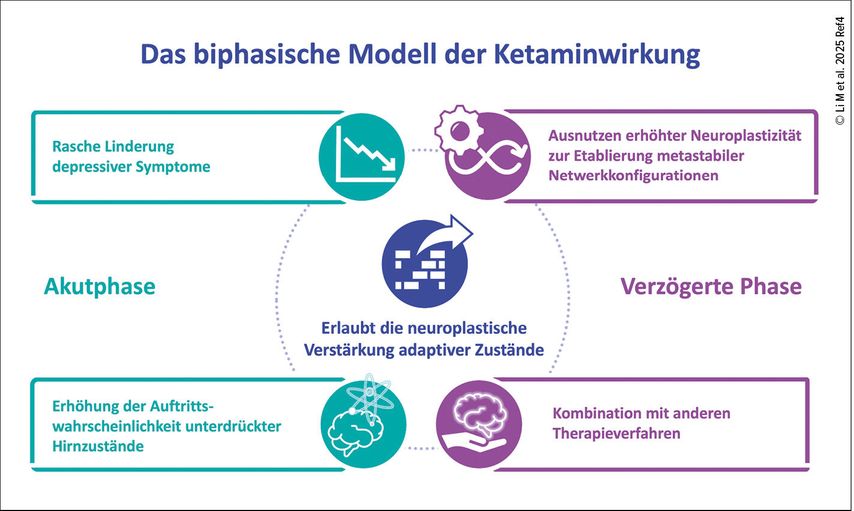
Abb. 1: Das biphasische Wirkmodell dient dazu, sowohl die akuten als auch die anhaltenden positiven Effekte in der Behandlung der TRD zu erklären (Li M et al. 2025)4
Mittels präklinischer Tiermodelle konnte eine zeitabhängige Entwicklung der antidepressiven Ketaminwirkung vermutet und durch zahlreiche Studien am Menschen bestätigt werden: Die Symptomlinderung setzt innerhalb weniger Stunden ein und folgt zeitlich auf die zentral erhöhte glutamaterge Neurotransmission. Dabei werden vorübergehend dysfunktionale Netzwerkverbindungen unterbrochen – etwa die mit depressiven Symptomen assoziierte Hyperkonnektivität im sog. „default mode network“5 –, während sich zugleich die Auftrittswahrscheinlichkeit unterdrückter Hirnzustände erhöht. Diese Akutphase öffnet etwa 24 Stunden nach Ketaminadministration ein (Zeit-)Fenster der Neuroplastizität, in dem die metastabilen Netzwerkkonfigurationen die Bildung alternativer Denk- und Verhaltensweisen ermöglichen. Zu diesem Zeitpunkt ist die Symptomlinderung am stärksten und ein vorübergehend erhöhter glutamaterger Metabolismus korreliert mit der gesteigerten Konzentration von Plastizitätsmarkern.6 In der Spät- oder zeitverzögerten Phase, die insgesamt ein bis drei Tage nach Anwendung anhält, können die zuvor unterdrückten adaptiven neuronalen Muster nach einer initialen Verstärkung stabilisiert werden, wobei Patient:innen noch immer von gesteigerter Plastizität profitieren, potenzielle Nebenwirkungen jedoch abgeklungen sind.7
Therapeutische Implikationen des Neuroplastizitätsfensters
Obwohl die antidepressiven Effekte von Ketamin auch nach dessen vollständiger Elimination noch anhalten, ist eine einmalige Applikation oft nicht ausreichend, weshalb serielle Infusionen bzw. intranasale Anwendungen indiziert sind, um die therapeutische Wirkung zu verlängern. Diese Erhaltungstherapien, die in der Regel zwei Verabreichungen pro Woche über einen Zeitraum von drei oder mehr Wochen vorsehen, können die Symptomlinderung auf bis zu 45 Tage verlängern.8 Dennoch wird eine langfristige Ketaminbehandlung auch ohne bislang belegte Risiken wie Toleranzentwicklung sowie Abhängigkeits- und Missbrauchspotenzial derzeit als unzweckmäßig erachtet. Die Kombination von Ketamin mit anderen Behandlungsverfahren – insbesondere mit Psychotherapie, welche eine langfristige Veränderung dysfunktionaler Interaktionsmuster zum Ziel hat – sind daher Gegenstand intensiver Forschung. Neben erhöhter Sicherheit können sie das Neuroplastizitätsfenster nutzen, um maladaptive Verarbeitungs- und Verhaltensmuster im therapeutischen Setting gezielt zu adressieren. Vereinfacht ausgedrückt: Innerhalb eines bestimmten Zeitfensters erhöht Ketamin die Lernfähigkeit, die für die Wirksamkeit psychotherapeutischer Interventionen ohnehin von essenzieller Bedeutung ist. Zusätzlich wirkt eine frühe Symptomlinderung kognitiven Beeinträchtigungen entgegen, die bei der Depression bis hin zum klinischen Bild der Pseudodemenz reichen und die Aufnahme einer gut wirksamen Psychotherapie verhindern können.
Durch die rasche Aufhebung starrer neuronaler Muster und die Förderung eines flexibleren, anpassungsfähigeren Hirnzustands schafft Ketamin ein Umfeld, in dem Behandlungsmethoden wie Psychotherapie und andere Verhaltensinterventionen, aber auch beispielsweise Neurofeedback zu nachhaltigeren Effekten führen können als die pharmakologische Monotherapie.
Der Begriff der Augmentation beschreibt die Erweiterung einer etablierten Therapie um ein zusätzliches, eigenständig wirksames Verfahren mit dem Ziel, einen additiven Effekt zu erzeugen. Damit auch die Psychotherapie im ursprünglich entwickelten Rahmen durchgeführt werden kann, setzt eine Ketamin-augmentierte Psychotherapie – anders als etwa sog. „Ketamin-assistierte“ Verfahren – eine unbeeinträchtigte Bewusstseinsfunktion voraus. Dies ist üblicherweise bereits einige Stunden nach Ketaminverabreichung der Fall. Aufgrund bekannter negativer Auswirkungen von NMDA-Rezeptor-blockierenden Substanzen auf die Gedächtniskonsolidierung im Schlaf wird jedoch meist eine Durchführung der Psychotherapie am Folgetag realisiert.
Demgegenüber versuchen die zuvor erwähnten „Ketamin-assistierten“ Verfahren explizit die vorübergehenden bewusstseinsverändernden Effekte während der Verabreichung therapeutisch zu nutzen. Hierzu wird in der Regel mittels verlängerter Infusionsschemata eine ausgedehnte Akutphase induziert, in der dann je nach Schweregrad der kognitiven Beeinträchtigung unterschiedliche Interventionen erfolgen, die für sich betrachtet jedoch keine zugelassene Psychotherapieform darstellen. Entsprechend kann nur bei einer zeitlich verzögerten Kombination mit einem etablierten Psychotherapieverfahren von einer Augmentation im engeren Sinne gesprochen werden. Die zwei Formen der initialen Verabreichung (per infusionem oder intranasal) sind hierbei vergleichbar. Klinisch relevant ist jedoch, dass gegenwärtig nur die intranasale Applikation zugelassen und erstattungsfähig ist.
Trotz der bereits bestehenden Zulassung muss das ideale Ketamin-augmentierte Therapieregime im Rahmen randomisierter, kontrollierter Studien mit möglichst großen, repräsentativen Probandengruppen noch identifiziert und evidenzbasiert begründet werden. Das „Cognitive Behavioral Analysis System of Psychotherapy“ (CBASP) als speziell für die Behandlung chronischer Depressionen entwickeltes Therapiekonzept wird derzeit als Option vor allem für diese Patient:innengruppe evaluiert. Die psychiatrischen Abteilungen der Universitätskliniken Jena, Tübingen, Berlin (Charité) und München (LMU) führen dazu aktuell eine multizentrische Studie durch. Dabei soll untersucht werden, ob eine Ketamin-augmentierte CBASP-Therapie zu einer stärkeren Symptomreduktion bei TRD-Patient:innen führt als eine CBASP-Placebo-Kombination oder die Ketamin-Augmentation etablierter Standardtherapien.
Gelingt es, das therapeutische Potenzial des Neuroplastizitätsfensters gezielt auszunutzen, könnte die Ketamin-augmentierte Psychotherapie langfristig dazu beitragen, die Wirksamkeit und Sicherheit bestehender Behandlungsansätze zu erhöhen und so die Häufigkeit therapieresistenter Verläufe zu reduzieren. Auch würde ein schnelleres Ansprechen auf die grundsätzlich gut wirksame Psychotherapie einen besseren Nutzen aus deren sehr begrenzter Verfügbarkeit ziehen. Das würde die Anwendbarkeit besonders in speziellen stationären Therapiesettings optimieren.
Literatur:
1 McIntyre RS et al.: Treatment-resistant depression: definition, prevalence, detection, management, and investigational interventions. World Psychiatry 2023; 22: 394-412 2 Bundesärztekammer (BÄK) et al.: Nationale VersorgungsLeitlinie Unipolare Depression – Langfassung, Version 3.2. 2022, zuletzt aufgerufen am 28.10.2025, doi: 10.6101/AZQ/000505 3 Zanos P, Gould TD: Mechanisms of ketamine action as an antidepressant. Mol Psychiatry 2018; 23(4): 801-11 4 Li M et al.: Dynamic processes induced by Ketamine and their potential for augmented treatment strategies in neuropsychiatric disorders. In: Himmelseher S.: Ketamine. Neuromethods, vol 224. Humana, New York, NY 2025, 297-232 5 Greicius MD et al.: Resting-state functional connectivity in major depression: abnormally increased contributions from subgenual cingulate cortex and thalamus. Biol Psychiatry 2007; 62(5): 429-37 6 Marx L et al.: Association between S-ketamine induced changes in glutamate levels in the pregenual anterior cingulate cortex and plasma brain-derived neurotrophic factor in healthy subjects. Front Psychiatry, Sec Mood Disorders 2025; 16: 1662051 7 Walter M et al.: Multistage drug effects of ketamine in the treatment of major depression. Eur Arch Psychiatry Clin Neurosci 2014; 264(Suppl 1): S55-S65 8 Aan het Rot M et al.: Safety and efficacy of repeated-dose intravenous ketamine for treatment-resistant depression. Biol Psychiatry 2010; 67(2): 139-45
Das könnte Sie auch interessieren:
Therapeutisches Drug-Monitoring (TDM) in der Neuropsychopharmakologie: von der Theorie zur klinischen Routine
Therapeutisches Drug-Monitoring (TDM) verbindet angewandte Pharmakokinetik mit der klinischen Praxis und stellt damit ein wertvolles Instrument der Präzisionsmedizin dar. Absorption, ...
Wie die Schwangerschaft Gehirn und Psyche beeinflusst
Eine Schwangerschaft verändert nicht nur den Körper, sondern auch das Gehirn und die Psyche einer Frau tiefgreifend. Diese Veränderungen markieren den Beginn einer eigenständigen ...
Blut-Hirn-Schranke im Fokus: neue Evidenz für ihre Durchlässigkeit bei Schizophrenie-Spektrum-Störungen
Die Blut-Hirn-Schranke (BHS) steht zunehmend im Zentrum der Forschung zu Schizophrenie-Spektrum-Störungen („schizophrenia spectrum disorders“, SSD).Eine aktuelle Studie der LMU München ...