Blut-Hirn-Schranke im Fokus: neue Evidenz für ihre Durchlässigkeit bei Schizophrenie-Spektrum-Störungen
Autorin:
Dr. med. Joanna Moussiopoulou
Fachärztin und Arbeitsgruppenleiterin
Klinik für Psychiatrie und Psychotherapie, LMU München
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Blut-Hirn-Schranke (BHS) steht zunehmend im Zentrum der Forschung zu Schizophrenie-Spektrum-Störungen („schizophrenia spectrum disorders“, SSD).Eine aktuelle Studie der LMU München unter Verwendung von kontrastmittelverstärkter Magnetresonanztomografie liefert erstmals robuste Belege für eine Störung der BHS in zahlreichen Hirnarealen bei diesen Erkrankungen – und rückt damit eine bislang unzureichend untersuchte pathophysiologische Komponente in den Blick.
Keypoints
-
Die dynamische kontrastmittelverstärkte MRT (DCE-MRI) zeigt erstmals eine signifikant erhöhte Durchlässigkeit der Blut-Hirn-Schranke (BHS) in mehreren Hirnarealen bei SSD – darunter Hippocampus, Amygdala, Thalamus und Hirnstamm – im Vergleich zu gesunden Kontrollen.
-
Die Unterscheidung zwischen Blut-Hirn-Schranke und Blut-Liquor-Schranke (BCSFB) ist zentral: Liquorbasierte Marker wie der Albuminquotient (QAlb) spiegeln primär die BCSFB wider, während DCE-MRT eine spezifische, räumlich aufgelöste Darstellung von BHS-Leckagen ermöglicht.
-
Weitere groß angelegte, multimodale und longitudinale Studien sind erforderlich, um die zugrunde liegenden neurobiologischen Mechanismen und ihre klinischen Korrelate besser zu verstehen.
-
DCE-MRT erweist sich als hochsensitives Verfahren zur Detektion subtiler BHS-Störungen bei SSD und könnte künftig im Rahmen einer individualisierten Präzisionspsychiatrie diagnostisch und pathophysiologisch relevant werden.
Eine alte Schranke mit neuer Bedeutung
Die Blut-Hirn-Schranke (BHS) ist eine hochselektive, semipermeable Barriere des zentralen Nervensystems, die den Stoffaustausch zwischen Gehirn und peripherem Kreislauf präzise reguliert. Als zentrale Schnittstelle zwischen Peripherie und Gehirn ist ihre Integrität entscheidend für die Aufrechterhaltung der neuronalen Homöostase.1 Immer mehr Hinweise deuten darauf hin, dass eine gestörte BHS zur Entstehung und Aufrechterhaltung neuropsychiatrischer Erkrankungen beiträgt – bei der Alzheimerdemenz wurde eine gestörte BHS sogar als früher Biomarker für kognitive Dysfunktion vorgeschlagen.2,3 Auch im Rahmen von Schizophrenie-Spektrum-Störungen („Schizophrenia spectrum disorders“, SSD) wächst das wissenschaftliche Interesse hinsichtlich der BHS.
Die bisherigen Studien verwendeten vorrangig indirekte, periphere Marker aus Blut und Liquor wie den Albuminquotienten (Liquor/Serum, QAlb) oder das Protein S100B als indirekte Parameter für BHS-Störungen. Diese sind jedoch durch beträchtliche Limitationen gekennzeichnet, insbesondere durch die geringe Spezifität für eine gestörte BHS.1,4 Die dynamische kontrastmittelverstärkte Magnetresonanztomografie („dynamic contrast-enhanced magnetic resonance imaging“, DCE-MRI) ist ein minimalinvasives Verfahren zur spezifischen Erfassung von BHS-Störungen mit hoher räumlicher und zeitlicher Auflösung.5 Durch pharmakokinetische Modellierung lassen sich subtile Permeabilitätsänderungen quantifizieren und lokalisieren.6,7
Studienaufbau und Methode
In der Studie wurden zwischen 2022 und 2023 45 Menschen mit SSD (Diagnosevalidierung mittels Mini International Neuropsychiatric Interview, M.I.N.I.)8 im Alter zwischen 18 und 60 Jahren sowie 42 alters- und geschlechtsangepasste gesunde Kontrollen am LMU Klinikum München untersucht.9 Nach Ausschluss unvollständiger Datensätze flossen 81 Teilnehmende in die finale Analyse ein.
Die Bildgebung erfolgte mittels 3-Tesla-DCE-MRT (3T Magnetom Prisma, Siemens Healthcare GmbH, Scanzeit etwa 23 Minuten). Während der DCE-MRT Sequenz wurde das gadoliniumhaltige Kontrastmittel (Gadobutrol, Gadovist®, 0,1mmol/kg) venös injiziert. Über pharmakokinetische Modellierung (Patlak-Modell)10 wurden Ktrans-Werte – ein Maß für die Durchlässigkeit der BHS – berechnet. Zusätzlich wurden Entzündungsparameter aus dem Blut (Neutrophilen-Lymphozyten-Ratio, NLR; Monozyten-Lymphozyten-Ratio, MLR),11 kognitive Testung („Trail makingTest“ A/B, TMT),12 klinische Variablen (Positive And Negative Syndrome Scale, PANSS,13 Global Assessment of Functioning, GAF)14 sowie – soweit vorhanden aufgrund klinischer Indikation – Liquorparameter (QAlb) erhoben, um klinische und neurobiologische Zusammenhänge mit der BHS-Permeabilität zu untersuchen.
Erhöhte BHS-Permeabilität bei SSD
Der Gruppenvergleich ergab signifikant höhere Ktrans-Werte in der SSD-Gruppe im Vergleich zu den Kontrollen, nach Korrektur für Kovariablen wie Alter, Geschlecht, BMI, Bildung und Raucherstatus.
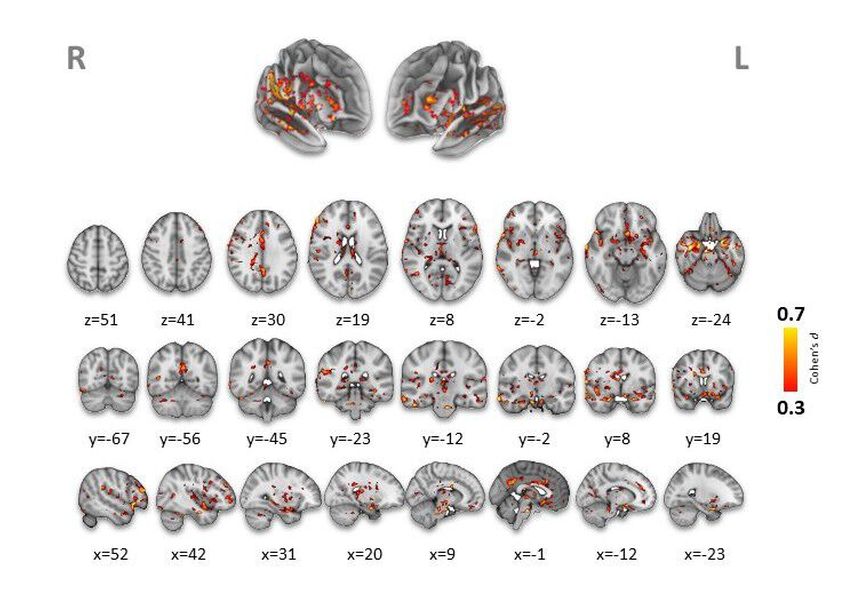
Am deutlichsten zeigte sich der Effekt im Thalamus, in der Amygdala, dem Hippocampus, dem Putamen, dem Cingulum, der Inselrinde sowie in frontalen und temporalen Kortexarealen – Regionen, die bereits in früheren SSD-Studien als zentral für strukturelle und funktionelle Veränderungen beschrieben wurden.15 Damit bestätigt die LMU-Studie die bislang einzige DCE-MRT-Studie an Menschen mit SSD von Cheng et al., die 2019 erhöhte Thalamus-Leckagen bei 29 Patient:innen beschrieb – und erweitert die Befunde auf zusätzliche Regionen möglicherweise dank größerer Stichprobe und längerer Scanzeit.
Was bedeuten diese Leckagen?
Die Ergebnisse stützen die Hypothese, dass neurovaskuläre Dysfunktionen ein zentrales Element der Pathophysiologie von SSD darstellen. Eine gestörte BHS kann eine Komponente einer neuroinflammatorischen Kaskade darstellen. Menschen mit SSD zeigen Hinweise sowohl auf periphere als auch zentralnervöse Entzündungsprozesse.16 Zunehmende Evidenz belegt einen Zusammenhang zwischen systemischer Inflammation und erhöhter BHS-Permeabilität17 sowie eine nachfolgende Aktivierung von Mikroglia und Astrozyten – integraler Bestandteil der BHS –, die über proinflammatorische Zytokine neurotoxische Prozesse auslösen können.18 Solche Prozesse werden zunehmend als gemeinsamer Nenner zwischen neurodegenerativen und psychiatrischen Erkrankungen diskutiert.
Bisher kein Zusammenhangmit Symptomen oder Entzündung
Trotz klarer Gruppenunterschiede zeigte sich keine Korrelation zwischen der gemessenen BHS-Leckage und klinischer Symptomatik (PANSS), kognitiver Leistung (TMT) oder systemischen Entzündungsmarkern (NLR, MLR). Auch zum Liquormarker QAlb bestand kein Zusammenhang. Mögliche Erklärungen liegen in methodischen Aspekten wie begrenzter Stichprobengröße, Querschnittsdesign und der hohen klinischen Heterogenität des Krankheitsbildes.
Limitationen und Ausblick
Bei der Interpretation der Ergebnisse sind mehrere Einschränkungen zu beachten. Die Kohorte umfasste keine medikamentennaiven Patient:innen, sodass mögliche Effekte antipsychotischer Therapie auf die BHS unklar bleiben. Dennoch stellt diese Arbeit die bislang größte DCE-MRT-Studie bei SSD dar und liefert eine solide methodische Grundlage für zukünftige, idealerweise längsschnittliche und multimodale Untersuchungen. Diese könnten klären, ob die beobachteten BHS-Veränderungen Ursache, Folge oder Begleitphänomene der Erkrankung sind – und ob sie als potenzieller Biomarker zur Differenzierung von Subtypen oder Krankheitsverläufen innerhalb dieser heterogenen Störungsgruppe geeignet sind.
Abb. 1: Der Vergleich der BHS-Permeabilität (Ktrans) zwischen den beiden Kohorten zeigt eine deutlich erhöhte, weitverbreitete Leckage bei Personen mit SSD im Vergleich zu gesunden Kontrollen. Die farbigen Signale markieren Hirnvoxels, in denen in der SSD-Gruppe eine statistisch signifikant höhere Durchlässigkeit (statistische Schwelle: voxelweise p<0,001; FWE-Cluster-korrigiert p<0,05, hier Cohen’s d zwischen 0,3 und 0,7) nachgewiesen wurde. Die Volumenbilder sind in axialer (z), koronaler (y) und sagittaler (x) Orientierung mit den standardisierten MNI-Koordinaten gezeigt. Hinweis: radiologische Konvention, L = R und R = L
Aufbauend auf den vorliegenden Querschnittsbefunden wird das Projekt im Rahmen der CDP-STAR-Studie19 als eigenständiges Modul prospektiv und longitudinal mit drei Messzeitpunkten (Baseline sowie zwei Follow-ups) fortgeführt und um eine tiefe multimodale Phänotypisierung erweitert. Neben einer umfassenden klinischen Charakterisierung umfasst das Design multimodale MRT-Modalitäten (einschließlich DCE-MRT), EEG, retinales Imaging sowie Blut- und Liquor-basierte Multi-omics-Analysen. Ziel ist die Validierung potenzieller Biomarkerkandidaten, die Erfassung individueller Trajektorien (z.B. Therapieansprechen, Rückfallrisiko) und die Aufklärung neurovaskulärer Mechanismen als Grundlage für präzisionspsychiatrische Stratifikations- und Interventionsansätze bei SSD.
Fazit
Die Ergebnisse deuten darauf hin, dass die Blut-Hirn-Schranke bei Schizophrenie-Spektrum-Störungen bei einem Teil der Betroffenen nicht vollständig intakt ist, sondern in mehreren zentralen Hirnregionen eine erhöhte Permeabilität aufweisen kann. Die DCE-MRT erweist sich als vielversprechendes Verfahren, um diese subtilen Veränderungen abzubilden. Langfristig könnte das Verständnis der neurovaskulären Mechanismen neue diagnostische und therapeutische Wege eröffnen – mit dem Ziel, die BHS als Zielstruktur neuropsychiatrischer Interventionen zu etablieren.
Literatur:
1 Pollak TA et al.: The blood-brain barrier in psychosis. Lancet Psychiatry 2018; 5(1): 79-92 2 Barisano G et al.: Blood-brain barrier link to human cognitive impairment and Alzheimer‘s disease. Nat Cardiovasc Res 2022; 1(2): 108-15 3 Nation DA et al.: Blood-brain barrier breakdown is an early biomarker of human cognitive dysfunction. Nat Med 2019; 25(2): 270-6 4 Steiner J et al.: S100B serum levels are closely correlated with body mass index: an important caveat in neuropsychiatric research. Psychoneuroendocrinology 2010; 35(2): 321-4 5 Montagne A et al.: Blood-brain barrier breakdown in the aging human hippocampus. Neuron 2015; 85(2): 296-302 6 Cramer SP, Larsson HB: Accurate determination of blood-brain barrier permeability using dynamic contrast-enhanced T1-weighted MRI: a simulation and in vivo study on healthy subjects and multiple sclerosis patients. J Cereb Blood Flow Metab 2014; 34(10): 1655-65 7 Heye AK et al.: Tracer kinetic modelling for DCE-MRI quantification of subtle blood-brain barrier permeability. Neuroimage 2016; 125: 446-55 8 Sheehan DV et al.: The Mini-International Neuropsychiatric Interview (M.I.N.I.): the development and validation of a structured diagnostic psychiatric interview for DSM-IV and ICD-10. J Clin Psychiatry 1998; 59 Suppl 20: 22-33; quiz 34-57 9 Moussiopoulou J et al.: Higher blood-brain barrier leakage in schizophrenia-spectrum disorders: A comparative dynamic contrast-enhanced magnetic resonance imaging study with healthy controls. Brain Behav Immun 2025; 128: 256-65 10 Patlak CS et al.: Graphical evaluation of blood-to-brain transfer constants from multiple-time uptake data. J Cereb Blood Flow Metab 1983; 3(1): 1-7 11 Ghobadi H et al.: Role of leukocytes and systemic inflammation indexes (NLR, PLR, MLP, dNLR, NLPR, AISI, SIR-I, and SII) on admission predicts in-hospital mortality in non-elderly and elderly COVID-19 patients. Front Med (Lausanne) 2022; 9: 916453 12 Salthouse TA: What cognitive abilities are involved in trail-making performance? Intelligence 2011; 39(4): 222-32 13 Kay SR et al.: The positive and negative syndrome scale (PANSS) for schizophrenia. Schizophr Bull 1987; 13(2): 261-76 14 Suzuki T et al.: Relationships between global assessment of functioning and other rating scales in clinical trials for schizophrenia. Psychiatry Res 2015; 227(2-3): 265-9 15 van Erp TG et al.: Subcortical brain volume abnormalities in 2028 individuals with schizophrenia and 2540 healthy controls via the ENIGMA consortium. Mol Psychiatry 2016; 21(4): 547-53 16 Khandaker GM et al.: Inflammation and immunity in schizophrenia: implications for pathophysiology and treatment. Lancet Psychiatry 2015; 2(3): 258-70 17 Galea I: The blood-brain barrier in systemic infection and inflammation. Cell Mol Immunol 2021; 18(11): 2489-501 18 Takata F et al.: Blood-brain barrier dysfunction amplifies the development of neuroinflammation: understanding of cellular events in brain microvascular endothelial cells for prevention and treatment of BBB dysfunction. Front Cell Neurosci 2021; 15: 661838 19 Yakimov V et al.: Clinical deep phenotyping of treatment response in schizophrenia (CDP-STAR): design and methodology of a prospective multimodal observational study. Eur Arch Psychiatry Clin Neurosci 2025, Online ahead of print. doi: 10.1007/s00406-025-02100-1
Das könnte Sie auch interessieren:
Therapeutisches Drug-Monitoring (TDM) in der Neuropsychopharmakologie: von der Theorie zur klinischen Routine
Therapeutisches Drug-Monitoring (TDM) verbindet angewandte Pharmakokinetik mit der klinischen Praxis und stellt damit ein wertvolles Instrument der Präzisionsmedizin dar. Absorption, ...
Wie die Schwangerschaft Gehirn und Psyche beeinflusst
Eine Schwangerschaft verändert nicht nur den Körper, sondern auch das Gehirn und die Psyche einer Frau tiefgreifend. Diese Veränderungen markieren den Beginn einer eigenständigen ...
Ketamin-augmentierte Psychotherapie
Das schnell wirksame Antidepressivum (S-)Ketamin wird bei therapieresistenten Patient:innen effektiv eingesetzt. Als zentrale Komponente eines biphasischen Wirkmechanismus wird für ...