Zytopenien als Nebenwirkung von Immuncheckpoint-Inhibitoren
Autor:
Prof. Heinz Läubli, MD, PhD
Medizinische Onkologie, Universitätsspital BaselLabor für Immuntherapie,
Department Biomedizin,
Universität Basel
E-Mail: heinz.laeubli@unibas.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Blockierung der Immuncheckpoints PD-1/PD-L1 und CTLA-4 haben die Prognose von vielen unserer Patienten verbessert. Immuntherapie mit Checkpoint-Blockade (ICB) führt bei einem Teil der Patienten trotz fortgeschrittener, teils metastasierter Erkrankung zu langfristigem Ansprechen. Insbesondere die Kombination von CTLA-4- und PD-1-Blockade ist sehr vielversprechend. Mit dieser neuen Therapieform sind aber auch neue Nebenwirkungen aufgetreten.
Keypoints
-
Immuncheckpoint-Inhibitoren verursachen vorwiegend immunvermittelte Nebenwirkungen(irAE). Im Prinzip können alle Organe betroffen sein.
-
Relevante hämatologische Nebenwirkungen (haem-irAE) kommen selten vor (<1% der Patienten), können aber schwerwiegende Folgen für die Patienten haben.
-
Das Erkennen von haem-irAE und deren spezifische Behandlung sind wichtig und ermöglichen in vielen Fällen eine Erholung.
-
Die Behandlung orientiert sich an der Art der Nebenwirkung und unterscheidet sich nicht von der Behandlung von hämatologischen Erkrankungen ohne Immuncheckpoint-Inhibitor-Vorbehandlung.
Die häufigsten immunvermittelten Nebenwirkungen («immune-related adverse events», irAE) betreffen die Grenzflächen Haut und Darm sowie die endokrinen Drüsen. Generell kann aber jedes Organ betroffen sein. Hämatologische Nebenwirkungen aufgrund von Immuncheckpoint-Inhibitorensind relativ seltene Nebenwirkungen, können aber für die Patienten schwere Folgen haben. Der Text fasst die häufigen haem-irAE zusammen und gibt eine Anleitung zu ihrer Diagnostik und Behandlung.
Immunvermittelte Nebenwirkungen unter Immuncheckpoint-Inhibitoren
Immuncheckpoint-Blockade (ICB) mit blockierenden Antikörpern gegen PD-1/PD-L1 oder in Kombination mit CTLA-4 kann bei Patienten mit Tumorerkrankungen sogar im metastasierten Setting langfristige Remissionen induzieren.1–3 Durch die Aktivierung des Immunsystems kommt es jedoch auch immer wieder zu irAE, welche prinzipiell alle Organe betreffen können.4,5 Mechanistisch können hier Antigene, die im Tumor und im entzündeten Organ vorkommen, die Entwicklung von Autoantikörpern sowie die Freisetzung von Zytokinen eine Rolle spielen.4,6 Am häufigsten sind die Grenzflächen, welche immunologisch auch mit Mikroorganismen zurechtkommen müssen, betroffen. Die Haut und auch der Darm machen somit oft Probleme.5 Endokrine Drüsensind zudem auch häufig betroffen. Seltenere, aber z.T. ausserordentlich gefährliche Nebenwirkungen betreffen die Lunge, die Leber, aber auch das Nervensystem. Hämatologische Nebenwirkungen, welche mit Zytopenien auffallen, sind relativ selten, müssen aber den behandelnden Ärzten bekannt und geläufig sein.
Häufigkeit und Arten von Zytopenien unter Immuncheckpoint-Inhibitoren
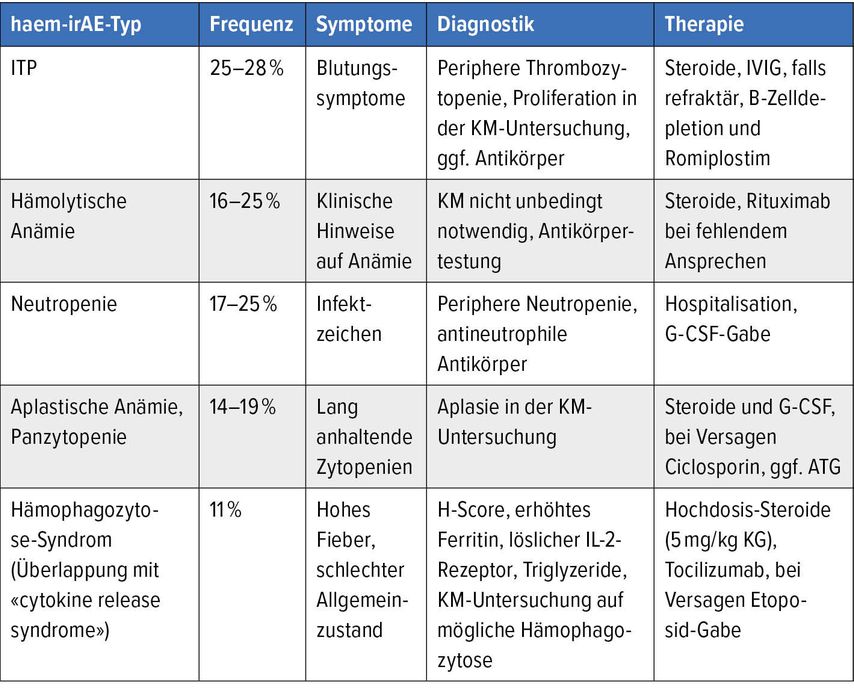
Relevante hämatologische immunvermittelte Nebenwirkungen (haem-irAE) treten je nach Studie und Art der Immuncheckpoint-Blockade (Monotherapie versus Kombinationstherapie) mit einer Rate zwischen 0,5% und 0,7% auf.7,8 In einer retrospektiven Analyse von Michot und Kollegen traten schwere haem-irAE in 0,7% der Fälle auf, zusammengenommen mit leichteren bei 3,6% der Fälle.8 In einer anderen Analyse wurde eine Frequenz von 0,5% schweren haem-irAE bei 948 Patienten aus drei unterschiedlichen Registern gefunden.7 Die häufigsten Nebenwirkungen sind Immunthrombozytopenien (ITP), hämolytische Anämien, aplastische Anämie oder auch Panzytopenie, Neutropenien und Hämophagozytose-Syndrom (Tab. 1).7,8 Der Zeitpunkt des Auftretens der haem-irAE lag bei den wenigen identifizierten Patienten innerhalb der ersten 3 Monate der Therapie, ausser bei Knochenmarksaplasien, welche eine deutlich längere Latenzzeit von mehreren Monaten Therapie zeigten.7,8 Am häufigsten sind Patienten mit nicht kleinzelligem Bronchuskarzinom (NSCLC) und Melanomen betroffen.
Diagnostik von haem-irAE
Die Diagnostik ist abhängig vom Typ der hämatologischen Nebenwirkung. Bei einem Abfall der Blutzellen, welche differenzialdiagnostisch nicht erklärlich sind (Infekt, massiver Tumorprogress etc.) soll eine Knochenmarkspunktion durchgeführt werden. Anti-Thrombozyten-Antikörper können bei Verdacht auf eine ITP gesucht werden. Bei einer Neutropenie können auch Anti-Neutrophilen-Antikörper positiv sein. In der Regel wird die Knochenmarksuntersuchung bei einer Verbrauchserkrankung (ITP, hämolytische Anämie) oder auch einer Aplasie aufschlussreich sein. Bei Verdacht auf ein Hämophagozytose-Syndrom kann der H-Score ausgerechnet werden.9 Ferritin, Triglyzeride und löslicher Interleukin-2-Rezeptor sind häufig erhöht. Eine typische Hämophagozytose kann teilweise in der Knochenmarksuntersuchung gefunden werden, muss aber für die Diagnosestellung nicht zwingend vorhanden sein.
Behandlung der haem-irAE
Die Behandlung von haem-irAE orientiert sich primär am Schweregrad und an der Art der hämatologischen Nebenwirkung. Primär sollte bei schweren haem-irAE die Immuntherapie mit ICB gestoppt oder pausiert werden. Da mechanistisch bei der ITP wie auch der hämolytischen Anämie Autoantikörper im Vordergrund stehen, sind B-Zell-gerichtete immuninhibitorische Massnahmen sinnvoll. In der Regel soll primär ein Versuch mit Steroiden durchgeführt werden. Bei der ITP sollen bei Vorkommen von Blutungszeichen auch intravenöse Immunglobuline dazugegeben werden (IVIG). Sollten die Massnahmen nicht reichen, kann zudem eine B-Zell-Depletion mit Rituximab durchgeführt werden. Bei der ITP kann auch eine Behandlung mit Romiplostim evaluiert werden. Sowohl bei der aplastischen Anämie/Panzytopenie wie auch bei der Neutropenie sollte neben dem Stopp des Immuntherapeutikums auch eine Hospitalisation zur Vermeidung von schweren Infektionen veranlasst werden. Bei der Neutropenie sollbis zur Rekonstitution täglich G-CSF verabreicht werden. Steroide sollten zur Vermeidung einer schweren Infektion nicht gegeben werden. Bei der aplastischen Anämie kann ein Versuch mit Kortikosteroiden gemacht werden, bei Panzytopenie kann G-CSF gegeben werden. Sollte kein Ansprechen zu sehen sein, kann ein Therapieversuch mit Ciclosporin und zusätzlich auch Romiplostim gemacht werden. Bei jüngeren, fitten Patienten kann auch ein Versuch mit Antithymozyten-Globulin unternommen werden. Patienten mit Verdacht auf Hämophagozytose-Syndrom sollen hospitalisiert werden, unter Umständen auch intensivmedizinisch. Hochdosis-Steroide und auch gegen Interleukin6 gerichtete Antikörper (Tocilizumab) sollen zur Anwendung kommen. Bei fehlendem Ansprechen kann eine einmalige Behandlung mit Etoposid durchgeführt werden.
Outcome bei haem-irAE
Das Outcome ist auch stark abhängig vom Typ der haem-irAE. Die ITP und auch die hämolytische Anämie haben in der Regel einen guten Ausgang und es ist mit einer Restitutio ad integrum zu rechnen.7,8 Hierbei kann je nach Schweregrad und Verlauf auch eine Wiederaufnahme der ICB überlegt werden. Ähnliches gilt bei der Neutropenie, welche häufig behandelbar und reversibel ist.7,8 Die aplastische Anämie oder auch die Panzytopenie bei Knochenmarksaplasie hingegen haben ein schlechtes Outcome und können zum Tode führen.7,8 Sollte eine Besserung unter der Therapie auftreten, darf die ICB nicht mehr begonnen werden. Gleiches gilt beim Hämophagozytose-Syndrom.Da es sich hierbeium eine schwierig behandelbare, lebensbedrohliche Komplikation handelt, soll in der Regel keine Reexposition mit Immuncheckpoint-Inhibitoren durchgeführt werden.
Generell kann gesagt werden, dass haem-irAE selten sind, jedoch schwere Verläufe auftreten können. Bei rascher Diagnosestellung und konsequenter Behandlung sind viele der Nebenwirkungen reversibel und oft kann die ICB weitergeführt werden. Offenbleibt die Frage, ob die Behandlungsalgorithmen gleich sein sollen wie bei Auftreten von hämatologischen Erkrankungen mit einem anderen Auslöser als einer Therapie mit Immuncheckpoint-Inhibitoren. Dass dazu Studien durchgeführt werden, isteher unwahrscheinlich, jedoch sollen «Real world»-Daten wenn möglich in Registern gesammelt werden, damit so die Erfahrungen der Allgemeinheit zur Verfügung stehen.
Literatur:
1 Larkin J et al.: Five-year survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med 2019; 381(16): 1535-46 2 Chen DS, Mellman I: Elements of cancer immunity and the cancer-immune set point. Nature 2017; 541(7637): 321-30 3 Wei SC et al.: Fundamental mechanisms of immune checkpoint blockade therapy. Cancer Discov 2018; 8(9): 1069-86 4 Konig D, Laubli H: Mechanisms of immune-related complications in cancer patients treated with immune checkpoint inhibitors. Pharmacology 2020: 1-14 5 Postow MA et al.: Immune-related adverse events associated with immune checkpoint blockade. N Engl J Med 2018; 378(2): 158-68 6 Young A et al.: The balancing act between cancer immunity and autoimmunity in response to immunotherapy. Cancer Immunol Res 2018; 6(12): 1445-52 7 Delanoy N et al.: Haematological immune-related adverse events induced by anti-PD-1 or anti-PD-L1 immunotherapy: a descriptive observational study. Lancet Haematol 2019; 6(1): e48-e57 8 Michot JM et al.: Haematological immune-related adverse events with immune checkpoint inhibitors, how to manage? Eur J Cancer 2019; 122: 72-90 9 Fardet L et al.: Development and validation of the HScore, a score for the diagnosis of reactive hemophagocytic syndrome. Arthritis Rheumatol 2014; 66(9): 2613-20
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...