Zielgerichtete Therapien beim Mammakarzinom
Autor:
Univ.-Prof. Dr. Christian Singer, MPH
Leiter Brustgesundheitszentrum
Medizinische Universität Wien
Klinische Abteilung für Gynäkologie und Gynäkologische Onkologie
Universitätsfrauenklinik Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Zielgerichtete Therapien werden inzwischen bei praktisch allen Tumorbiologien erfolgreich eingesetzt und ermöglichen gerade im fortgeschrittenen Stadium inzwischen klinisch relevante Überlebensvorteile. Der nachfolgende Artikel bietet einen Überblick über die aktuellsten Daten zu zielgerichteten Therapien bei Patientinnen mit Mammakarzinom.
Keypoints
-
Die Verlängerung des Gesamtüberlebens beim HR+/HER2– mBC durch Abemaciclib wurde bestätigt.
-
Mit Tucatinib und Trastuzumab Deruxtecan (T-DxD) stehen nun neue Therapieoptionen beim HER2+ Mammakarzinom zur Verfügung.
-
Die Langzeitprognose beim TNBC konnte durch Sacituzumab Govitecan und Immuncheckpoint-Inhibitoren verbessert werden.
Adjuvanter Einsatz des CDK4/6-Inhibitors Abemaciclib verlängert IDFS bei HR+/HER2– Brustkrebs
Die Kombination von Cyclin-abhängigen Kinase-4- und -6(CDK4/6)-Inhibitoren mit einer endokrinen Therapiestrategie hat sich mittlerweile als Goldstandard in der Erstlinien-Behandlung des HR+/HER2– (hormonrezeptorpositiven/„human epidermal growth factor receptor 2“-negativen) fortgeschrittenen Brustkrebses (mBC) etabliert. Die entsprechenden Zulassungsdaten beruhen bei prämenopausalen Patientinnen auf Daten der MONALEESA 7 (Phase-III-Studie, Ribociclib), bei postmenopausalen Patientinnen auf Daten der MONALEESA 2 und 3 (Ribociclib), der MONARCH-3-Studie (Abemaciclib) sowie auf Daten der PALOMA-2-Studie (Palbociclib). Jeder der dabei untersuchten CDK4/6-Inhibitoren konnte in Kombination mit einem Aromataseinhibitor (AI) bzw. Fulvestrant als endokrinem Backbone eine deutliche Verbesserung des progressionsfreien Überlebens (PFS) erzielen, im Falle von Abemaciclib und Ribociclib übersetzte sich der primäre Endpunkt sogar in einen deutlichen Vorteil im Gesamtüberleben (OS).
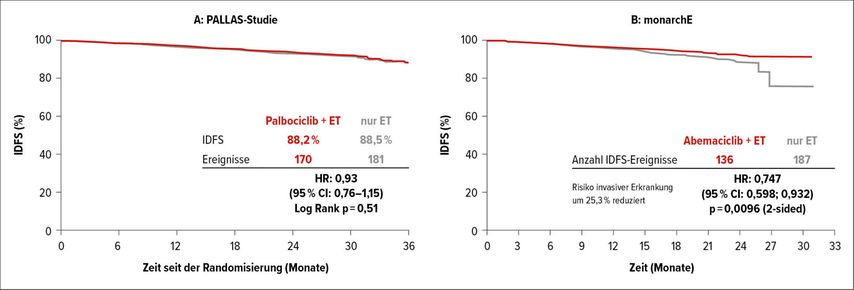
Es lag daher nahe, die Wirksamkeit dieser Substanzgruppe nun auch in der adjuvanten Therapie zu untersuchen. Die Ergebnisse von Phase-III-Studien für Palbociclib (PALLAS) sowie für Abemaciclib (monarchE) liegen inzwischen vor. Beide Studien wurden bei Frauen mit einem HR+/HER2– frühen Mammakarzinom mit hohem Rezidivrisiko durchgeführt und beim Kongress der Europäischen Gesellschaft für Medizinische Onkologie (ESMO) 2020 sowie als Update beim San Antonio Breast Cancer Symposium (SABCS) 2020 präsentiert: Trotz einer mehr oder weniger vergleichbaren Patientenpopulation konnte die PALLAS-Studie keinen zusätzlichen Nutzen durch eine zweijährige adjuvante Therapie mit Palbociclib aufzeigen (Abb. 1A).1
Im Gegensatz dazu lieferte die monarchE-Studie, bei der Patientinnen entweder zumindest 4 befallene axilläre Lymphknoten aufwiesen oder – im Falle von 1–3 befallenen Lymphknoten – die Tumoren zumindest eines der histopathologischen Charakteristika aufwiesen (Tumorgröße über 5cm, G3 oder Ki67>20%) ein positives Ergebnis: Durch eine 2-jährige Behandlung mit Abemaciclib zusätzlich zu einer endokrinen Therapie konnte die Rate an Lokalrezidiven um etwa 25% gesenkt werden (invasives krankheitsfreies 2-Jahres-Überleben [IDFS] 92,2 vs. 88,7%; Hazard-Ratio [HR]: 0,75; p=0,0096; Abb. 1B). Auch die Rate von Fernmetastasen („distant recurrence-free survival“ [DRFS]) konnte nach 2 Jahren um fast 30%gesenkt werden (93,6 vs. 90,3%; HR: 0,72; p=0,085). Wenngleich die Studie ein relativ kurzes Follow-up aufwies, so dürfte – wenn der günstige Effekt der Therapie auch nach einer längeren Nachbeobachtung anhält – der adjuvante Einsatz von Abemaciclib in nicht allzu weiter Ferne liegen.
Abb. 1: IDFS von Patientinnen mit HR+/HER2– mBC unter endokriner Therapie (ET) plus/minus Palbociclib in der PALLAS-Studie (A) sowie plus/minus Abemaciclib in monarchE (B). Modifiziert nach 9, 10
Auch die in monarchE mit über 80% (in allen Graden) besonders häufig auftretende Diarrhö schien die Therapie-Compliance nur mäßig zu beeinflussen und konnte mit der entsprechenden Supportivtherapie üblicherweise gut beherrscht werden.2
Tucatinib & Trastuzumab-Deruxtecan erweitern Therapieoptionen bei HER2+ mBC
Neben den bereits seit Längerem im Einsatz befindlichen Substanzen Trastuzumab, Pertuzumab und Trastuzumab-Emtansin (TDM-1) gibt es nun zwei neue Substanzen, die im Jahr 2021 in Europa zur Behandlung des HER2+ fortgeschrittenen Mammakarzinoms zum Einsatz zugelassen werden. Beide sind zwar nur in Phase-II-Studien untersucht worden, lassen jedoch aufgrund der zum Teil recht beeindruckenden Daten aufhorchen.
Der Tyrosinkinase-Inhibitor Tucatinib scheint insbesondere bei Metastasen des Zentralnervensystems von HER2+ Mammakarzinomen effektiv zu sein, wie eine Analyse der Ansprechraten von manifesten Hirnmetastasen von Patientinnen aus HER2CLIMB ergab: Im Vergleich zu einer Kombination von Trastuzumab und Capecitabin verlängerte sich das mediane ZNS-bezogene progressionsfreie Überleben (CNS-PFS) von Patientinnen, die zuvor bereits mit Trastuzumab, Pertuzumab und TDM-1 behandelt worden waren, von 4,2 Monaten auf immerhin 9,9 Monate (HR: 0,32; p<0,00001). Der Unterschied im OS betrug klinisch relevante 6,1 Monate (18,1 vs. 12 Monate; HR: 0,58; p=0,005), die Raten des objektiven intrakraniellen Ansprechens (IC-ORR) lagen bei 47,3 vs. 20% in der Vergleichsgruppe. Tucatinib ist daher die erste Substanz, die bei Patientinnen mit HER2+ Mammakarzinom mit Hirnmetastasen einen signifikanten Überlebensvorteil zu erzielen vermag.3
Auch das gegen HER2-gerichtete Antikörper-Zytostatikum-Konjugat Trastuzumab-Deruxtecan (T-Dxd), welches die Selektivität einer Antikörper-basierten Strategie mit der Effektivität eines an sich hochtoxischen Topoisomerase-Hemmers vereint, stellt eine wirksame Option bei bereits multipel vorbehandelten und therapierefraktären Patientinnen dar. T-DXd wurde in der einarmigen DESTINY-Breast01-Studie (Phase II) bei Frauen mit metastasiertem Mammakarzinom untersucht, die im Median bereits 6 Vortherapien (inkl. TDM-1) gehabt hatten. Die Substanz konnte dabei eine objektive Ansprechrate (ORR, primärer Endpunkt) von 60,9% erreichen, wobei 6% der Patienten eine komplette und 54,9% eine partielle Remission erleben durften. Während 36,4% der eingeschlossenen Patientinnen eine Krankheitsstabilisierung zeigten, waren lediglich 1,6% progredient. Eine Stabilisierung der Erkrankung über zumindest 6 Monate konnte bei 76,1% erzielt werden, mit einer medianen Ansprechdauer von 14,8 Monaten. Zum Zeitpunkt der primären Analyse wurden noch 43% der Patientinnen mit T-DXd behandelt. Die Therapie wurde insgesamt gut vertragen, allererdings kam es in 20,7% der Fälle zu Neutropenien und vereinzelt zu Pneumonitis-ähnlichen Lungenveränderungen, die zum Teil schwer verliefen und ein aggressives proaktives Vorgehen bei Pneumonitis-verdächtigen klinischen Symptomen notwendig machen.4
Sacituzumab Govitecan verbessert das Gesamtüberleben bei mTNBC
Auch beim tripelnegativen Mammakarzinom (TNBC) gibt es inzwischen eine Reihe von zielgerichteten Therapieansätzen. Die beim ESMO-Kongress 2020 präsentierte ASCENT-Studie beeindruckte durch eine überzeugende Wirksamkeit des gegen TROP 2 gerichteten Antikörper-Drug-Konjugats Sacituzumab Govitecan. Bei dieser Phase-III-Studie wurde bei Patientinnen mit TNBC, die zuvor bereits zumindest zwei Chemotherapien im metastasierten Setting erhalten hatten, Sacituzumab mit einer Therapie nach Vorgabe des behandelnden Onkologen („physician’s choice“) verglichen.
Das mediane PFS unter Sacituzumab-Govitecan war mit 5,6 Monaten signifikant länger als das PFS unter einer Therapie nach Wahl des Onkologen (medianes PFS 1,7 Monate; HR: 0,41; p<0,0001). Selbst das OS war mit 12,1 vs. 6,7 Monate (HR: 0,48; p<0,0001) beinahe verdoppelt. An Nebenwirkungen traten zwar Neutropenien und Diarrhöen auf, insgesamt war die Therapie jedoch gut verträglich. Während die Substanz in den USA bereits eine beschleunigte Zulassung der Food and Drug Administration (FDA) hat, ist Sacituzumab-Govitecan derzeit bei uns noch nicht erhältlich.5
Immunonkologie erfolgreich beim PD-L1-positiven fortgeschrittenen TNBC
Neuerungen gibt es auch auf dem Gebiet der Immunonkologie (IO) zu vermelden. Patientinnen mit metastasiertem TNBC, die eine Expression des „Programmed cell death 1 ligand 1“(PD-L1)-Proteins auf mehr als 1% der tumorinfiltrierenden Tumorzellen aufweisen, haben mit dem PD-L1-Antikörper Atezolizumab, der in Kombination mit nab-Paclitaxel verabreicht wird, nun eine effektive Behandlungsoption. Die entsprechenden Daten stammen von der prospektiv-randomisierten Phase-III-Studie IMpassion 130, in der 902 Patienten mit unbehandeltem, metastasiertem TNBC 1:1 randomisiert wurden und entweder Atezolizumab plus nab-Paclitaxel oder Placebo plus nab-Paclitaxel erhielten. Atezolizumab plus nab-Paclitaxel verlängerte das PFS von Patienten mit metastasiertem TNBC in der „Intention to treat“(ITT)-Population und insbesondere in der PD-L1-positiven Subgruppe. Schon die initiale Analyse, die 2018 vorgestellt worden war, erreichte den primären Endpunkt PFS mit 7,2 versus 5,5 Monate in der ITT-Population. Wie zu erwarten war, beschränkte sich der DFS-Benefit mit 7,5 versus 5,0 Monate auf die PD-L1-IC-positive Gruppe (HR:0,62; p<0,001), während jene Patientinnen, deren Tumoren <1% PD-L1-positive Immunzellen aufwiesen, praktisch keinen Vorteil durch die Kombinationstherapie zeigten.
Neuere Daten aus der finalen OS-Analyse der Zulassungsstudie IMpassion 130 konnten demonstrieren, dass in der PD-L1-positiven Patientengruppe eine konsistente und klinisch relevante Verlängerung des medianen OS von etwa 7,5 Monaten durch die Kombination von Atezolizumab plus nab-Paclitaxel gegenüber nab-Paclitaxel plus Placebo erzielt werden konnte. Auch zeigten sich keine neuen Langzeitnebenwirkungen der Kombinationstherapie. Sie verschafft den Patientinnen also einen klinischen Nutzen, ohne ihre Lebensqualität zu beeinträchtigen. Die IO-Kombinationstherapie hat sich somit zu einem neuen Therapiestandard in der Erstlinientherapie des PD-L1-positiven TNBC entwickelt.6
Enttäuschend waren hingegen die Ergebnisse der IMpassion-131-Studie, bei der Nab-Paclitaxel durch Paclitaxel als Chemotherapie-Backbone ersetzt worden war. In der doppelblinden und placebokontrollierten Phase-III-Studie wurden Patientinnen mit einem lokal fortgeschrittenen bzw. metastasierten TNBC 1:1 randomisiert und erhielten entweder Paclitaxel alleine oder Paclitaxel plus Atezolizumab. Überraschenderweise konnte bei einer Therapie mit konventionellem Paclitaxel weder in der PD-L1-positiven Population noch in der ITT-Population ein zusätzlicher PFS-Vorteil durch die Zugabe von Atezolizumab erzielt werden (PD-L1-positiv: 6,0 vs. 5,7 Monate; HR: 0,82; p=20; ITT-Population: 5,7 vs. 5,6 Monate; HR:0,86). Auch hinsichtlich des OS ergab sich kein Vorteil durch die Zugabe von Atezolizumab zu Paclitaxel (PD-L1-positiv: 22,1 vs. 28,3 Monate; HR: 1,12; ITT-Population: 19,2 vs. 22,8 Monate; HR: 1,11). Die Ursache für das diskrepante Abschneiden von Atezolizumab in Abhängigkeit von der miteingesetzten Chemotherapie bleibt unklar, könnte jedoch mit dem immunsuppressiven Effekt der üblicherweise mit Paclitaxel eingesetzten Kortikosteroide zusammenhängen.7
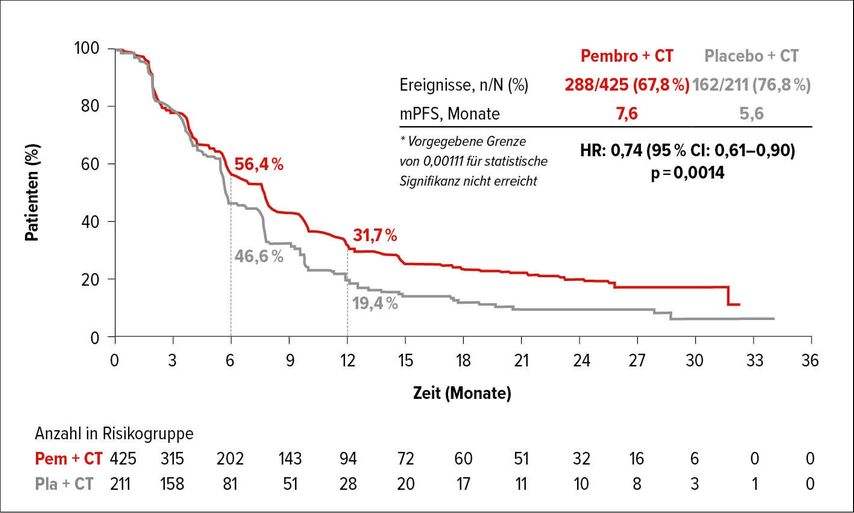
Auch zum PD-1(„Programmed cell death protein 1“)-Inhibitor Pembrolizumab gibt es inzwischen positive Effektivitätsdaten beim fortgeschrittenen TNBC, sofern die Tumoren eine PD-L1-Expression aufweisen. Patientinnen, deren Tumoren PD-L1 mit einem „Combined Positive Score“ (CPS) ≥10 exprimierten, erzielten unter Pembrolizumab plus Chemotherapie eine statistisch signifikante und klinisch relevante Verbesserung des PFS um 35% (HR:0,65; p=0,0012). Das PFS verlängerte sich durch die Zugabe von Pembrolizumab im Median auf 9,7 Monate gegenüber 5,6 Monaten unter Chemotherapie allein. Bei Patientinnen, deren Tumoren PD-L1 mit einem „Combined Positive Score“ ≥1 exprimierten, verlängerte Pembrolizumab plus Chemotherapie ebenfalls das PFS im Vergleich zur Chemotherapie allein (medianes PFS: 7,6 Monate vs. 5,6 Monate; HR: 0,74; 95% Konfidenzintervall [CI]: 0,61–0,90; p=0,0014; Abb. 2), jedoch erreichten diese Ergebnisse keine statistische Signifikanz.8
Abb. 2: PFS in der Population von Patientinnen mit fortgeschrittenem TNBC mit PD-L1-CPS ≥1 unter Chemotherapie (CT) plus/minus Pembrolizumab. Modifiziert nach 11
Literatur:
1 Di Cosimo S et al.: CDK 4/6 inhibitors mired in uncertainty in HR positive and HER2 negative early breast cancer. Breast 2020; 55: 75-8 2 Johnston SRD et al.: Abemaciclib combined with endocrine therapy for the adjuvant treatment of HR+, HER2-, node-positive, high-risk, early breast cancer (monarchE). J Clin Oncol 2020; 38(34): 3987-98 3 Lin NU et al.: Intracranial efficacy and survival with tucatinib plus trastuzumab and capecitabine for previously treated HER2-positive breast cancer with brain metastases in the HER2CLIMB trial. J Clin Oncol 2020; 38(23): 2610-9 4 Modi S et al.: Trastuzumab deruxtecan in previously treated HER2-positive breast cancer. N Engl J Med 2020; 382(7): 610-21 5 Ozaki Y et al.: Sacituzumab govitecan-hziy in triple-negative breast cancer. N Engl J Med 2019; 380(24): 2382 6 Emens LA et al.: IMpassion130: final overall survival analysis from the pivotal phase III study of atezolizumab plus nab-paclitaxel vs placebo plus nab-paclitaxel in previously untreated locally advanced or metastatic triple-negative breast cancer. ESMO-Kongress 2020; Abstract #LBA16 7 Miles DW et al.: Primary results from IMpassion131, a double-blind placebo-controlled randomized phase III trial of first-line paclitaxel atezolizumab for unresectable locally advanced/metastatic triple-negative breast cancer. ESMO-Kongress 2020; Abstract #LBA15 8 Cortes J et al.: Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): arandomised, placebo-controlled, double-blind, phase 3 clinical trial. Lancet 2020; 396(10265): 1817-28 9 Mayer E: PALLAS: a randomized phase III trial of adjuvant palbociclib with endocrine therapy versus endocrine therapy alone for HR+/HER2- early breast cancer. ESMO-Kongress 2020; #LBA12 10 Johnston S: Abemaciclib in high risk early breast cancer. ESMO-Kongress 2020; #LBA5_PR 11 Cortes J et al.: KEYNOTE-355: randomized, double-blind, phase III study of pembrolizumab + chemotherapy versus placebo + chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer. ASCO-Kongress 2020; Abstract #1000
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...