Wie sich die Behandlung von gastroösophagealen Tumoren verändert
Autorin:
Ap. Prof. Priv.-Doz. Dr. Dr. Aysegül Ilhan-Mutlu
Klinische Abteilung für Onkologie
Universitätsklinik für Innere Medizin I Medizinische Universität Wien
E-Mail: aysegul.ilhan@meduniwien.ac.at
Die Behandlung von oberen gastroösophagealen Tumoren (GET) hat sich in den letzten zwei bis drei Jahren revolutioniert, da die Ergebnisse großer Phase-III-Studien fast in jedem Setting positive Ergebnisse zeigten, die zu einem Paradigmenwechsel führten. Dieser kurze Überblick zielt darauf ab, sich auf die Behandlungshighlights zu konzentrieren und die praxisverändernden Daten bei der Behandlung von GET im palliativen Setting zu beleuchten.
Ösophagus und gastroösophagealer Übergang (GEJ)
Zweite und weitere Therapielinien
Die KEYNOTE-181-Studie war eine der ersten positiven Studien zu Ösophagustumoren seit Jahrzehnten. Diese Studie untersuchte Pembrolizumab im Vergleich zu einer Chemotherapie bei Patienten mit fortgeschrittenem/metastasiertem Plattenepithelkarzinom (ESCC) oder Adenokarzinom (AC) des Ösophagus als Zweitlinientherapie. Obwohl Pembrolizumab in der Gesamtkohorte vielversprechende Ergebnisse zeigte, wurde der signifikanteste Nutzen bei Patienten mit ESCC (medianes Gesamtüberleben [OS] 8,2 vs. 7,1 Monate; HR: 0,78; p=0,0095) und PD-L1-CPS („combined positive score“) ≥10 (medianes OS 9,3 vs. 6,7 Monate; HR: 0,69; p=0,0074) beobachtet. Somit wurde die Pembrolizumab-Therapie für diese Patienten-Subkohorte (ESCC plus CPS ≥10) als Therapie für die Zweit- und weitere Linien von der US-amerikanischen Food and Drug Administration (FDA) zugelassen, nicht jedoch von der Europäischen Arzneimittel-Agentur (EMA).
Nivolumab wurde in der ATTRACTION-3-Studie in einem ähnlichen Setting getestet. Diese Studie umfasste jedoch nur ESCC-Patienten zur Zweitlinienbehandlung. Das OS war in der Nivolumab-Gruppe im Vergleich zur Chemotherapie-Gruppe signifikant verlängert (medianes OS: 10,9 Monate vs. 8,4 Monate; HR: 0,77; p=0,019). Diese positiven Ergebnisse führten zu einer FDA- und EMA-Zulassung von Nivolumab als Zweitlinientherapie bei Patienten mit metastasiertem, rezidiviertem oder fortgeschrittenem ESCC.
Erstlinientherapie
Als First-Line-Studie randomisierte KEYNOTE-590 Patienten mit lokal fortgeschrittenem/inoperablem oder metastasiertem Adenokarzinom oder ESCC oder Siewert-Typ-1-GEJ entweder auf Pembrolizumab plus Chemotherapie oder Chemotherapie (Cisplatin plus 5-Fluoruracil [FU]) allein. Die Wirksamkeit von Pembrolizumab plus Chemotherapie vs. Chemotherapie war bei ESCC-Patienten mit CPS ≥10 am stärksten ausgeprägt (medianes OS 13,9 vs. 8,8 Monate; HR: 0,57; p<0,0001). Dies führte zu einer Zulassung von Pembrolizumab zusammen mit einer Chemotherapie auf Platin- und Fluoropyrimidinbasis als Erstlinientherapie bei Patienten mit fortgeschrittenem oder metastasiertem ESCC und Adenokarzinom des Ösophagus und GEJ, wenn CPS ≥10, durch die EMA.
In der CheckMate-648-Studie wurden 970 Patienten folgenden Armen zugeordnet:
-
Nivolumab q2w plus Chemotherapie (5-FU und Cisplatin q4w),
-
Nivolumab 3mg/kg q2w plus Ipilimumab 1mg/kg q6w oder
-
Chemotherapie allein.
Die koprimären Endpunkte waren das OS und das progressionsfreie Überleben (PFS) bei Patienten mit Tumorzell-PD-L1-Expression (TPS) ≥1% Diese Gruppe hatte eine statistisch hochsignifikante Verlängerung des OS mit Nivolumab plus Chemotherapie im Vergleich zu Chemotherapie allein (medianes OS 15,4 vs. 9,1 Monate; HR: 0,54; p<0,0001). Eine Zulassung durch die EMA von beiden Behandlungsarmen für die Erstlinienbehandlung von Patienten mit fortgeschrittenem oder metastasiertem ESCC und TPS ≥1% erfolgte im April 2022.
Magen und GEJ
Dritte und weitere Linien
Die TAGS-Studie untersuchte weltweit Trifluridin/Tipiracil in einem Phase-III-Setting und randomisierte Patienten mit metastasiertem Magen- und GEJ-Tumor, die mindestens zwei vorangegangene Chemotherapien erhalten hatten, entweder auf Trifluridin/Tipiracil oder auf Placebo. Das mediane OS betrug 5,7 Monate in der Trifluridin/Tipiracil-Gruppe vs. 3,6 Monate in der Placebo-Gruppe (HR: 0,69; p=0,00029). Die Behandlung wurde gut vertragen.
Diese signifikante Verlängerung des OS führte zur Zulassung (durch FDA und EMA) von Trifluridin/Tipiracil als dritter und weiterer Behandlungsoption bei Adenokarzinomen von Magen- und GEJ-Tumoren.
Zweitlinientherapie
Eine internationale, randomisierte, multizentrische Phase-III-Studie (REGARD) zeigte einen Überlebensvorteil der Ramucirumab-Monotherapie bei Patienten mit fortgeschrittenem Magen- oder GEJ-Adenokarzinom in einem Zweitliniensetting, welche für eine Chemotherapie in zu schlechtem Zustand waren.
Eine andere Phase-III-Studie war RAINBOW, in deren Rahmen Patienten mit metastasiertem Magen- oder GEJ-Adenokarzinom auf Paclitaxel mit oder ohne Ramucirumab (n=665) als Zweitlinienbehandlung randomisiert wurden. Patienten im Ramucirumab-plus-Paclitaxel-Arm hatten ein signifikant längeres medianes OS (9,63 Monate) im Vergleich zu Patienten, die Paclitaxel allein erhielten (7,36 Monate; HR: 0,80; p=0,01). Basierend auf den Ergebnissen dieser beiden Phase-III-Studien wurde Ramucirumab (als Einzelwirkstoff oder in Kombination mit Paclitaxel) für die Behandlung von Patienten mit fortgeschrittenem Magen- oder GEJ-Adenokarzinom zugelassen, die nach einer Erstlinientherapie mit einer platin- oder fluoropyrimidinbasierten Chemotherapie refraktär oder fortschreitend waren.
Im Falle einer Zweitlinientherapie sollten auch gewebeagnostische Zulassungen erwähnt werden. Im Allgemeinen scheint bei Mikrosatelliteninstabilität (MSI), die bei etwa 4 bis 5% aller westlichen Patienten mit fortgeschrittenem GET vorkommt, und bei hoher Tumormutationslast (TMB) eine Immuntherapie von größerem Nutzen zu sein. So hat die FDA die Immuntherapie mit Pembrolizumab zur Behandlung von Patienten mit nicht resezierbaren oder metastasierten soliden MSI-H- und TMB-H-Tumoren, die nach vorangegangener Behandlung unabhängig von der Tumorlokalisation fortschreiten und für die es keine zufriedenstellenden alternativen Behandlungsmöglichkeiten gibt, zugelassen. Eine EMA-Zulassung wird in Kürze erwartet.
Erstlinientherapie
Die Phase-III-Studie CheckMate 649 brachte schließlich die ersten positiven Ergebnisse für die Erstlinienbehandlung von Magen-, GEJ- und Ösophagus-AC, indem sie zeigte, dass die Zugabe von Nivolumab zur Standard-Chemotherapie (XELOX oder CAPOX) bei Patienten mit einem PD-L1-CPS ≥5 zu einer Verlängerung des OS (14,4 vs. 11,1 Monate; HR: 0,71; p<0,0001) sowie des PFS gegenüber alleiniger Chemotherapie führte.
Darüber hinaus zeigten aktuelle Daten eine anhaltende Verträglichkeit sowie gute Lebensqualität, was diese Kombination darin unterstützt, in dieser Patientenkohorte die Therapie der ersten Wahl zu sein. Allerdings ist umstritten, ob Patienten mit CPS <5 einen Nutzen daraus ziehen oder nicht. Dennoch hat die FDA diese Behandlungskombination bei allen Patienten mit fortgeschrittenem gastroösophagealem Adenokarzinom unabhängig vom CPS zugelassen. Die EMA hat jedoch die Zulassung auf Patienten mit CPS ≥5 beschränkt.
HER2-positive Tumoren
Die ToGA-Studie war die erste randomisierte, prospektive Phase-III-Studie, die die Wirksamkeit und Sicherheit von Trastuzumab bei Patienten mit HER2(„human epidermal growth factor receptor 2“)-positivem fortgeschrittenem Magen- oder GEJ-Adenokarzinom untersuchte. In dieser Studie wurden 594 Patienten mit HER2-positiven, lokal fortgeschrittenen, rezidivierenden oder metastasierten Tumoren randomisiert und erhielten Trastuzumab plus Chemotherapie (Cisplatin plus 5-FU oder Capecitabin) oder alleinige Chemotherapie. Die Ergebnisse zeigten eine signifikante Verlängerung des medianen OS durch die Gabe von Trastuzumab zur Chemotherapie bei HER2-positiven Patienten (medianes OS 13,8 bzw. 11 Monate; HR: 0,74; p=0,046).
Trastuzumab blieb bis zur Präsentation der Ergebnisse der DESTINY-GASTRIC-01-Studie die einzige Anti-HER2-Behandlungsoption bei Patienten mit Magen- und Speiseröhrenkrebs. In dieser Studie wurde nun das Antikörper-Chemotherapie-Konjugat Trastuzumab Deruxtecan (T-DXd) als Monotherapie bei stark vorbehandelten Patienten mit gastroösophagealen Tumoren (mindestens zwei Vorlinien) getestet. Dieses Konjugat scheint beim HER2-positiven gastroösophagealen Karzinom wirksam zu sein, zumindest bei stark vorbehandelten Patienten. Die Phase-III-Studien der Second- und First-Line-Settings laufen derzeit. In der Zwischenzeit hat die FDA T-DXd als Zweit- und Drittlinienbehandlung von Patienten mit HER2-Positivität, die zuvor eine auf Trastuzumab basierte Therapie erhalten haben, zugelassen.
Eine weiteres Highlight, das die Praxis möglicherweise verändern wird, stammt aus der KEYNOTE-811-Studie. Dies ist eine Phase-III-Studie, in der Patienten mit HER2-positiven metastasierenden Magen- oder GEJ-Tumoren entweder auf Pembrolizumab plus Behandlungsstandard (SOC, Anti-HER2 und Chemotherapie) oder Placebo plus SOC randomisiert wurden. Die Gesamtansprechrate (ORR) betrug 74,4% bei Pembrolizumab plus SOC, jene bei Placebo plus SOC 51,9% (Unterschied 22,7 Prozentpunkte, p=0,000006). Die FDA hat Pembrolizumab in dieser Subpopulation von Patienten basierend auf dieser im Protokoll festgelegten ersten Zwischenanalyse zugelassen.
Schlussfolgerung
Jahrzehntelang wurde im Bereich der gastroösophagealen Tumoren intensiv geforscht, leider mit wenig überzeugenden Ergebnissen. Dieser Trend scheint sich nun zu ändern, da verschiedene immun- und zielgerichtete Therapien bei Patienten mit einem gastroösophagealen Tumor sowohl im resezierbaren als auch im metastasierten Setting vorteilhaft waren.
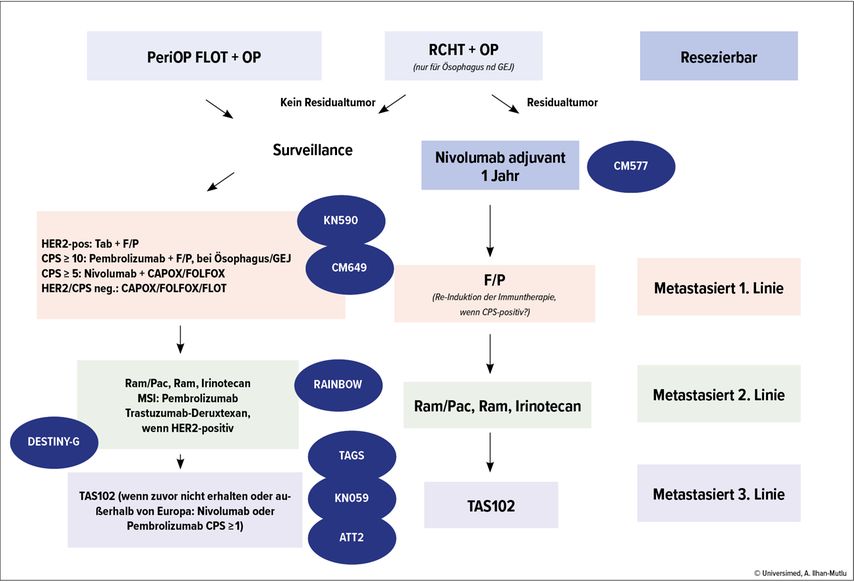
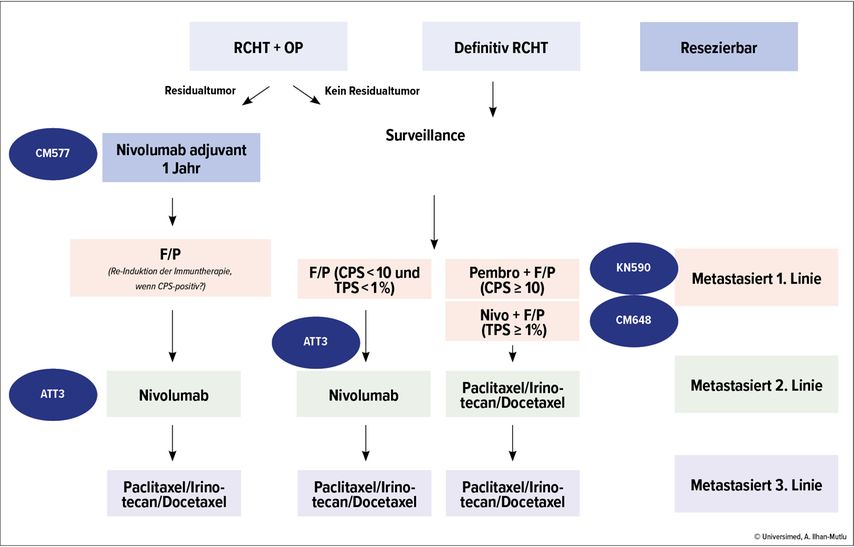
Im Lichte der jüngsten Daten ist der potenzielle Behandlungsalgorithmus von GET getrennt in Adenokarzinom und Plattenepithelkarzinom in Abbildung 1 und Abbildung 2 dargestellt.
Abb. 1: Möglicher zukünftiger Behandlungsalgorithmus beim Adenokarzinom (Magen/Ösophagus/gastroösophagealer Übergang). ATT: Attraction; CM:CheckMate; CPS: „Combined positive score“ für PD-L1-Expression; F: Fluoropyrimidin; KN: Keynote; L: Folinsäure; MSI: Mikrosatelliteninstabilität; O: Oxaliplatin; P: Platin; Pac: Paclitaxel; RCHT: Radiochemotherapie; Ram: Ramucirumab; T: Docetaxel; Tab: Trastuzumab
Abb. 2: Möglicher zukünftiger Behandlungsalgorithmus des Plattenepithelkarzinoms des Ösophagus. ATT: Attraction; CM: CheckMate; CPS: „Combined positive score“ für PD-L1-Expression; F: Fluoropyrimidin; KN: Keynote; P: Platin; RCHT: Radiochemotherapie; TPS: „Tumor proportion score“ von PD-L1-Expression
Literatur:
bei der Verfasserin
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...