
Vom Mikrobiom bis zu CAR-T-Zellen
Bericht: Friederike Klein
Die Immuntherapie ist eines der innovativsten Felder der Onkologie und hat seit Jahren einen eigenen europäisch-internationalen Kongress. In diesem Jahr fand die Immunotherapy of Cancer Conference (ITOC) zum siebten Mal statt – und das erste Mal virtuell. Zukunftsweisendes zur Immuntherapie gab es unter anderem in Bezug auf das Mikrobiom, die Checkpoint-Inhibition und die „Chimeric antigen receptor“(CAR)-T-Zellen.
Hoffnungsträger Stuhl
Für den Erfolg einer allogenen Stammzelltransplantation (SZT) spielt das Mikrobiom eine wichtige Rolle. Sowohl Gesamtüberleben (OS) als auch letale Graft-versus-Host-Erkrankung (GvHD), Sepsishäufigkeit, Engraftment und Rezidivrate werden von Veränderungen im Mikrobiom beeinflusst.1,2
Wie Prof. Dr. Marcel R. M. van den Brink vom Memorial Sloan Kettering Cancer Center (MSKCC) in New York berichtete, gilt das nach einer noch nicht publizierten Studie mit 240 Patienten auch für die autologe SZT: Eine geringe Diversität des intestinalen Mikrobioms des Empfängers zum Zeitpunkt des neutrophilen Engraftments geht danach mit einem kürzeren progressionsfreien Überleben (PFS) einher (Hazard-Ratio [HR]: 0,54; 95% Konfidenzintervall [CI]: 0,32–0,92; p=0,024) (Abb. 1A). Auch das OS ist bei großer gegenüber geringer Vielfalt im Darmmikrobiom verlängert (HR: 0,38; 95% CI: 0,16–0,92; p=0,032) (Abb. 1B).
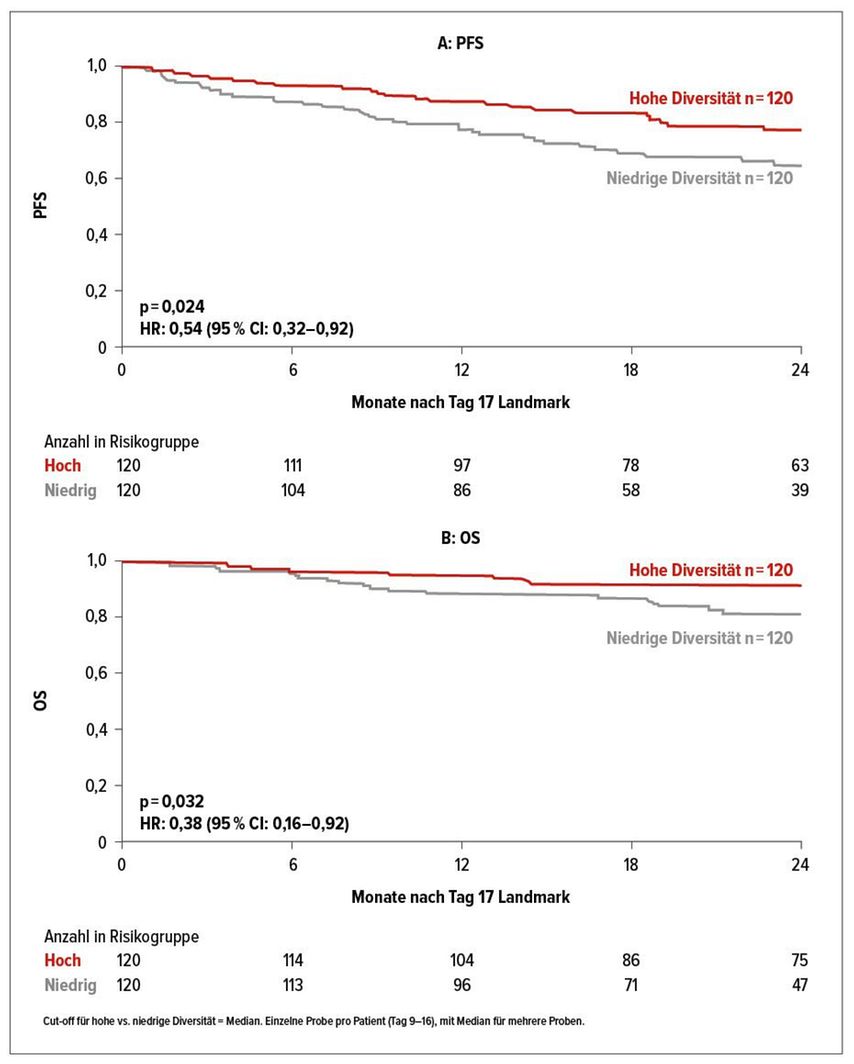
Abb. 1: Niedrige Diversität des intestinalen Mikrobioms zum Zeitpunkt des neutrophilen Engraftments ist bei Auto-SZT-Rezipienten mit einem kürzeren PFS (A) und OS (B) assoziiert. Modifiziert nach dem Vortrag von Prof. van den Brink
Wesentliche Einflüsse auf das Darmmikrobiom haben Antibiotika, Ernährung, Konditionierungsregime und andere Medikamente. Therapeutische Ansätze umfassen unter anderem Kommensalen-sparende Antibiotikaregime, diätetische Maßnahmen, z.B. die Gabe nichtverdaubarer Kohlenhydrate oder kurzkettiger Fettsäuren, und probiotische Maßnahmen wie die Gabe bestimmter Bakterienstämme oder den fäkalen Mikrobiomtransfer (FMT).
Mit dem FMT werden nicht einfach nur günstigere Mikroorgansimen im Empfänger angesiedelt, die die Zusammensetzung des Mikrobioms kurz- oder auch längerfristig verändern. Die FMT kann eine Art Umprogrammierung im Hinblick auf die onkologische Therapie möglich machen, wie Prof. Dr. Giorgio Trinchieri von der Universität Pittsburgh berichtete. Überträgt man das Mikrobiom von einem Patienten mit Melanom im Stadium IV, der auf Pembrolizumab angesprochen hat, auf einen Melanompatienten ohne Ansprechen auf den Checkpoint-Inhibitor, kann dies zu einem Ansprechen auch beim Empfänger führen. In einer Machbarkeitsstudie kam es bei einem auf die Immuntherapie refraktären Patienten nach einer solchen FMT mit Pembrolizumab zu einer Komplettremission (CR), zwei weitere sprachen partiell an und drei Patienten blieben mehr als ein Jahr stabil. Die übrigen neun FMT-Empfänger zeigten allerdings weiter kein Ansprechen auf den gegen den Checkpoint „programmed cell death 1“ (PD-1) gerichteten Antikörper. Gründe dafür könnten andere Resistenzmechanismen sein, meinte Prof. Trichieri, beispielsweise das Fehlen entsprechender Tumorantigene. Möglich seien auch eine Immundefizienz oder das Fehlen bestimmter Bakterientaxa, die der Patient benötigen würde, der Spenderstuhl aber nicht bietet.
Tatsächlich sind die Bakterienstämme und ihre Zusammensetzung bei jedem Menschen einzigartig, betonte Prof. Dr. Nicola Segata vom Zentrum für integrative Biologie der Universität von Trient. Das Engraftment nach FMT ist abhängig von den Stämmen von Spender wie Empfänger. Er berichtete von dem FMT als Supportivtherapie bei Patienten mit Nierenzellkarzinom, die bei einer Therapie mit einem Tyrosinkinaseinhibitor unter einer anhaltenden Diarrhö litten.3 Sieben der zehn FMT-Patienten hatten vier Wochen nach FMT keine Diarrhö mehr, bei Placebo-FMT war das bei keinem der zehn Patienten dieser Gruppe der Fall.
Vor allzu viel Euphorie warnte der Experte für computergestützte Biogenomik aber: Ein Großteil des menschlichen Mikrobioms ist noch völlig unerforscht. In einer weltweit durchgeführten Studie fanden sich in Stuhl, Vagina, Mundhöhle und auf der Haut auf Speziesebene Genome, die zu 77% unbekannt waren. Vieles ist also noch eine „black box“ und es gibt ein so komplexes, kreuzreaktives Netzwerk im Darmmikrobiom, dass die Folgen von Eingriffen derzeit noch nicht gut abzuschätzen sind.
Anti-PD-1-Resistenz überwinden
Tumoren mit wenig Expression des „programmed cell death ligand 1“ (PD-L1), wenig CD8-positiven T-Zellen und vielen FOXp3-regulatorischen T-Zellen gelten als „kalt“ – sie sprechen nicht auf die Therapie mit PD-1- oder PD-L1-Checkpoint-Inihibitoren an.
Ein typischer kalter Tumor ist das Pankreaskarzinom. Ein Ansatz, diesen Tumor „heiß“ zu machen, stellt die GVAX-Vakzine dar, die über die Aktivierung von dendritischen Zellen die T-Zellen des Patienten gegen Tumorzellen im Pankreas aktivieren soll. Alleine ist die Vakzine allerdings nicht ausreichend wirksam, erklärte Prof. Dr. Lei Zheng von der John-Hopkins-Universität in Baltimore. Sie kann aber helfen, das Tumormilieu für die Immuntherapie vorzubereiten. Die Vakzine induziert eine Infiltration des Tumors mit T-Zellen. Für eine Assoziation mit dem Gesamtüberleben sind allerdings Granzyme-B-exprimierende CD8-positive T-Zellen notwendig, deren Anteil an den tumorinfiltrierenden Lymphozyten (TIL) nach Vakzinierung gering war. Das änderte sich durch eine Kombination von GVAX mit dem PD-1-Inhibitor Nivolumab und einer T-Zell-Aktivierung durch einen agonistisch wirkenden Anti-CD137-Antikörper, Urelumab. Mit dieser Tripeltherapie erreichten 30% der Patienten mit Pankreaskarzinom ein Ansprechen. Es zeigte sich, dass die erschöpfte, Eomesodermin(Eomes)-positive T-Zell-Population abnahm, die Granzyme-B-produzierenden Populationen zunahmen. Vakzine und Anti-CD137-Antikörper können demnach helfen, das Mikromilieu im Prostatakarzinom so umzustimmen, dass der Tumor auf die Checkpoint-Blockade anspricht.
Mit Sport Immunsystem ankurbeln
Einen ganz anderen Ansatz, um Tumoren immunologisch angreifbarer zu machen, verfolgt die Arbeitsgruppe von Prof. Dr. Per Thor Straten von der Universität Kopenhagen. Im Mausmodell hatten Tiere, die sich im Laufrad intensiv bewegen konnten, zu 60% seltener die induzierten humanen Karzinome entwickelt als Mäuse, die kein Laufrad zur Verfügung hatten, und bei Karzinomentwicklung waren die Tumoren der aktiven Mäuse kleiner geblieben.4 Die körperliche Aktivität führte zu einer Mobilisierung von Immunzellen und einer verstärkten Tumorinfiltration durch Immunzellen, insbesondere von NK- und T-Zellen. Das wollen die Wissenschaftler jetzt auf den Menschen übertragen.
Im August 2020 begann eine randomisierte klinische Studie mit Patienten mit metastasiertem nichtkleinzelligem Bronchialkarzinom. Zur Mobilisierung der Immunzellen trainieren die Patienten der Interventionsgruppe sechs Wochen lang parallel zu einer konventionellen Therapie dreimal wöchentlich 30 Minuten lang mit moderater bis hoher Intensität, während Patienten in der Kontrollgruppe die onkologische Therapie alleine erhalten. Diese kann aus einer Checkpoint-Hemmung, einer Kombination von Checkpoint-Inhibitoren mit einer Chemotherapie oder einer onkologischen Surveillance bestehen. An der Studie teilnehmen können nur Patienten in einem guten Allgemeinzustand und das Training erfolgt aus Sicherheitsgründen in der Klinik, um eine rasche Intervention bei Komplikationen gewährleisten zu können.
Neue Ziele für CAR-T-Zellen
Nach den ersten auf das B-Zell-Antigen CD19 gerichteten T-Zell-Therapien mit CAR folgen immer mehr Ansätze mit anderen Antigenen. Kurz vor der Zulassung steht ein CAR-T-Zell-Produkt zur Therapie des multiplen Myeloms, das auf das B-Zell-Reifungsantigen BCMA gerichtet ist.5
Ein weiteres CAR-T-Zell-Produkt nutzt als Zielstruktur SLAMF7, das die Funktion von NK-, T- und B-Zellen beeinflusst. Das SLAMF7-CAR wird nicht über einen viralen Vektor, sondern mithilfe des springenden Gens „sleeping beauty“ transferiert. Es besitzt eine definierte Zusammensetzung von CD4- und CD8-positiven Zellen. Die Erwartungen an die SLAMF7-CAR-T-Zell-Therapie sind hoch, wie Dr. Michael Hudecek vom translationalen CAR-T-Zell-Programm der Universitätsklinik Würzburg berichtete: Im Tiermodell war eine ausgeprägte Eradikation der Myelomzellen bis hin zu einer Heilung zu beobachten. Mit CARAMBA ist im August 2020 die erste Humanstudie in Zentren in sechs europäischen Ländern angelaufen.
Beim Neuroblastom, dem häufigsten extrakraniellen soliden Tumor in der Kindheit, ist eine auf das Disialogangliosid GD2 gerichtete CAR-T-Zell-Therapie Erfolgversprechend. Sie erreichte in einer Phase-I-Studie mit Patienten im Alter von 12 Monaten bis 25 Jahren, die an einem Neuroblastom mit hohem Risiko erkrankt waren, eine Ansprechrate von 79% mit 37% Komplettremissionen, wie Prof. Dr. Franco Locatelli von der Universität Sapienza in Rom berichtete. Alle Patienten waren vortherapiert und galten als nicht heilbar oder hatten ein extrem hohes Rezidivrisiko ohne andere Therapieoptionen. Autologe CD3/CD28-positive T-Zellen der Patienten wurden mithilfe eines retroviralen Vektors mit dem Drittgenerations-CAR gegen GD ausgestattet und reinfundiert. Typische Nebenwirkungen der CAR-T-Zell-Therapie waren laut Prof. Locatelli meist nur mild bis moderat ausgeprägt. Ein Zytokinfreisetzungsyndrom erreichte nur bei einem von 19 Patienten Grad 3 und bei einem weiteren Grad 4. Neurotoxizität wurde bislang überhaupt nicht beobachtet. Häufig waren Neutropenien des Grads 3/4 (14 von 19 Patienten). Das mediane Gesamtüberleben betrug 6,87 Monate, aber 37,6% der Patienten überlebten zwei Jahre.
Eine Phase-I/II-Studie untersucht nun die Wirksamkeit und die Tolerabilität der GD-gerichteten CAR-T-Zell-Therapie bei Patienten mit rezidiviertem oder refraktärem GD2-positivem Neuroblastom sowie Patienten mit anderen GD2-positiven Tumorerkrankungen wie z.B. einem rezidivierten oder refraktären Osteosarkom oder Ewing-Sarkom.
Quelle:
Virtuelle 7th Immunotherapy of Cancer Conference (ITOC7), 2.–3. Oktober 2020
Literatur:
1 Peled JU et al.: N Engl J Med 2020; 382(9): 822-34 2 Stein-Thoeringer CK et al.: Science 2019; 366(3469): 1143-9 3 Ianiro G et al.: Nat Commun 2020; 11(1): 4333 4 Pedersen et al.: Cell Metobolism 2016; 23(3): 554-62 5 Munshi SC et al.: ASCO 2020 Virtual Meeting, Abstract #8503
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...


