Urothelkarzinom: neue Standards «ante portas»
Autoren:
Prof. Dr. med. Jörg Beyer
Universitätsklinik für Medizinische Onkologie
Inselspital, Universität Bern
E-Mail: joerg.beyer@insel.ch
PD Dr. med. Thomas Hermanns
Leitender Arzt
Universitätsspital Zürich, Klinik für Urologie Universität Zürich
E-Mail: thomas.hermanns@usz.ch
Zwei grosse amerikanische Kongresse sind für uroonkologisch Interessierte besonders relevant: das Fokustreffen Uroonkologie der American Society of Clinical Oncology (ASCO-GU) sowie die Jahrestagung der American Society of Clinical Oncology (ASCO).
Keypoints
-
Eine adjuvante Therapie mit Nivolumab verlängert das krankheitsfreie Überleben nach kurativ intendierter radikaler Zystekomie bzw. Nephroureterektomie bei Patienten mit Hochrisiko-Urothelkarzinomen.
-
Enfortumab Vedotin verlängert das Gesamtüberleben noch in der dritten Linie bei intensiv vorbehandelten metastasierten Urothelkarzinomen – allerdings zu derzeit noch inakzeptabel hohen Kosten.
-
Harnblasen-erhaltende Konzepte werden als erfolgversprechende Alternative zur kurativ intendierten radikalen Zystektomie bei Patienten mit lokal begrenztem muskelinvasivem Urothelkarzinom der Harnblase untersucht.
Auf diesen Kongressen wurden 2021 die Ergebnisse zweier prospektiver randomisierter Studien vorgestellt, welche beide das Potenzial haben, neue Standards in der Therapie von Urothelkarzinomen zu definieren und die Prognose sowohl von Patienten in lokal begrenzten als auch metastasierten Tumorstadien zu verbessern. Beide Studien liegen mittlerweile hochrangig publiziert vor.1,2 Ebenso spannend sind allerdings auch erste klinische Studien, welche alternative Strategien zur radikalen kurativ intendierten Zystektomie bei Patienten evaluieren, die für einen solchen Eingriff zu krank sind oder die einen Harnblasenerhalt wünschen.3
Immuncheckpoint-Inhibitoren als adjuvante Therapie
Immuncheckpoint-Inhibitoren (CPI) sind als adjuvante Therapie von Urothelkarzinomen interessant, um die hohe Rezidivrate von 50% oder mehr nach neoadjuvanter Chemotherapie und kurativ intendierter radikaler Zystektomie zu senken, sowie bei den Patienten, die keine neoadjuvante Therapie erhalten konnten, und bei Patienten mit Urothelkarzinomen des oberen Harntraktes. Auf dem ASCO-Kongress 2020 und aktuell publiziert in «Lancet Oncology» zeigte der Einsatz des CPI Atezolizumab im Rahmen der IMvigor010-Studie trotz Hinweisen auf eine klinische Wirksamkeit keinen Vorteil zugunsten eines verbesserten krankheitsfreien Überlebens, welches als primärer Endpunkt der Studie definiert war.4,5 Möglicherweise vermag künftig die Analyse zirkulierender Tumor-DNA eine Subgruppe zu definieren, die dennoch von einer adjuvanten Therapie mit Atezolizumab profitieren könnte.
Aktuell wurden jedoch auf dem ASCO-GU im Februar 2021 die Ergebnisse von CheckMate 274 vorgestellt, in der bei einem vergleichbaren Patientenkollektiv der Einsatz von Nivolumab als adjuvante Therapie nach kurativ intendierter radikaler Resektion von Urothelkarzinomen der Harnblase oder des oberen Harntraktes untersucht wurde. Die Studie wurde mittlerweile im «New England Journal of Medicine» publiziert.1
Eingeschlossen wurden in der prospektiven, randomisierten, doppelt verblindeten, placebokontrollierten CheckMate-274-Studie insgesamt 709 Patienten, die mittels «Intention to treat»-Analyse ausgewertet wurden, 353 Patienten im Arm mit Nivolumab und 356 Patienten im Arm mit Placebo. Wie in einer so grossen, professionell durchgeführten Studie zu erwarten, waren beide Studienarme bezüglich der wesentlichen Patientencharakteristika vergleichbar. Der primäre Endpunkt eines verbesserten krankheitsfreien Überlebens zugunsten der adjuvanten Therapie mit Nivolumab wurde erreicht. Ereignisse in Form von Progress oder Tod traten während eines medianen Beobachtungszeitraums von rund 20 Monaten bei 170/353 (48,2%) Patienten im Nivolumab-Arm auf und bei 204/356 (57,3%) Patienten im Placeboarm. Die Wahrscheinlichkeit für das krankheitsfreie Überleben nach 12 Monaten betrug mit Nivolumab 62,8% (95% CI: 57,3–67,8%), mit Placebo dagegen nur 46,6% (95% CI: 41,1–51,9%). Diese Unterschiede sind klinisch relevant und mit einer Hazard-Ratio von 0,70 (95% CI: 0,55–0,90) selbst für die «Intention to treat»-Kohorte auch statistisch signifikant.
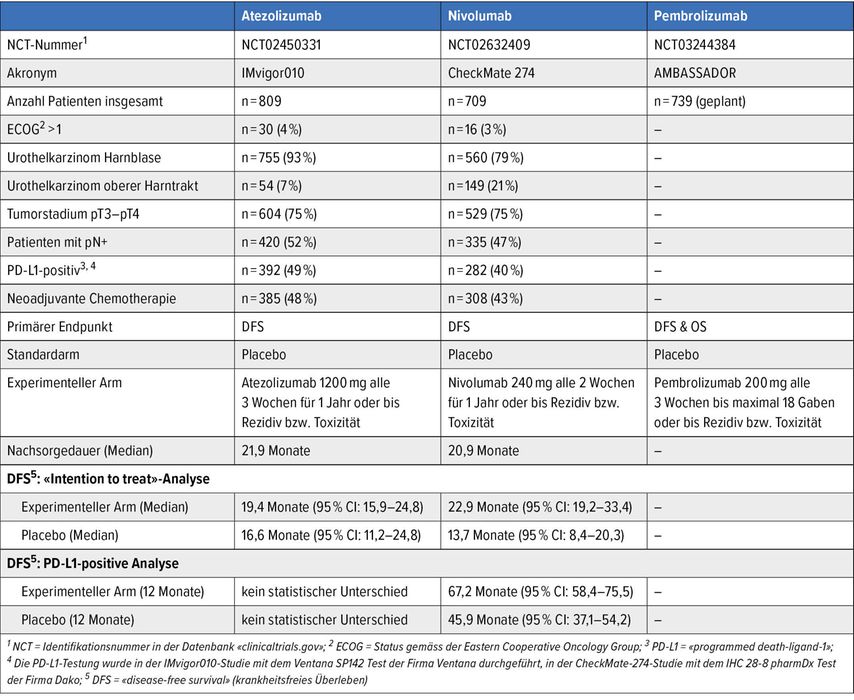
Besonders spannend ist jedoch, dass die Ergebnisse für Patienten mit Expression des «programmed death-ligand-1» (PD-L1) ≥1% nochmals deutlich besser waren als für Patienten ohne Expression von PD-L1. Verwendet wurde der immunhistochemische Test IHC 28-8 pharmDx der Firma Dako. Die Wahrscheinlichkeit für das krankheitsfreie Überleben betrug in der Kohorte von Patienten mit PD-L1 ≥1% mit Nivolumab 67,2% (95% CI: 58,4–74,5%) und mit Placebo nahezu unverändert nur 45,9% (95% CI: 37,1–54,2%). Die Hazard-Ratio von 0,55 (95% CI: 0,35–0,85) zugunsten des Einsatzes von Nivolumab war für die Kohorte mit PD-L1-Expression ≥1% ebenfalls statistisch signifikant. Dies ist umso bemerkenswerter, als ein derartiger Unterschied in der IMvigor10-Studie mit dem CPI Atezolizumab nicht gefunden worden war (Tab. 1).3
Tab. 1: Vergleich des Einsatzes von Immuncheckpoint-Inhibitoren als adjuvante Therapie beim Urothelkarzinom nach kurativ intendierter radikaler Zystektomie
Wieso konnte das krankheitsfreie Überleben durch den Einsatz von Nivolumab verlängert werden, jedoch durch Atezolizumab nicht? Skeptiker würden Zufall bzw. Pech, unterschiedliche Patientenkollektive oder Unterschiede im statistischen Design als ursächlich ansehen, andere Unterschiede in der biologischen Aktivität der beiden Substanzen, die Herstellerfirma von Nivolumab wahrscheinlich die Überlegenheit ihres Antikörpers (Tab. 1). Es bleibt letztendlich spekulativ. In der adjuvanten Situation bei Urothelkarzinomen wird mit Pembrolizumab derzeit ein weiterer CPI in der prospektiven, randomisierten AMBASSADOR-Studie (NCT03244384) untersucht. Die Ergebnisse dieser Studie stehen noch aus. Sicher ist jedoch, dass CPI aus der Therapie von Urothelkarzinomen nicht mehr wegzudenken sind und als vielversprechende Option auch in der adjuvanten Therapie nach kurativ intendierter Resektion gelten. Allerdings sind die Nachsorgeintervalle noch zu kurz und es wurde noch kein Vorteil im Gesamtüberleben nachgewiesen. Der Einsatz von CPI stellt daher aktuell noch keinen neuen Standard dar als adjuvante Therapie bei Urothelkarzinomen nach kurativ intendierter radikaler Resektion. CPI sind in der Schweiz für diese Indikation auch noch nicht zugelassen.
Enfortumab Vedotin als «new kid on the block»
Enfortumab Vedotin ist ein gegen Nectin-4 gerichteter humanisierter Antikörper, der mit dem Spindelgift Monomethyl-Auristatin E gekoppelt ist. Auf diese Weise kann das Zellgift nach Bindung und Internalisierung als sogenannte «zielgerichtete Therapie» die Ausbildung eines funktionsfähigen Spindelapparates stören und die Tumorzellen in Apoptose zwingen.6 Nectin-4 ist bei mehr als 60% metastasierter Urothelkarzinome überexprimiert.7 Nachdem in vorangegangenen Studien bereits eine Wirksamkeit für Enfortumab Vedotin gezeigt werden konnte, wurden aktuell auf dem ASCO-GU 2021 die Ergebnisse der prospektiven EV-301-Studie vorgestellt und nachfolgend im «New England Journal of Medicine» publiziert.2
Randomisiert wurden in der prospektiven, unverblindeten EV-301-Studie 608 Patienten mit metastasierten Urothelkarzinomen. Alle Patienten mussten zuvor mit einem platinhaltigen Therapieregime und einem PD-1- oder PD-L1-Inhibitor behandelt worden sein und einen ECOG-Status von 0 oder 1 aufweisen, was in diesem Kollektiv intensiv vorbehandelter zumeist älterer und komorbider Patienten eine erhebliche Positivselektion darstellt. Dem entspricht, dass das mediane Alter der Patienten bei Studieneinschluss mit 68 Jahren vergleichsweise niedrig war. In den Studienarm mit Enfortumab Vedotin wurden 301 Patienten eingeschlossen, in den Standardarm wurden 307 Patienten eingeschlossen, die nach Entscheid des Studienzentrums eine Therapie mit Docetaxel, Paclitaxel oder Vinflunin erhielten. Die Therapie wurde in beiden Studienarmen bis zum Progress durchgeführt. Patienten mit Progress im experimentellen Arm mit Enfortumab Vedotin konnten eine weitere Chemotherapie erhalten, Patienten mit Progress im Standardarm erhielten kein Enfortumab Vedotin, weil ein Cross-over zur experimentellen Therapie laut Protokoll nicht erlaubt war.
Während des medianen Beobachtungszeitraums verstarben 134/301 (45%) Patienten im Studienarm mit Enfortumab Vedotin entsprechend einer medianen Überlebenswahrscheinlichkeit von 12,88 Monaten (95% CI: 10,58–15,21 Monate), dies im Vergleich zu 167/307 (54%) Patienten im Standardarm mit Chemotherapie und einer medianen Überlebenswahrscheinlichkeit von 8,97 Monaten (95% CI: 8,05–10,74 Monate). Somit zeigte sich ein medianer Überlebensvorteil von ca. 4 Monaten zugunsten von Enfortumab Vedotin. Die Hazard-Ratio lag bei 0,70 (95% CI: 0,56–0,89). Daher war der Unterschied im Gesamtüberleben zwischen den beiden Behandlungsarmen statistisch signifikant.
Diese Ergebnisse sind eindrucksvoll und dokumentieren sowohl eine Wirksamkeit des Therapieprinzips als auch einen klinischen Nutzen von Enfortumab Vedotin selbst bei intensiv vorbehandelten Patienten, sofern sie sich noch in einem guten Allgemeinzustand befinden. Der Einsatz des Medikamentes als Erstlinientherapie im Vergleich zu einer platinhaltigen Standardkombination wird derzeit in der prospektiven EV-302-Studie untersucht (NCT04223856). Studienzentren in der Schweiz sind das Inselspital in Bern sowie die Kantonsspitäler in Chur und Winterthur.
Eine Zulassung für die Schweiz existiert für Enfortumab Vedotin nicht. Prohibitiv ist der nicht nachvollziehbare und inakzeptabel hohe Preis des Medikaments, das über die internationale Apotheke zu monatlichen Therapiekosten von mehr als 30000 CHF bezogen werden kann. Hier überzieht die Industrie die gesellschaftlich akzeptablen Margen selbst für eine wirksame Substanz in einem solchen Übermass, dass zu hoffen bleibt, dass das Medikament in diesem Preissegment auch keine Zulassung erhalten wird, damit derartige Exzesse in der Preisgestaltung von Krebsmedikamenten in Zukunft keine Schule machen können. Vielleicht nimmt die Herstellerfirma aber auch mit «sanftem Druck» der Behörden Vernunft an.
Alternative Strategien zur kurativ intendierten radikalen Zystektomie
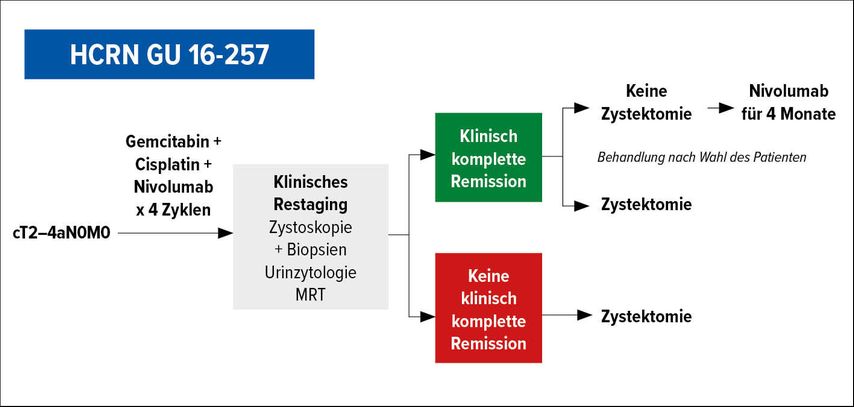
Eine trimodale Therapie mit maximalem transurethralem Tumordebulking und nachfolgender Radiochemotherapie ist seit vielen Jahren Standard für Patienten, die zu krank für eine kurativ intendierte radikale Zystektomie sind, einen Harnblasenerhalt wünschen oder für die der Eingriff aus anderen Gründen nicht in Betracht kommt. Nachteile vor allem der Radiotherapie sind Komplikationen wie z.B. eine strahleninduzierte Zystitis oder eine Schrumpfblase mit verringertem Harnblasenvolumen. Weiterhin sind die Nachsorge und eine eventuell erforderliche spätere Zystektomie erschwert. Da jedoch bei bis zu 30% der Patienten bereits nach alleiniger Chemotherapie in einer nachfolgenden Zystektomie kein Tumor mehr im Resektat nachweisbar ist und einige Patienten, die weitere Interventionen ablehnen, auch ohne Radiotherapie oder Zystektomie Langzeitremissionen erreichen können, untersuchten Galsky et al., ob bei ausgewählten Patienten nach einer Chemoimmunkombination auf die begleitende Radiotherapie verzichtet werden kann (Abb. 1).3
Abb. 1: Konzept der Phase-II-Studien HCRN GU 16-257: eine trimodale Therapie ohne Radiotherapie für Patienten mit klinisch kompletter Remission (modifiziert nach Galsky et al.)3
In der prospektiven Phase-II-Studie HCRN GU 16-257 erhielten 76 Patienten zunächst eine Chemotherapie mit 4 Zyklen Cisplatin und Gemcitabin in Kombination mit dem CPI Nivolumab.3 In einem darauffolgenden sehr sorgfältigen Restaging mit Zystoskopie, zystoskopischen Biopsien, MRI und Urinzytologie wurden Patienten mit einer klinisch kompletten Remission identifiziert. Diese Patienten konnten entweder eine kurativ intendierte radikale Zystektomie oder ein exspektatives Vorgehen wählen, mit einer Salvage-Zystektomie im Falle eines Rezidives. Alle Patienten ohne klinisch komplette Remission erhielten gleich im Anschluss an die Immunchemotherapie eine kurativ intendierte radikale Zystektomie. Nur 64 Patienten beendeten die 4 Zyklen Immunchemotherapie, von denen immerhin 31 (48%) Patienten eine klinisch komplette Remission erreichten. Wenig überraschend wünschte nur ein Patient direkt eine Zystektomie, die anderen 30 Patienten wählten ein zunächst exspektatives Vorgehen. Während der sehr kurzen Nachbeobachtungszeit von im Median ca. einem Jahr erlitten insgesamt 9 Patienten ein lokales Rezidiv, von diesen erhielten 6 Patienten die geplante Salvage-Zystektomie. Nur ein Patient war bei der Resektion nodal-positiv. Fernmetastasen traten bei keinem dieser 31 Patienten auf.
Die Daten der HCRN-GU-16-257-Studie sind selbstverständlich präliminär und müssen in prospektiven randomisierten Studien gegenüber dem Standard einer neoadjuvanten Chemotherapie gefolgt von kurativ intendierter radikaler Zystektomie oder einer herkömmlichen trimodalen Therapie geprüft werden. Dennoch sind diese ersten Ergebnisse spannend und Hypothesen-generierend und zeigen einen Weg auf, wie für ausgewählte Patienten ein Harnblasenerhalt möglich werden könnte ohne Einsatz einer Radiotherapie und den damit verbundenen Nebenwirkungen. Es muss allerdings betont werden, dass auch bei diesen selektionierten Patienten ein wirklicher Nutzen nur vorliegt, wenn Langzeitremissionen erzielt werden können.
Fazit
Immuncheckpoint-Inhibitoren stellen eine vielversprechende Substanzklasse in der adjuvanten Therapie nach kurativ intendierter radikaler Resektion von Urothelkarzinomen dar, sind in dieser Situation derzeit jedoch noch keine Standardtherapie und in der Schweiz für diese Indikation auch noch nicht zugelassen.
In Studien werden neue Konzepte des Harnblasenerhalts untersucht, mit der Hoffnung, bei ausgewählten Patienten durch eine Chemoimmunkombinationstherapie auf eine Radiotherapie im Rahmen einer trimodalen Therapie verzichten zu können.
Mit Enfortumab Vedotin steht neu eine wirksame Therapie für Patienten mit intensiv vorbehandelten metastasierten Urothelkarzinomen zur Verfügung. Prohibitiv ist der inakzeptabel hohe Preis des Medikaments. Eine Zulassung in der Schweiz besteht für Enfortumab Vedotin ebenfalls noch nicht.
Literatur:
1 Bajorin DF et al.: Adjuvant nivolumab versus placebo in muscle-invasive urothelial carcinoma. N Engl J Med 2021; 384(22): 2102-14 2 Powles T et al.: Enfortumab vedotin in previously treated advanced urothelial carcinoma. N Engl J Med 2021; 384(12): 1125-35 3 Galsky MD et al.: Phase 2 trial of gemcitabine, cisplatin, plus nivolumab with selective bladder sparing in patients with muscle-invasive bladder cancer (MIBC): HCRN GU 16-257. J Clin Oncol 2021; 39(Suppl 15): Abstr. #4503 4 Hussain MHA et al.: IMvigor010: primary analysis from a phase III randomized study of adjuvant atezolizumab (atezo) versus observation (obs) in high-risk muscle-invasive urothelial carcinoma (MIUC). J Clin Oncol 2020; 38(Suppl): Abstr. #5000 5 Bellmunt J et al.: Adjuvant atezolizumab versus observation in muscle-invasive urothelial carcinoma (IMvigor010): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2021; 22(4): 525-37 6 Heath EI et al.: The biology and rationale of targeting nectin-4 in urothelial carcinoma. Nat Rev Urol 2021; 18(2): 93-103 7 Challita-Eid PM et al.: Enfortumab vedotin antibody-drug conjugate targeting nectin-4 is a highly potent therapeutic agent in multiple preclinical cancer models. Cancer Res 2016; 76(10): 3003-13
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...