Urothelkarzinom: gute Nachrichten für Patient:innen mit FGFR-Alterationen
Autorin:
OÄ Dr. Dora Niedersüß-Beke, MBA
Zentrum für Onkologie, Hämatologie und Palliativmedizin
I. Medizinische Abteilung, Klinik Ottakring, Wien
Beim Urothelkarzinom stand der diesjährige Kongress der American Society of Oncology (ASCO) ganz im Zeichen der Präzisionsmedizin. Der Inhibitor des Fibroblasten-Wachstumsfaktor-Rezeptors (FGFR) Erdafitinib gilt nun bei Patient:innen mit mutierten Karzinomen in gewissen Therapiesituationen als neuer Standard.
Einzug der Präzisionsmedizin in die Therapie des Urothelkarzinoms
Standardtherapie des Urothelkarzinoms (UC) im lokal fortgeschrittenen/metastasierten Setting ist eine platinhaltige Kombination gefolgt von einer Immuntherapie mit Avelumab bei Ansprechen bzw. einer Immuntherapie mit Pembrolizumab bei Krankheitsprogression. In höheren Therapielinien waren, bis zur Zulassung von Enfortumab Vedotin, einem hochpotenten Antikörper-Wirkstoff-Konjugat (ADC), in Europa kaum wirksame Therapiemöglichkeiten verfügbar.
Nun wurde die erste Phase-III-Studie präsentiert, in der eine gezielte Therapie, ein pan-FGFR(Fibroblasten-Wachstumsfaktor-Rezeptor)-Inhibitor, Erdafitinib, bei Patient:innen mit FGFR-alterierten Tumoren untersucht wurde. Die Inzidenz von FGFR-Alterationen beträgt rund 20% der Fälle bei Patient:innen mit einem fortgeschrittenen/metastasierten UC.
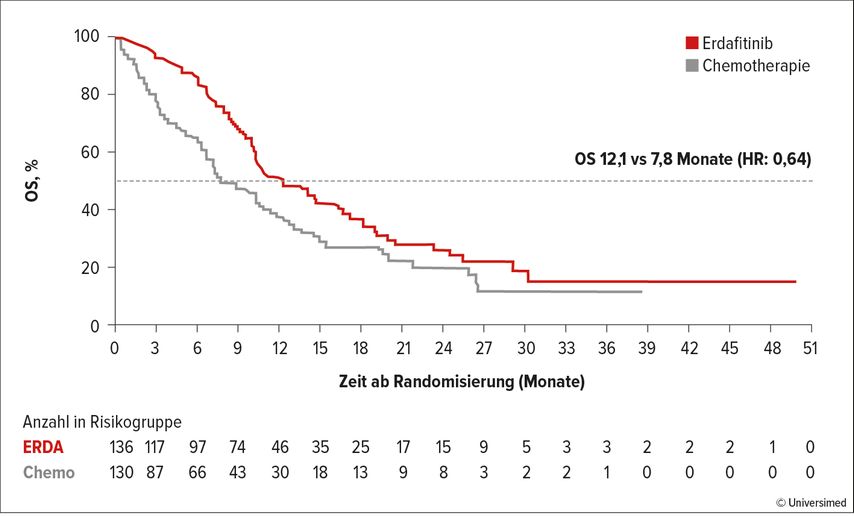
In die THOR-Studie wurden insgesamt 266 Patient:innen mit einer FGFR-3/2-Alteration eingeschlossen. Die Patient:innen erhielten Erdafitinib 8mg 1x täglich versus eine Chemotherapie mit Vinflunin oder Docetaxel alle 3 Wochen im Vergleichsarm. Der primäre Endpunkt dieser Studie war das Gesamtüberleben, er wurde mit 12,1 Monaten vs. 7,8 Monate, einer HR von 0,64 und einem p-Wert von 0,005 signifikant erreicht (Abb. 1). In den Subgruppenanalysen haben die Patient:innen unabhängig von ECOG-Status (0–2), Metastasierungsmuster, Therapielinie bzw. Tumorlokalisation von Erdafitinib profitiert. Auch die sekundären Endpunkte bestätigen die Potenz dieser gezielten Therapie. Das Gesamtansprechen lag bei 45,6% vs. 11,5% mit einer kompletten Remissionsrate von 6,6% im Studienarm. Das progressionsfreie Überleben lag bei 5,6 Monaten vs. 2,7 Monate (HR: 0,58).
Abb. 1: Signifikante Verlängerung des Gesamtüberlebens mit Erdafitinib im Rahmen der THOR-Studie. Modifiziert nach Loriot Y et al.: ASCO 2023; Abstr. #LBA4619
Doch auch diese Substanz ist mit Nebenwirkungen verbunden. Bei fast der Hälfte der behandelten Patient:innen im Studienarm (45,9%) traten therapieassoziierte Toxizitäten Grad 3–4 auf. Darunter waren Hyperphosphatämie, Diarrhö, Stomatitis, Hand-Fuß-Syndrom und Nagelveränderungen am häufigsten. Bei 8,1% der Patient:innen musste die Therapie aufgrund der Toxizität abgesetzt werden. Auch schwerwiegende Sehstörungen, z.B. aufgrund von Retinopathien, sind nicht zu unterschätzen. Eine Nebenwirkung, welche noch vor Therapiebeginn und während der Therapie eine ophthalmologische Betreuung notwendig macht.
Trotz der beschriebenen Nebenwirkungen ist Erdafitinib der neue Standard nach Therapieversagen unter einer oder mehreren Therapielinien und bei einer bestätigten FGFR-Alteration. Spätestens seit Präsentation dieser Studie ist eine molekulare Testung auf FGFR-Alterationen unerlässlich.
Erdafitinib + Cetrelimab in der Erstlinie?
Eine weitere spannende Studie untersuchte die Erdafitinib-Monotherapie vs. Erdafitinib in Kombination mit Cetrelimab, einem PD-L1-Inhibitor, in der Erstlinie. In die Phase-II-Studie NORSE wurden Cisplatin-unfitte Patient:innen, eine Gruppe, die rund 50% der Patientenpopulation ausmacht, mit einer FGFR-Alteration eingeschlossen. Der primäre Endpunkt dieser kleinen Studie, mit 45 Patient:innen pro Studienarm, waren Ansprechrate sowie Sicherheit. Bemerkenswert an dieser Studie ist, dass fast ein Drittel der Patient:innen einen ECOG-Status von 2 hatte und somit (weil Cisplatin-unfit und höherer ECOG-Status) die „alltägliche“ Patientenpopulation mit einem fortgeschrittenen UC realistisch abdeckt.
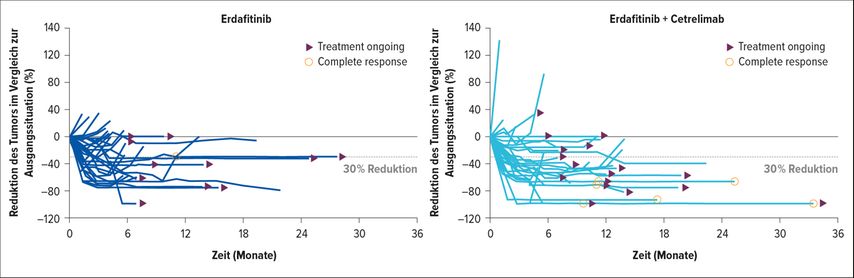
Die Kombination mit Erdafitinib und Cetrelimab konnte eine Ansprechrate von 55,4% vs. 44,2% erreichen. Tiefes und andauerndes Ansprechen (Abb. 2) waren ebenso evident wie eine deutliche Verlängerung im PFS und OS. Im Sicherheitsprofil zeigte sich kein numerischer Unterschied in den beiden Studienarmen (46,5% vs. 45,5% Toxizitäten von Grad 3–4), jedoch zeigte sich wiederum, dass die Toxizität der Checkpointinhibitoren (ein Todesfall aufgrund einer immunassoziierten Pneumonitis) nicht zu unterschätzen ist. Ob diese Kombination den Einzug in die Erstlinie schafft, ist abzuwarten, zumal derzeit einige Studien für Cisplatin-unfitte Patient:innen mit teilweise hochpotenten Substanzen (ADC) durchgeführt werden.
Abb. 2: Tiefe und Dauer des Ansprechens mit Erdafitinib und Erdafitinib in Kombination mit Cetrelimab. Die mediane Zeit bis zum Ansprechen betrug 1,5 Monate (1–6) für die Erdafitinib-Gruppe und 2,4 Monate (1–14) für die Erdafitinib+Cetrelimab-Gruppe. 25,6 % der Patient:innen in der Gruppe mit Erdafitinib bzw. 36,4 % der Patient:innen in der Gruppe mit Erdafitinib + Cetrelimab erhalten weiterhin eine Behandlung. Modifiziert nach Siefker-Radtke AO et al.: ASCO 2023; Abstr. #4504
Daten von längeren Follow-ups zurKombination mit Enfortumab Vedotin plus Pembrolizumab
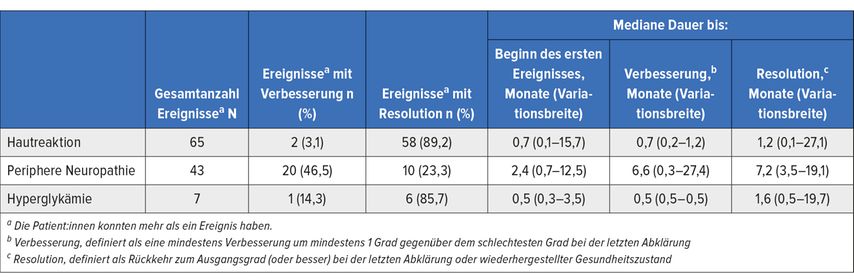
Hochinteressant war die Präsentation der Kohorte A der EV-301-Studie mit einem Nachbeobachtungszeitraum von fast 4 Jahren. In dieser Kohorte der mehrarmigen Phase-I/II-Studie wurden 45 Patient:innen mit Enfortumab Vedotin (EV) + Pembrolizumab therapiert. Mit 73,3% Rate des objektiven Ansprechens und einem PFS von 12,7 Monaten sind keine neuen Sicherheitsprobleme beschrieben, jedoch wurde erstmals die Dauer bis zur Verbesserung bzw. bis zur kompletten Resolution der relevanten Nebenwirkungen von EV, wie Hauttoxizität, Hyperglykämie oder der peripheren Neuropathie, präsentiert (Tab. 1). Diese hochpotente Kombination wird derzeit in der EV-302-Studie versus Standardtherapie (Platin/Gemcitabin gefolgt von Avelumab-Erhaltungstherapie) untersucht. Die Ergebnisse, welche eine potenzielle Änderung in der Erstlinientherapie des Urothelkarzinoms bewirken könnten, werden mit Spannung erwartet.
Tab. 1: Auftreten, Verbesserung und Resolution der Nebenwirkungen mit EV in der EV-301-Studie. Modifiziert nach Gupta S et al. ASCO 2023; Abstr. #4505
Literatur:
bei der Verfasserin
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...