Update multiples Myelom – Neuigkeiten vom EHA/ASCO 2020
Autor:
Univ.-Prof. Dr. Heinz Ludwig
Wilhelminen-Krebsforschungsinstitut
c/o I. Medizinische Abteilung
Zentrum für Onkologie und Hämatologie mit
Ambulanz und Palliativstation
Wilhelminenspital, Wien
E-Mail: heinz.ludwig@wienkav.at
Covid-19 hat in wenigen Monaten die Welt auf den Kopf gestellt und damit auch die Organisation von wissenschaftlichen Zusammenkünften und Kongressen. Dementsprechend wurden weder ASCO noch EHA 2020 auf konventionelle Weise in riesigen Veranstaltungshallen, sondern als virtuelles Meeting im Web abgehalten – mit weitreichenden positiven und negativen Konsequenzen. Zigtausend Spezialisten konnten sich die Mühen und Kosten einer Teilnahme vor Ort ersparen und damit auch wesentlich zur Reduktion des CO2-Ausstoßes beitragen. Außerdem mussten sie nicht lange Wege in den Kongresshallen absolvieren, sondern konnten bequem von ihrem Arbeitsplatz oder von zu Hause aus das Meeting verfolgen bzw. zahlreiche „sessions on demand“ zu den ihnen genehmen Zeiten verfolgen. Die entsprechenden Myelom-Highlights werden im Folgenden kurz zusammengefasst.
Neuigkeiten in der Erstlinientherapie
Elotuzumab wurde in Kombination mit Bortezomib-Lenalidomid-Dexamethason (VRd) in zwei randomisierten Studien evaluiert, wobei in die GMMG-HD6-Studie ausschließlich Patienten, die für eine Transplantation geeignet waren, eingeschlossen wurden. Diese von Hartmut Goldschmidt geleitete Studie hat insgesamt 559 Patienten in eine Gruppe mit Elotuzumab-VRd bzw. eine Gruppe mit VRd randomisiert. Nach vier Zyklen Induktion wurde eine autologe Transplantation durchgeführt, danach folgten weitere vier Zyklen Konsolidierung, gefolgt von der Erhaltungstherapie mit Lenalidomid, die in der ersten Gruppe mit Elotuzumab kombiniert wurde. Beim EHA-Meeting wurden nun die Responseraten nach Beendigung der vier Zyklen Induktion vorgestellt.1 Entgegen den Erwartungen konnte weder bezüglich der Gesamtansprechrate noch der Rate an ≥VGPR („very good partial response“) ein Unterschied zwischen beiden Behandlungsgruppen beobachtet werden (Elo-VRd vs. VRd; ORR: 82,4% vs. 85,6%; ≥VGPR: 58,3% vs. 54%). Die Kombinationstherapie zeigt keine erhöhte Rate an unerwünschten Wirkungen (AE) im Vergleich zu VRd. Obwohl die Rekrutierung schon vor mehr als einem Jahr beendet wurde, wurden keine Daten für das progressionsfreie Überleben (PFS) gezeigt, was darauf hinweist, dass es derzeit diesbezüglich keine signifikanten Unterschiede geben dürfte.
Eine ähnliche Studie (SWOG-1211) wurde von Saad Usmani präsentiert.2 In dieser kleinen randomisierten Phase-II-Studie wurden 100 Patienten mit zytogenetisch oder klinisch definiertem Hochrisiko-Myelom [t(14;16), t(14;20), del(17p) oder 1q21-Amplifikation, Plasmazellleukämie sowie erhöhtes Serum-LDH (>2x ULN)], die nicht für eine Transplantation vorgesehen waren, entweder in einen Therapiearm mit Elotuzumab-VRd oder in eine VRd-Gruppe randomisiert. Die Patienten erhielten acht Zyklen Elotuzumab-VRd oder VRd, gefolgt von der Erhaltungstherapie mit demselben Regime (allerdings in vierwöchigen Intervallen). Nach einem Follow-up von 53 Monaten zeigte sich kein Unterschied in Bezug auf Ansprechrate (ORR: 88% vs. 83%) und PFS (31 vs. 34 Monate; HR: 0,97) sowie Gesamtüberleben (OS) zwischen den beiden Therapiegruppen. Bemerkenswert ist allerdings das für eine Hochrisiko-Patientengruppe lange PFS.
Die Resultate dieser beiden Studien, sowie die in einer Presseaussendung angekündigten vergleichbaren Ergebnisse von Elotuzumab mit Lenalidomid-Dexamethason (Rd) und Rd bei neu diagnostizierten, nicht für die Transplantation geeigneten Patienten, legen nahe, dass Elotuzumab die Behandlungsergebnisse in der ersten Therapielinie nicht verbessert. Dies gilt für Hochrisiko-Patienten, für jüngere für die Transplantation geeignete, sowie für ältere für eine Transplantation nicht geeignete Patienten.
Große Aufmerksamkeit wurde der Präsentation von Katja Weisel zuteil, die die Ergebnisse einer Phase-II-Studie (GMMG-CONCEPT) mit Isatuximab und Carfilzomib-Lenalidomid-Dexamethason (Isa-KRd) bei Patienten mit Hochrisiko-Zytogenetik – del(17p), t(4;14), t(14;16) oder 1q21 (mehr als 3 Kopien) + ISS II oder III – präsentierte.3 Das Studienprotokoll sieht bei den TE-Patienten sechs Zyklen Isatuximab-KRd (Isa-KRd), gefolgt von ASCT und vier weiteren Konsolidierungszyklen mit Isa-KRd, vor. Danach erfolgt eine Erhaltungstherapie mit Isa-KR.
Bei den nicht für eine Transplantation geeigneten (TNE) Patienten wurden insgesamt zwölf Zyklen Isa-KRd verabreicht und dann die Patienten mit Isa-KR in der Erhaltungsphase weiter therapiert. Bei allen 50 Patienten (4 TNE, 46 TE) wurde ein Ansprechen beobachtet, wobei die Rate an ≥VGPR bei 90% und jenean ≥CR (komplette Remission) bei 46% lag. Die MRD-Rate (minimale Resterkrankung) lag bei jenen Patienten, bei denen eine diesbezügliche Testung vorlag, bei 60%. Die Behandlung wurde erstaunlich gut toleriert. Als wesentliche Limitation sind die derzeit noch geringe Fallzahl und ganz besonders das Fehlen eines Vergleichsarms anzuführen.
KRd wird gegenwärtig von vielen als das wirksamste Induktionsprotokoll angesehen. Die Erwartung einer Überlegenheit gegenüber VRd wurde aber in der ENDURANCE-Studie, die von Shaji Kumar bereits beim ASCO-Meeting präsentiert wurde, nicht erfüllt.4 In diese Studie wurden insgesamt 1087 Patienten, die nicht unmittelbar für eine Transplantation vorgesehen waren und eine Standardrisiko-Zytogenetik ohne t(14;20), t(14,16), del17p bzw. eine zweifach erhöhte LDH aufwiesen, eingebracht. Im Therapiearm A wurde VRd über insgesamt zwölf und im Arm B KRd über insgesamt neun Zyklen verabreicht. Anschließend wurden die Patienten in eine Lenalidomid-Erhaltungstherapie, begrenzt auf zwei Jahre, bzw. in eine Gruppe mit Lenalidomid-Erhaltungstherapie bis zum Progress oder zur Unverträglichkeit neu randomisiert. Die Rate an VGPR war zwar mit 73,8% im KRd-Arm im Vergleich zu 64,7% im VRd-Arm signifikant besser (p=0,002), bezüglich anderer Ansprechkategorien, wie CR, fand sich aber kein Unterschied. Das PFS lag nach einem Follow-up von 29 Monaten im VRd-Arm bei 34,4 und im KRd-Arm bei 34,6 Monaten. Bezüglich OS zeigte sich kein Unterschied; die Überlebensrate nach drei Jahren lag bei 84% im VRd- und bei 86% im KRd-Arm. Somit wurde die Erwartungshaltung nicht bestätigt; einschränkend könnte man argumentieren, dass KRd sein volles Potenzial dann ausspielen kann, wenn die Induktionstherapie nicht auf neun Zyklen begrenzt ist, sondern kontinuierlich weiter verabreicht werden kann.
Erhaltungstherapie bei Patienten ohne Transplantation
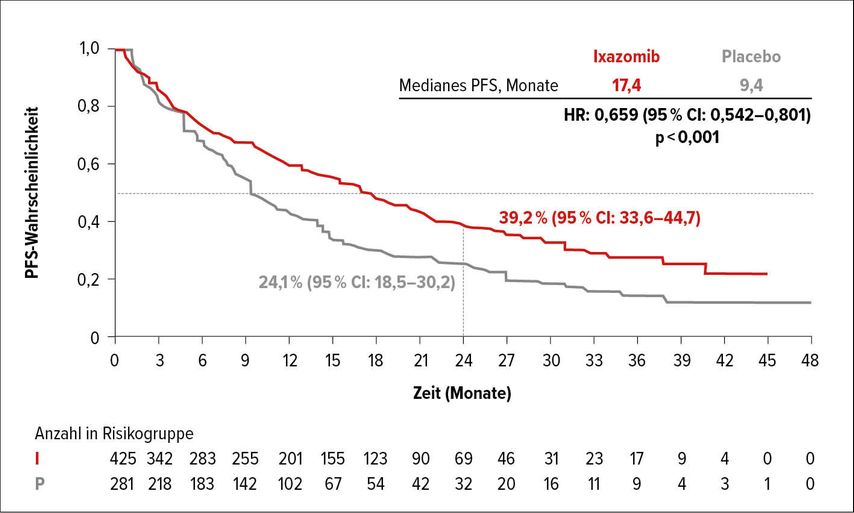
In der TOURMALINE-MM4-Studie wurden 702 Patienten, die eine Induktionstherapie über sechs bis zwölf Monate erhalten und eine ≥PR erreicht hatten, in eine Gruppe mit Ixazomib-Erhaltungstherapie (3mg Zyklus 1–4, danach bei guter Toleranz 4mg bis insgesamt 26 Zyklen) bzw. in eine Kontrollgruppe randomisiert.5 Mit Ixazomib konnte eine signifikante Verlängerung des PFS von 9,4 auf 17,4 Monate (p<0,001) erreicht werden (Abb. 1).
Vergleicht man die PFS-Raten vom Zeitpunkt des Behandlungsbeginns, so findet sich in der Erhaltungstherapie-Gruppe ein PFS von 26,3 Monaten im Vergleich zu 20,3 Monaten in der Kontrollgruppe. Auch dieser Unterschied ist hochsignifikant. Somit bietet sich Ixazomib als Alternative zu Lenalidomid für die Erhaltungstherapie bei Patienten ohne Transplantation an, nachdem zuvor schon in der TOURMALINE-MM3-Studie eine Verlängerung des PFS mit Ixazomib-Erhaltungstherapie bei Patienten nach ASCT gezeigt worden war.6 Leider liegen noch keine Subgruppenanalysen vor, die Hinweise darauf geben können, wie weit Hochrisiko-Patienten von der Ixazomib-Erhaltungstherapie profitieren.
Patienten mit relapsiertem/refraktärem multiplem Myelom mit 1–3 Vortherapien
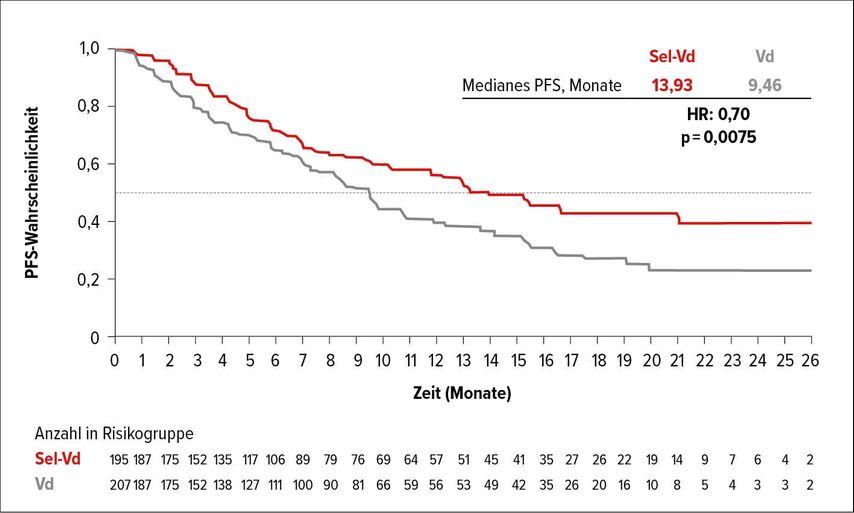
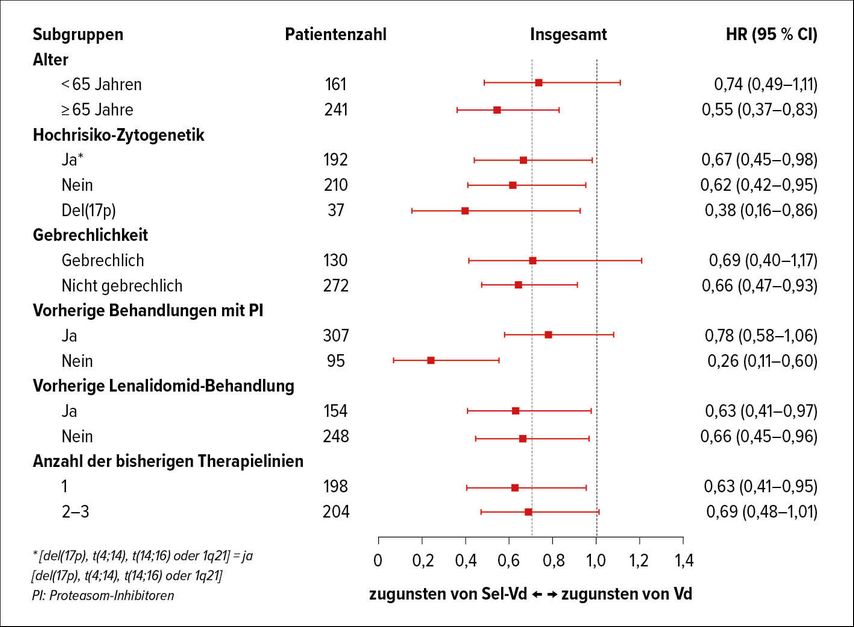
In dieser Indikation wurde beim EHA-Kongress die IKEMA-Studie7 und beim ASCO-Kongress die BOSTON-Studie8 vorgestellt. In letztgenannter Studie wurde die Wertigkeit von Selinexor in Kombination mit Vd evaluiert, wobei Selinexor als XPO-1-Inhibitor fungiert, wodurch der Export von Tumorsuppressor-Genen aus dem Zellkern behindert, jedoch jener von Onkoproteinen gefördert wird. Selinexor hat sich bereits als „Single agent“-Therapie (in Kombination mit Dexamethason) in der STORM-Studie bewährt, in der eine Remissionsrate von 29% bei multipel vorbehandelten Patienten erreicht werden konnte.9 Durch die Kombination mit Vd (Sel-Vd) zeigten sich nun eine Verbesserung der Gesamtansprechrate (76,4 vs. 62,3%) und eine Verbesserung von ≥VGPR auf 44,5 vs. 32,4%. Hervorzuheben ist, dass 80% der Patienten bereits mit Proteasominhibitoren und etwa 40% mit Lenalidomid vorbehandelt waren. Das PFS war mit fast 14 Monaten in der Sel-Vd-Gruppe dem der Kontrollgruppe mit Vd (9,5 Monate) signifikant überlegen (Abb. 2a). Eine Forest-Plot-Analyse machte deutlich, dass Patienten mit del17p besonders von der Behandlung profitierten (Abb. 2b). Eine weitere unerwartete Beobachtung betraf die positive Auswirkung von Selinexor auf die Polyneuropathie, die unter der Kombinationstherapie mit 32,3% deutlich seltener als im Vd-Arm (47,1%) beobachtet wurde. Allerding ist Selinexor mit verschiedenen unangenehmen Nebenwirkungen wie Müdigkeit, Übelkeit und Erbrechen verknüpft, weshalb ein umfassendes Supportivmanagement erforderlich ist.
Abb. 2a: Selinexor-Vd (Sel-Vd) führt im Vergleich zu Vd zu signifikant längerem PFS (nach Dimopoulos MA etal.)8
Abb. 2b: Forest-Plot-Analyse bezüglich PFS unter Selinexor-Vd oder Vd allein (nach Dimopoulos MA et al.)8
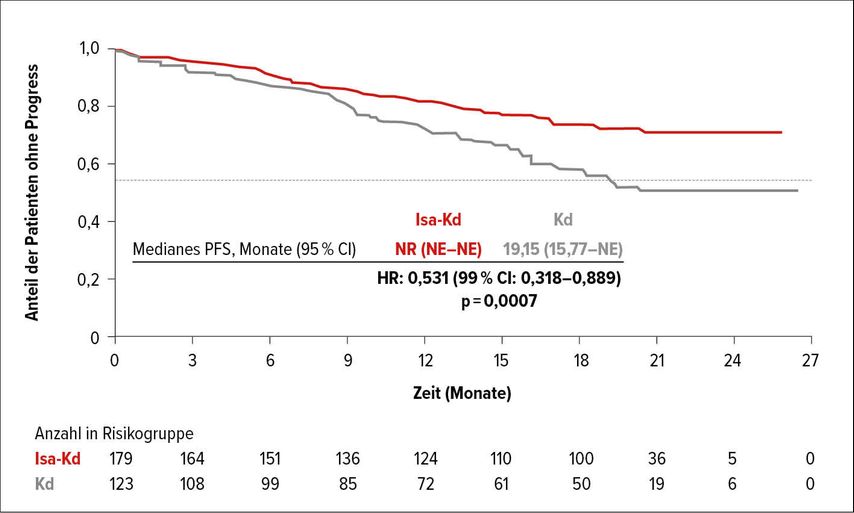
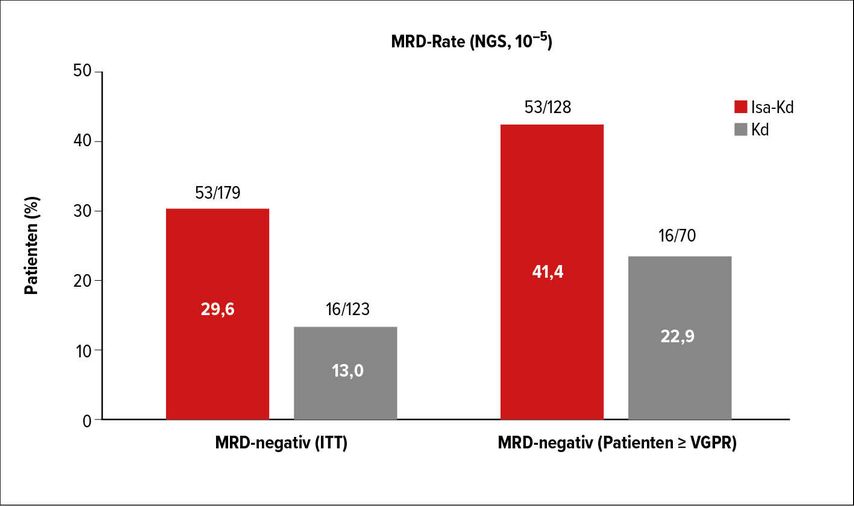
Die zweite neue Studie in der oben angegebenen Indikation wurde von Philippe Moreau als „late-breaking“ Abstract vorgestellt.7 In der sogenannten IKEMA-Studie wurden 302 Patienten entweder in einen Therapiearm mit Isatuximab-Kd (Isa-Kd) oder in eine Gruppe mit Kd-Therapie randomisiert. Die Ergebnisse zeigten eine deutliche Überlegenheit des Kombinationsarms sowohl in Bezug auf die Remissionsraten (88,6 vs. 82,9%) als auch in Bezug auf die MRD-Raten (29,6 vs. 13,0%). Der Median des PFS lag in der Kontrollgruppe bei 19,2 Monaten und wurde in der Kombinationsgruppe noch nicht erreicht (Abb. 3a+b). Die Hazard-Ratio von 0,53 zeigt, dass durch die Kombinationstherapie das Risiko für eine Progression um etwa 47% reduziert wird. Die Behandlung wurde exzellent vertragen, sodass sich Isatuximab nach den positiven Ergebnissen der ICARIA-Studie10 nun nicht nur als idealer Kombinationspartner für Pomalidomid-Dexamethason, sondern auch für Kd etabliert hat.
Abb. 3a: Isatuximab-Kd führt zu einer signifikanten Verlängerung des PFS im Vergleich zu Kd (nach Moreau P et al.)7
Neue Substanzen bzw. Therapiestrategien
Belantamab-Mafodotin steht nach den positiven Ergebnissen als „Single agent“-Therapie bei massiv vorbehandelten Patienten nun kurz vor der Registrierung. Mittlerweile wird Belantamab-Mafodotin als Backbone für verschiedenste Kombinationen in den sogenannten DREAMM-Protokollen evaluiert, wobei je nach Kombinationspartner Remissionsraten bei umfangreich vorbehandelten Patienten von bis zu 70% erreicht wurden.11 Eine bedeutende und nicht selten therapielimitierende Nebenwirkung ist allerdings die Cornea-Toxizität mit begleitender Konjunktivitis, die bei einem Teil der Patienten einen Therapieabbruch bzw. eine Verlängerung der Therapieintervalle erfordert.
San Miguel präsentierte die KarMMa-Studie mit Anti-BCMA-CAR-T-Zellen (Idecabtagene Vicleucel Anti-BCMA) bei 128 Patienten mit im Schnitt sechs Vortherapien und Resistenz auf die unmittelbare Vortherapie.12 Ein objektives Ansprechen wurde bei 73% und eine CR bei 31% der Patienten beobachtet, wobei höhere Zelldosen (450x 106/kg) zu höheren Ansprechraten (81%) führten. Das mediane PFS war mit 8,6 Monaten relativ kurz. An Nebenwirkungen standen Infektion und Zytokinsturm-Reaktionen (CIRS), gefolgt von Neurotoxizität, im Vordergrund. CAR-T-Zellen konnten bei 59% bzw. 36% der getesteten Patienten nach sechs bzw. zwölf Monaten nachgewiesen werden.
Noch bessere Ergebnisse wurden von Saad Usmani im Rahmen der CARTITUDE-1-Studie erzielt.13 Alle der 29 massiv vorbehandelten Patienten sprachen auf die CAR-T-Zell-Therapie an, 76% erreichten eine sCR (stringentes komplettes Ansprechen) und alle 16 auf MRD-Negativität getesteten Patienten erwiesen sich als MRD-negativ. Nach Ansicht der Autoren kann die Behandlung ambulant durchgeführt werden, allerdings sollte bei Auftreten von Symptomen eines CIRS eine zeitnahe Hospitalisierung erfolgen.
Weitere neue Substanzen
Weitere interessante neue Substanzen können aus Platzgründen nur kursorisch erwähnt werden. Dazu zählen TAK-079, ein Antikörper mit hoher Affinität zu CD38, der bei Daratumumab-naiven Patienten mit RRMM eine Ansprechrate von 56% erzielte, und Melflufen, ein Konjugat aus einem Peptid und Melphalan, das zu einer höheren intrazellulären Konzentration als Melphalan führt. Mit Melflufen als Monosubstanz wurde eine Ansprechrate von 32% bei Patienten mit RRMM erzielt.
Weiters erwähnenswert sind zwei neue IMiDs (Iberdomid, CC92480) mit ausgeprägter Wirkung bei Lenalidomid- bzw. Pomalidomid-resistenten Patienten. Mit Iberdomid-Dexamethason wurden Ansprechraten zwischen 31 und 34% und mit CC92480 von 48% bei Patienten mit RRMM berichtet.
Eine weitere vielversprechende Substanz ist CC-93269, ein bivalenter BiTE („bispecific T-cell engager“), der an zwei Epitope von BCMA sowie an CD3 bindet und in einer Phase-II-Studie zu einer Ansprechrate von erstaunlichen 78% geführt hat. Der BiTE AMG-701 steht dem aber keineswegs nach, da Daten aus einer Phase-I/II-Studie eine Ansprechrate von 100% zeigten.
Teclistamab ist ein sogenannter DuoBody©, der mit einem Fc-Teil BCMA und mit dem anderen CD3 bindet. Bei höherer Dosierung wurde damit bei einer noch kleinen Zahl von „Triple-class“-refraktären Patienten mit RRMM eine Ansprechrate von 67% erzielt.
Conclusio
Die oben angeführten Studienergebnisse verdeutlichen die kontinuierlichen Fortschritte bei der Entwicklung neuer wirksamer Therapien für Patienten mit multiplem Myelom – eine Erfolgsgeschichte, die zunehmend Fahrt aufnimmt.
Literatur:
1 Goldschmidt H et al.: Bortezomib, lenalidomide and dexamethasone with or without elotuzumab as induction therapy for newly-diagnosed, transplant-eligible multiple myeloma. EHA 2020, Abstr. #S203 2 Usmani S et al.: Primary analysis of the randomized phase II trial of bortezomib, lenalidomide, dexamethasone with/without elotuzumab for newly diagnosed, high risk multiple myeloma (SWOG-1211). EHA 2020, Abstr. #S201 3 Weisel K et al.: Depth of response to isatuximab, carfilzomib, lenalidomide and dexamethasone (Isa-KRd) in front-line treatment of high-risk multiple myeloma: interim analysis of the GMMG-CONCEPT trial. EHA 2020, Abstr. #S204 4 Kumar S et al.: Carfilzomib, lenalidomide, and dexamethasone (KRd) versus bortezomib, lenalidomide, and dexamethasone (VRd) for initial therapy of newly diagnosed multiple myeloma (NDMM): results of ENDURANCE (E1A11) phase III trial. ASCO 2020, Abstr. #LBA3 5 Dimopoulos MA et al.: Ixazomib vs placebo as post-induction maintenance therapy in newly diagnosed multiple myeloma (NDMM) patients (pts) not undergoing autologous stem cell transplant (ASCT): phase 3 TOURMALINE-MM4 trial. EHA 2020, Abstr. #S200 6 Dimopoulos MA et al.: Oral ixazomib maintenance following autologous stem cell transplantation (TOURMALINE-MM3): a double-blind, randomised, placebo-controlled phase 3 trial. Lancet 2019; 393(10168): 253-64 7 Moreau P et al.: Isatuximab plus carfilzomib and dexamethasone vs carfilzomib and dexamethasone in relapsed/refractory multiple myeloma (IKEMA): interim analysis of a phase 3, randomized, open-label study. EHA 2020, Abstr. #LB2603 8 Dimopoulos MA et al.: Weekly selinexor, bortezomib, and dexamethasone (SVd) versus twice weekly bortezomib and dexamethasone (Vd) in patients with multiple myeloma (MM) after one to three prior therapies: initial results of the phase III BOSTON study. ASCO 2020, Abstr. #8501 9 Chari A et al.: Oral selinexor–dexamethasone for triple-class refractory multiple myeloma. N Engl J Med 2019; 381(8): 727-38 10 Attal M et al.: Isatuximab plus pomalidomide and low-dose dexamethasone versus pomalidomide and low-dose dexamethasone in patients with relapsed and refractory multiple myeloma (ICARIA-MM): arandomised, multicentre, open-label, phase 3 study. Lancet 2019; 394(10214): 2096-107 11 ADCReview: Belantamab mafodotin, GSK2857916, Clinical Trials. www.adcreview.com/belantamab-mafodotin-gsk2857916-clinical-trials . Zuletzt aufgerufen am 22. Juli 2020 12 San Miguel J et al.: Idecabtagene vicleucel (IDE-CEL; BB2121), a BCMA-targeted CAR T cell therapy, in patients with relapsed and refractory multiple myeloma: intial KARMMA results. EHA 2020, Abstr. #S209 13 Usmani SZ et al.: Treatment of relapsed and refractory multiple myeloma with JNJ-4528, aB-cell maturation antigen (BCMA)-directed chimeric antigen receptor (CAR)-T-cell therapy: update of phase 1b results from CARTITUDE-1. EHA 2020, Abstr. #EP926
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...