Therapieoptionen bei rezidivierter/refraktärer AL-Amyloidose
Autoren:
Dr. Georg Jeryczynski1
Dr. Alexander Friedrich2
Assoc.-Prof. Priv.-Doz. Dr. Maria Krauth3
Priv.-Doz. Dr. Hermine Agis3
1 Klinik für Innere Medizin I, Abteilung für Onkologie, Medizinische Universität Wien
2 Klinik für Innere Medizin I, Abteilung für Palliativmedizin, Medizinische Universität Wien
3 Klinik für Innere Medizin I, Abteilung für Hämatologie und Hämostaseologie, Medizinische Universität Wien
Korrespondenz:
E-Mail: hermine.agis@meduniwien.ac.at
Die AL-Amyloidose (AL) zählt zu den seltenen Erkrankungen in der Hämatologie.1 Hervorgerufen wird die Krankheit durch extrazelluläre Ablagerungen von fehlgefalteten Proteinen. Im Falle der AL werden die Ablagerungen durch pathogene bzw. „toxische“ freie Leichtketten hervorgerufen. Produziert werden diese fehlgefalteten freien Leichtketten meistens von monoklonalen Plasmazellen im Rahmen einer Plasmazelldyskrasie. In selteneren Fällen werden die toxischen freienLeichtketten auch bei Lymphomerkrankungen gebildet.
Keypoints
-
Daratumumab ist eine hochwirksame Therapie bei Patienten mit vorbehandelter AL. Das gilt besonders für Patienten, die nicht mit einem Anti-CD38-Antikörper vorbehandelt wurden.
-
PI in Patienten mit rezidivierter/refraktärer AL wirken am besten, wenn die Patienten nicht mit PI vorbehandelt wurden.
-
Pomalidomid ist eine wirksame Therapie für Patienten mit rezidivierter/refraktärer AL. Es kommt zu einem IMiD-induzierten Anstieg der kardialen Biomarker. Vorsicht vor Fehlinterpretation.
-
Ca. 50% der AL-Patienten weisen die Translokation t(11;14) auf und respondieren sehr gut auf Venetoclax.
Bis vor Kurzem gab es keine zugelassenen Medikamente für die Behandlung einer AL. Trotzdem wurden Therapien verabreicht, hauptsächlich mit Medikamenten, die aus der Behandlung des multiplen Myeloms bekannt waren.
Im Jänner 2021 wurde von der Food and Drug Administration (FDA) in den USA erstmalig eine Antikörper-basierte Kombinationstherapie aus Daratumumab, Bortezomib, Cyclophosphamid und Dexamethason zur Therapie einer neu diagnostizierten AL zugelassen.2 Im Juli 2021 wurde diese Zulassung auch durch die European Medicines Agency (EMA) erteilt.3
Diese Entscheidungen wurden auf Basis der Daten aus der ANDROMEDA-Studie (NCT03201965; eine internationale, multizentrische Phase-III-Studie bei neu diagnostizierter AL) gefällt.4 Mit dieser Antikörper-basierten Kombinationstherapie ist ein großer Sprung in der Behandlung der Patienten mit einer neu diagnostizierten AL gelungen. Für die Patienten mit einer refraktären Erkrankung oder mit einem Rezidiv gibt es weiterhin keine speziell zugelassenen Therapieoptionen. Es kommen daher auch in dieser Situation Therapieregime zum Einsatz, die bekannt sind von der Behandlung von multiplen Myelomen und für die es zumindest Daten aus kleinen Fallserien und aus Phase-I- bzw. -II-Studien gibt.
Antikörper-basierte Therapien
Anti-CD38-Antikörper: Daratumumab
Dass die ANDROMEDA-Studie überhaupt möglich wurde, beruht auf den Erfolgen des Anti-CD38-Antikörpers Daratumumab im Einsatz bei Patienten mit multiplen Myelomen. Bei Patienten mit multiplem Myelom, die für eine autologe Stammzelltherapie nicht geeignet sind, ist Daratumumab sogar in der Erstbehandlung zugelassen. Es wurden auch erste Erfahrungen bei Patienten mit mehrfach rezidivierter und vorbehandelter AL-Amyloidose gesammelt.
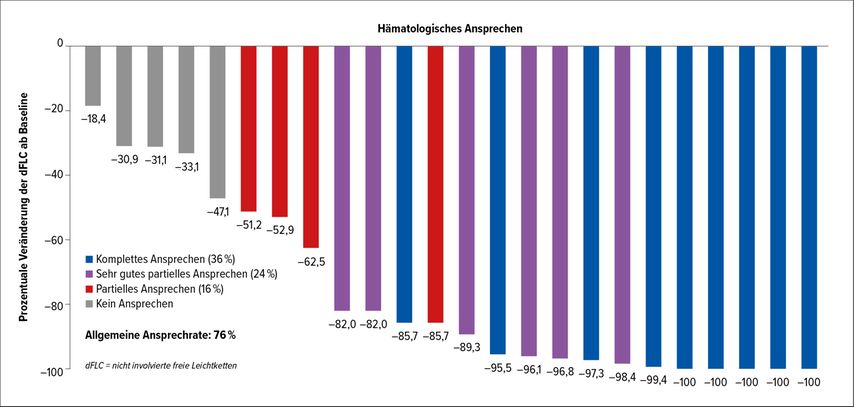
2016 wurden die ersten positiven Ergebnisse mit Daratumumab in der Behandlung von zwei Patienten mit rezidivierter AL publiziert.5 2017 wurde bereits eine retrospektive Fallserie von 25 Patienten mit rezidivierter AL und Daratumumab-Therapie veröffentlicht.6 In dieser Fallserie konnte die Wirksamkeit sogar (vorbehaltlich der kleinen Fallzahl) quantifiziert werden: Bei 100% der Patienten kam es zu einer Reduktion der Differenz der freien Leichtketten (dFLC). Die Rate des allgemeinen Ansprechens (ORR) lag bei 76%, davon 36% Complete Responses (CR), 24% Very Good Partial Responses (VGPR) und 16% Partial Responses (PR).
Es hat sich auch gezeigt, dass die Wirkung der Antikörper-Therapie sehr rasch einsetzt. Als mittlere Zeitspanne bis zu den ersten Zeichen eines Ansprechens wurde ein Monat angegeben (Abb. 1).
Abb. 1: Waterfall Plot der prozentualen Reduktion der nicht involvierten freien Leichtketten unter Daratumumab in 24 auswertbaren Patienten. Bei allen Patienten konnte eine Reduktion festgestellt werden (modifiziert nach Kaufman et al.)24
Bisher wurden keine Daten einer Phase-III-Studie mit Daratumumab bei Patienten mit einer rezidivierten AL veröffentlicht. Es wurde 2021 eine Zusammenfassung aller größeren retrospektiven Fallserien von Palladini et al. publiziert. Um in diese Beobachtungsstudie eingeschlossen zu werden, musste die Fallserie zumindest zehn oder mehr Patienten beinhalten, die zumindest eine Vorbehandlung erhalten hatten. Insgesamt wurden in dieser Zusammenfassung 627 Patienten evaluiert, wovon 496 Patienten Daratumumab als Monotherapie und 131 Daratumumab im Rahmen einer Kombinationstherapie erhalten hatten. Unabhängig davon, ob Daratumumab als Monotherapie oder in einer Kombination verabreicht wurde, ergaben die hämatologischen ORR nahezu die gleichen Resultate von 76% und 73%.
Es wurden auch zwei prospektive Phase-II-Analysen zum Einsatz von Daratumumab durchgeführt und veröffentlicht, allerdings mit niedrigen Patientenzahlen (22 und 40 Studienteilnehmer).7,8 Auch im prospektiven Setting ergaben die Therapien mit Daratumumab gute Ergebnisse mit hämatologischen VGPR- und CR-Raten von 86% und 36%.
Die Antikörper-Therapie wurde sehr gut vertragen und erbrachte ein rasches hämatologisches Ansprechen innerhalb weniger Wochen. Auch eine entsprechende Verbesserung der Organfunktionen konnte verzeichnet werden. Das progressionsfreie Überleben (PFS) lag im Median bei 28 Monaten.
Anti-CD38-Antikörper: Isatuximab
Isatuximab ist ebenfalls ein Anti-CD38-Antikörper und wurde und wird auf seine Wirksamkeit bei Patienten mit rezidivierter/refraktärer AL getestet. In einer prospektiven, multizentrischen Phase-II-Studie (SWOG S1702) zeigte Isatuximab mit einem Ansprechen bei 27 von 35 Patienten eine ORR von 77%. Die 1-Jahres-PFS-Rate lag bei 85% und die 1-Jahres-Rate des Gesamtüberlebens (OS) bei 97% (diese Daten wurden von der Firma Sanofi zur Verfügung gestellt).
Anti-SLAMF7-Antikörper Elotuzumab & Anti-BCMA-Antikörper Belantamab-Mafodotin
Beide monoklonalen Antikörper sind ebenfalls gegen Plasmazelloberflächenantigene gerichtet. Elotuzumab ist gegen SLAMF7 gerichtet und Belantamab-Mafodotin gegen BCMA („B cell maturation antigen“). Belantamab ist ein monoklonaler Antikörper, der mit dem Zelltoxin Mafodotin kombiniert ist.
Für beide Antikörper liegen noch keine ausreichenden Daten vor. Zur Evaluierung von Balantamab-Mafodotin läuft eine EMN(EMN27)-Studie, die derzeit rekrutiert (NCT04617925).
Proteasom-Inhibitoren-basierte Therapien
Bortezomib
Der am häufigsten angewendete und daher am besten bekannte Proteasom-Inhibitor (PI) ist Bortezomib. Dieses Medikament wird bei den meisten Patienten mit AL bereits in der Erstlinientherapie angewendet.
Im Rahmen einer Rezidiv-Erkrankung kann zwar wieder ein Ansprechen auf Bortezomib erreicht werden, aber es besteht auch das Risiko einer Resistenzentwicklung mit Refraktärität. Wenn es die Möglichkeit gibt, eine andere Substanz zu verwenden, dann ist die Empfehlung, im Rezidiv darauf auszuweichen.
Ixazomib
Ixazomib ist ein oraler PI der dritten Generation, der 1x pro Woche oral eingenommen wird. 2017 wurde dazu bereits eine Phase-I/II-Studie mit 21 Patienten mit rezidivierter AL veröffentlicht. Die hämatologische ORR lag bei 53%, die Organ-Response-Rate bei kardialer Beteiligung war bei 45% und bei renaler Beteiligung ebenfalls bei 45%.9
Basierend auf diesen sehr guten Ausgangsdaten wurde eine Phase-III-Studie initiiert: TOURMALINE-AL1 (NCT01659658). In dieser Studie wurde Ixazomib kombiniert mit Dexamethason verglichen mit der Standardtherapie nach Wahl des Behandlers („physician’s choice of standard regimen“). Diese Phase-III-Studie wurde vorzeitig beendet, da der primäre Endpunkt ORR nicht erreicht wurde.
Es zeigte sich aber dennoch eine gute Wirksamkeit von Ixazomib bei jenen Patienten, die nicht mit einem PI vorbehandelt waren.10 Diese Patienten hatten eine höhere hämatologische CR-Rate und das Ansprechen hielt auch länger an.
Derzeit laufen zwei Studien mit Ixazomib bei der AL. In einer Studie wird Ixazomib in Kombination mit einem Anti-CD38-Antikörper untersucht: Ixazomib, Daratumumab und Dexamethason bei AL-Amyloidose (NCT03283917) sowohl bei neu diagnostizierten Patienten als auch bei Patienten mit einer relapsierten Erkrankung.
Die zweite Studie untersucht die Wirksamkeit eines vollständig oralen Regimes mit Venetoclax, Ixazomib und Dexamethason (NCT04847453) für Patienten mit einer rezidivierten/refraktären AL. Für beide Studien liegen zu diesem Zeitpunkt noch keine Daten vor.
Carfilzomib
Carfilzomib gilt als sehr potenter PI der zweiten Generation bei Patienten mit einem rezidivierten multiplen Myelom. Carfilzomib wird i.v. verabreicht und führt zu einer irreversiblen Hemmung des Proteasoms. Aus der Anwendung bei Patienten mit multiplem Myelom ist bekannt, dass unter der Therapie mit Carfilzomib kardiotoxische Nebenwirkungen auftreten können, ebenso wie nicht vorhersehbare lebensbedrohliche thrombotische Mikroangiopathien (TMA). Aufgrund dieser Nebenwirkungen hat man gezögert, Carfilzomib bei Patienten mit AL einzusetzen, besonders bei jenen Patienten mit kardialer Beteiligung.
Es wurde 2016 beim Meeting der American Society of Hematology eine Phase-I/II-Studie vorgestellt,11 in der die Sicherheit und die Wirkung von Carfilzomib bei 28 Patienten mit vorbehandelter AL untersucht wurden. Es wurde im ersten Zyklus eine Dosis von 20mg/m2 an den Tagen 1+2 verabreicht, an den nachfolgenden Tagen und Zyklen eine Dosis von 36mg/m2 an den Tagen 8+9 und 15+16.
Die Auswertung ergab eine ORR von 63%, allerdings bei einer Nebenwirkungsrate von 46% mit einem Schweregrad von 3–4. Es handelte sich dabei hauptsächlich um kardiale und pulmonale Probleme, die bei Patienten mit kardialer AL oder mehr Organbeteiligung auftraten.
In der A.R.R.O.W.-Studie wurde die 1x wöchentliche Gabe von Carfilzomib mit der 2x wöchentlichen Gabe bei Patienten mit rezidiviertem/refraktärem multiplem Myelom verglichen. Im Rahmen dieser Analyse wurde auch eine kleine Gruppe von AL-Patienten (insgesamt 5) untersucht.
Es wurden Carfilzomib-Dosen zwischen 20mg/m2 und 56mg/m2 gemäß Protokoll einmal pro Woche verabreicht. In der 1x wöchentlichen Gabe wurde Carfilzomib besser vertragen und es wurde ein sehr rasches Ansprechen mit einem hohen Prozentsatz von kompletten Remissionen beschrieben. Einschränkend muss jedoch auf die sehr geringe Patientenzahl hingewiesen werden.12
Von einer Therapie mit Carfilzomib werden hauptsächlich jene Patienten profitieren, die keine kardiale Beteiligung und nur wenige vorgeschädigte Organe aufweisen. Diese Patienten sind zumeist jene mit einer hauptsächlich autonomen und AL-bedingten Polyneuropathie.13
IMiD („immunomodulatory drugs“)
Thalidomid
Thalidomid zeigte bei Patienten mit AL nur eine mäßige Wirksamkeit bei ausgeprägten Bradykardien und Rhythmusstörungen. Es wird derzeit nicht mehr verwendet.14
Lenalidomid
Es ist eine durchaus wirksame Therapie in der Behandlung der rezidivierten/refraktären AL, besonders wenn Refraktärität gegenüber anderen Substanzklassen vorliegt. Es muss allerdings dringend darauf hingewiesen werden, dass die Dosierung nicht von den Patienten mit multiplem Myelom übernommen werden darf. Lenalidomid mit 25mg 1x1/Tag wird von Patienten mit rezidivierter/refraktärer AL sehr schlecht vertragen. Die Dosis sollte bei 15mg oder darunter liegen.
Dabei muss unbedingt bedacht werden, dass Lenalidomid renal eliminiert wird und dass sich unter dieser Therapie eine Verschlechterung der Nierenfunktion ergeben kann, die teilweise bis zur Dialysepflichtigkeit führt. Auch die kardialen Biomarker TnT und NTproBNP steigen unter einer Lenalidomid-Therapie an.
Pomalidomid
Pomalidomid ist derzeit das neueste IMiD mit Zulassung für Patienten mit rezidiviertem/refraktärem multiplem Myelom. Es zeigt auch eine hohe Wirksamkeit bei Patienten mit AL.15 Auch bei Patienten, die mit Lenalidomid vorbehandelt wurden, zeigt Pomalidomid Wirksamkeit.
Pomalidomid ist bzgl. der Response-Raten gut vergleichbar mit Lenalidomid, allerdings bei einem besseren Sicherheitsprofil und einer besseren Verträglichkeit. Pomalidomid ist bei AL das derzeit am häufigsten verwendete IMiD, da auch die maximal tolerierte Dosis mit 4mg pro Tag ähnlich ist wie beim multiplen Myelom.
Auch bei Pomalidomid kommt es zu einem paradoxen Anstieg der kardialen Biomarker, ohne dass eine Progression der Grunderkrankung vorliegt. Das erschwert und behindert die korrekte Organ-Response-Beurteilung.
Allgemein gute Wirksamkeit
Im Allgemeinen haben IMiD und besonders Pomalidomid eine sehr gute Wirkung bei Patienten mit rezidivierter/refraktärer AL. Es gibt eine Veröffentlichung von 2019 von Sanchorawala et al. über die Wirksamkeit von allen ImiDs. Es wurden dafür gepoolte Daten aus 3 Publikationen mit 125 Patienten zusammengefasst.16 Weiters gibt es eine rezente Phase-II-Studie von Milani et al. von 2020 zur Wirksamkeit von Pomalidomid17 bei 153 vorbehandelten Patienten mit AL. Die hämatologischen ORR in beiden Studien lagen zwischen 40 und 60%.
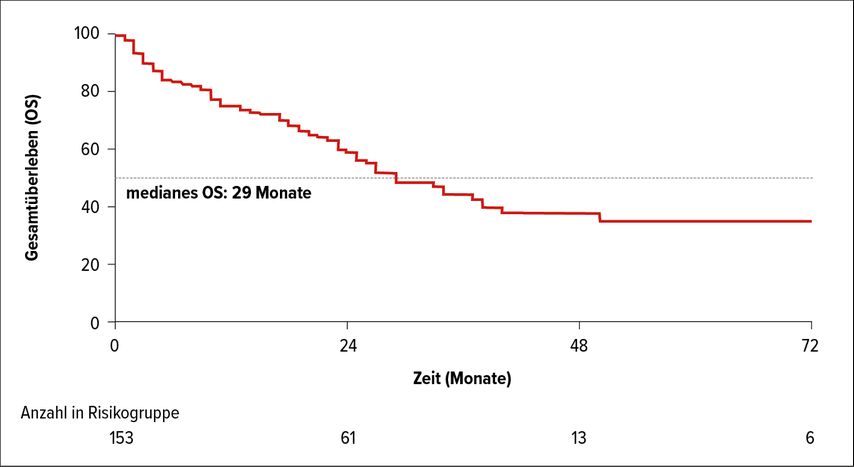
Die Patienten, die eine Behandlung mit Pomalidomid erhielten, zeigten mit 33% eine höhere Rate an kompletten Remissionen als jene Patienten, die mit Thalidomid oder Lenalidomid behandelt wurden. Das mediane OS bzw. PFS in den gepoolten Daten der Arbeit von Sanchorawala lag bei 4,3 bzw. 2,1 Jahren.16 Auch bei Milani lag in der Phase-II-Studie das mediane OS bei Patienten mit einer hämatologischen ORR bei 50 Monaten und bei jenen ohne Response bei 25 Monaten (Abb. 2).
Fallstricke der IMiD-Therapie
Bei Patienten mit einer AL und einer IMiD-basierten Therapie gibt es einige Fallstricke zu beachten:
-
Unter einer IMiD-Therapie kommt es zu einem „paradoxen“ Anstieg der kardialen Biomarker (TnT und NTproBNP). Dieser Anstieg darf nicht als Progression der Erkrankung gewertet werden.
-
Unter einer IMiD-Therapie besteht die Gefahr eines sekundären Malignoms.
-
Nach einer Organtransplantation ist die Gabe von IMiD eher zu vermeiden oder mit großer Vorsicht in die Wege zu leiten, da bereits Case Reports zu akuter Organabstoßung unter IMiD-Therapie publiziert wurden.
Für die Zukunft gibt es zwei neue und sehr spannende Untersuchungen mit Pomalidomid, einerseits Pomalidomid in Kombination mit Daratumumab in Patienten mit rezidivierter/refraktärer AL (NCT04895917) und andererseits Pomalidomid in Kombination mit Daratumumab in Patienten, die zuvor bereits mit Daratumumab behandelt wurden (NCT04270175).
Zukünftige Therapieoptionen
Venetoclax
Bei Venetoclax handelt es sich um einen oralen BCL-2-Inhibitor, der für die Behandlung von chronischer lymphatischer und akuter myeloischer Leukämie zugelassen wurde. Während der letzten Jahre wurde die Expression von antiapoptotischen Proteinen bei Patienten mit multiplen Myelomen mit großem Interesse untersucht und Venetoclax eingesetzt.
Besonders erfolgreich war diese Substanz bei Patienten mit einer Translokation t(11;14).18 Ca. 20% der Patienten mit multiplem Myelom weisen diese genetische Veränderung auf. Bei den Patienten mit AL weisen ca. 50% der Erkrankten diese Mutation auf.19
Bereits 2018 gab es die ersten Fallbeobachtungen, die darauf hinwiesen, dass Venetoclax bei Patienten mit vorbehandelter AL komplette Remissionen erreichen konnte.20 2020 wurde eine Fallserie mit 12 Patienten mit AL-Amyloidose und t(11;14) und Venetoclax-Therapie veröffentlicht. Die Therapie wurde gut vertragen und 4 Patienten mit rezidivierter/refraktärer AL erreichten eine komplette Remission und drei eine VGPR.21
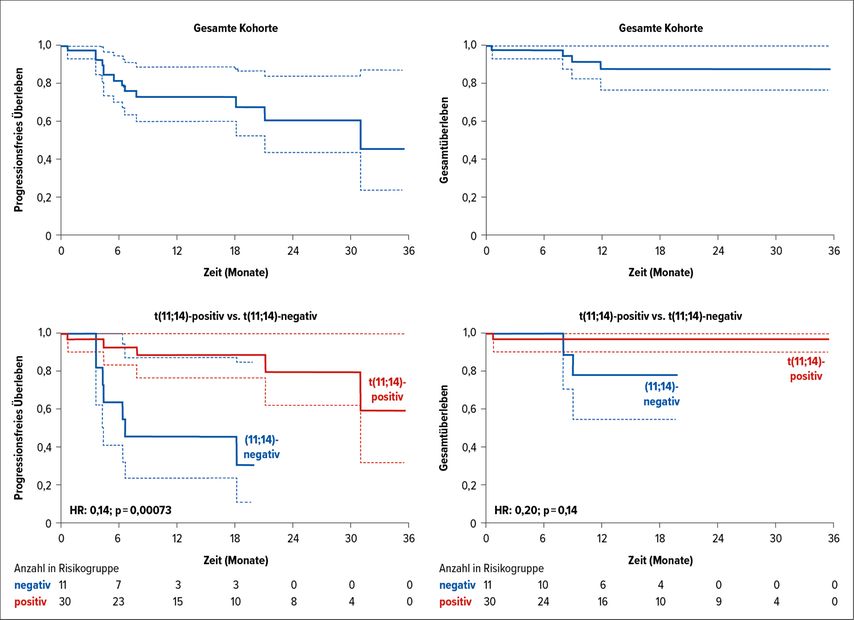
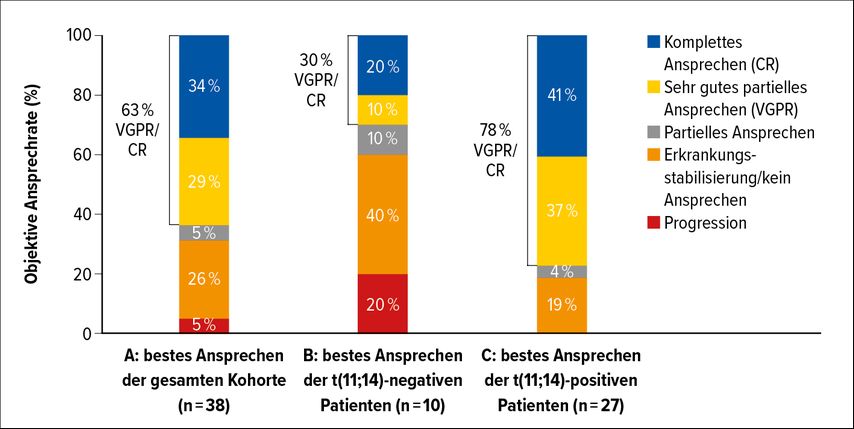
2021 konnte die hervorragende Wirkung von Venetoclax in bereits 43 Patienten mit rezidivierter/refraktärer AL unterstrichen werden. 31 Patienten aus dieser Kohorte exprimierten t(11;14), 11 Patienten waren negativ und bei einem Patienten war das zytogenetische Resultat nicht erhebbar. Für die gesamte Gruppe war die ORR 68% und 63% erreichten eine VGPR/CR.
Von jenen Patienten, die t(11;14)-positiv waren, erreichten sogar 81% eine ORR vs. 40% von den t(11;14)-negativen Patienten. Ebenso war die VGPR/CR-Rate unter den t(11;14)-positiven Patienten höher als bei den negativen – 78% vs. 30% (Abb. 4).
Diese guten Response-Raten bilden sich auch im PFS und im OS ab. In der gesamten Kohorte lag das mediane PFS bei 31 Monaten, das mediane OS wurde noch nicht erreicht. In der Gruppe der t(11;14)-positiven AL-Patienten wurde weder das mediane PFS noch das mediane OS erreicht (Abb. 3).
Insgesamt ist Venetoclax eine große Hoffnung für die nahe Zukunft. Allerdings müssen die Daten erst in einer Phase-III-Studie überprüft und bestätigt werden.
Abb. 3: Kaplan-Meier-Kurven zu PFS und OS. A: PFS der gesamten Kohorte, B: OS der gesamten Kohorte, C: PFS der t(11;14)-positiven Patienten im Vergleich zu den t(11;14)-negativen, D: OS der t(11;14)-positiven Patienten im Vergleich zu den t(11;14)-negativen (modifiziert nach Premkumar et al.)22
Derzeit laufende Studien
Wie bereits bei Ixazomib aufgelistet gibt es eine sehr spannende Phase-I/Ia-Studie zur Dosisfindung und Verträglichkeit eines vollständig oralen Regimes mit Venetoclax, Ixazomib und Dexamethason (NCT04847453) für Patienten mit einer rezidivierten/refraktären AL. Zusätzlich gibt es ein Expanded-Access-Programm für t(11;14)-positive Myelome. AL-Amyloidosen sind ebenfalls inkludiert.
CAR-T-Zellen
Zu den CAR-T-Zellen gibt es eine sehr spannende Publikation: In diesem präklinischen Projekt wurden Mäuse, die zuerst mit Myelomzellen oder Amyloid-produzierenden Zellen transplantiert wurden, anschließend einer CAR-T-Zell-Therapie unterzogen.23
Bei jenen Mäusen, die mit dem speziellen CAR-T-Zell-Produkt behandelt wurden, zeigte sich eine beeindruckende Rückbildung der Myelom-bedingten Läsionen und auch der Amyloid-assoziierten Veränderungen im Vergleich zur Kontrollgruppe.
Es gibt derzeit keine laufenden Studien mit CAR-T-Zell-Therapien bei Patienten mit AL. Allerdings besteht großes Interesse an den Wirkungen und Nebenwirkungen, die diese Form der zellbasierten Therapie bei Patienten mit AL ergeben könnten.
Literatur:
1 Merlini G et al.: Systemic immunoglobulin light chain amyloidosis. Nat Rev Dis Primers 2018; 4(1): 38 2 „FDA grants accelerated approval to Darzalex Faspro for newly diagnosed light chain amyloidosis“; 15.1.2021 3 „EMA grants approval to Darzalex Faspro for newly diagnosed light chain amyloidosis“; 24.6.2021. Online auf: https://www.ema.europa.eu/en/medicines/human/summaries-opinion/darzalex-2 4 Palladini G et al.: Daratumumab plus CyBorD for patients with newly diagnosed AL amyloidosis: safety run-in results of ANDROMEDA. Blood 2020; 136(1): 71-80 5 Sher T et al.: First report of safety and efficacy of daratumumab in 2 cases of advanced immunoglobulin light chain amyloidosis. Blood 2016; 128(15): 1987-9 6 Kaufman GP et al.: Daratumumab yields rapid and deep hematologic responses in patients with heavily pretreated AL amyloidosis. Blood 2017; 130(7): 900-2 7 Sanchorawala V et al.: Safety, tolerability, and response rates of daratumumab in relapsed AL amyloidosis: results of a phase 2 study. Blood 2020; 135(18): 1541-7 8 Roussel M et al.: A prospective phase 2 trial of daratumumab in patients with previously treated systemic light-chain amyloidosis. Blood 2020; 135(18): 1531-40 9 Sanchorawala V et al.: A phase 1/2 study of the oral proteasome inhibitor ixazomib in relapsed or refractory AL amyloidosis. Blood 2017; 130(5): 597-605 10 Dispenzieri A et al.: A randomized phase 3 study of ixazomib-dexamethasone versus physician’s choice in relapsed or refractory AL amyloidosis. Leukemia 2021; online ahead of print 11 Cohen AD et al.: Safety and efficacy of carfilzomib (CFZ) in previously-treated systemic light-chain (AL) amyloidosis. Blood 2016; 128(22): 645 12 Moreau P et al.: Once weekly versus twice weekly carfilzomib dosing in patients with relapsed and refractory multiple myeloma (A.R.R.O.W.): interim analysis results of a randomised, phase 3 study. Lancet Oncol 2018; 19(7): 953-64 13 Manwani R et al.: Carfilzomib is an effective upfront treatment in AL amyloidosis patients with peripheral and autonomic neuropathy. Br J Haematol 2019; 187(5): 638-41 14 Seldin DC et al.: Tolerability and efficacy of thalidomide for the treatment of patients with light chain-associated (AL) amyloidosis. Clin Lymphoma 2003; 3(4): 241-6 15 Sanchorawala V et al.: Pomalidomide and dexamethasone in the treatment of AL amyloidosis: results of a phase 1 and 2 trial. Blood 2016; 128(8): 1059-62 16 Sanchorawala V et al.: Long term outcome of patients treated on clinical trials of immunomodulatory agents for the treatment of immunoglobulin light chain (AL) amyloidosis: a pooled analysis. Am J Hematol 2019; 94(7): E194-6 17 Milani P et al.: Pomalidomide and dexamethasone grant rapid haematologic response in patients with relapsed and refractory AL amyloidosis: a European retrospective series of 153 patients. Amyloid 2020; 27(4): 231-6 18 Kumar S et al.: Efficacy of venetoclax as targeted therapy for relapsed/refractory t(11;14) multiple myeloma. Blood 2017; 130(22): 2401-9 19 Muchtar E et al.: Interphase fluorescence in situ hybridization in untreated AL amyloidosis has an independent prognostic impact by abnormality type and treatment category. Leukemia 2017; 31(7): 1562-9 20 Leung N et al.: Venetoclax induced a complete response in a patient with immunoglobulin light chain amyloidosis plateaued on cyclophosphamide, bortezomib and dexamethasone. Haematologica 2018; 103(3): e135-e7 21 Sidiqi MH et al.: Venetoclax for the treatment of translocation (11;14) AL amyloidosis. Blood Cancer J 2020; 10(5): 55 22 Premkumar VJ et al.: Venetoclax induces deep hematologic remissions in t(11;14) relapsed/refractory AL amyloidosis. Blood Cancer J 2021; 11(1): 10 23 Rosenzweig M et al.: Preclinical data support leveraging CS1 chimeric antigen receptor T-cell therapy for systemic light chain amyloidosis. Cytotherapy 2017; 19(7): 861-6 24 Kaufman GP et al.: Daratumumab yields rapid and deep hematologic responses in patients with heavily pretreated AL amyloidosis. Blood 2017; 130(7): 900-2
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...