Therapieoptimierung mit immunonkologischer und zielgerichteter Strategie
Bericht:
Dr. Ine Schmale
Seit etwa 10 Jahren bilden die immunonkologische und die zielgerichtete Therapie die beiden Hauptsäulen in der Behandlung des Melanoms. Mit diesen beiden Strategien wurde die Prognose der Melanompatienten deutlich verbessert und viele Patienten erreichen ein Langzeitüberleben. Bei der Jahrestagung der European Society for Medical Oncology (ESMO) wurden Studien zur weiteren Optimierung der Melanomtherapie präsentiert.
Adjuvante Pembrolizumab-Therapie verlängert rezidivfreie Zeit
Bei Patienten mit Melanom im Stadium IIB und IIC besteht ein hohes Rezidivrisiko, bei einer mit den Stadien IIIA und IIIB vergleichbaren Überlebenswahrscheinlichkeit. In der Phase-III-Studie KEYNOTE-716 wurde randomisiert, doppelblind und placebokontrolliert die Pembrolizumab-Monotherapie bei 976 Patienten mit neu diagnostiziertem, reseziertem Melanom im Stadium IIB und IIC geprüft.1 Primärer Endpunkt war das rezidivfreie Überleben (RFS) laut Bewertung der Prüfärzte. Die Patienten beider Studienarme waren median 60 bzw. 61 Jahre alt und wiesen in 63,4 bzw. 64,6% der Fälle ein Stadium IIB auf. Mit einer medianen Nachbeobachtungszeit von 14 Monaten wurde eine signifikante Verlängerung des RFS durch Pembrolizumab beobachtet (HR: 0,65; 95% CI: 0,46–0,92; p=0,00658). Nach 12 Monaten waren 90,5 versus 83,1% der Patienten rezidivfrei. Therapieassoziierte Nebenwirkungen wurden für 79,9 versus 60,9% der Patienten berichtet, bei 16,1 versus 4,3% waren diese von Grad 3–4. 15,3 versus 2,5% der Patienten brachen die Therapie aufgrund von therapieassoziierten Nebenwirkungen ab. Es wurde zu keinem Zeitpunkt ein signifikanter Unterschied in der Lebensqualität zwischen den Patienten beider Studienarme beobachtet. Das günstige Nutzen-Risiko-Profil spreche für den adjuvanten Einsatz von Pembrolizumab bei Patienten mit Hochrisiko-Stadium-II-Melanom, resümierten die Autoren.
Nivolumab plus Ipilimumab wirksam bei Hirnmetastasen
Die finalen 3-Jahres-Daten der Studie CheckMate 204 bestätigen die Immuntherapie für die Behandlung von Patienten mit Hirnmetastasen.2 In der CheckMate-204-Studie wurden in zwei Kohorten Melanompatienten mit asymptomatischen bzw. symptomatischen Hirnmetastasen mit 4 Zyklen Nivolumab (1mg/kg, q3w) plus Ipilimumab (3mg/kg, q3w) gefolgt von einer Nivolumab-Monotherapie (3mg/kg, q2w) behandelt. Die Studienmedikation wurde bis zum Progress oder bis zu nicht akzeptabler Toxizität, aber maximal 24 Monate gegeben. Primärer Endpunkt war die klinische Krankheitskontrolle (komplettes oder partielles Ansprechen oder stabile Erkrankung ≥6 Monate).
Bei den asymptomatischen Patienten (n=101) zeigten laut Prüfarztbericht 33% (BICR [„blinded independent central review“]: 26%) ein komplettes intrakranielles Ansprechen (CR), 21% (24%) ein partielles Ansprechen (PR) und 4% (4%) eine stabile Erkrankung (SD). Die Ansprechrate betrug somit 53% (BICR: 50%) und die klinische Kontrollrate 57% (53%). Mit einer medianen Nachbeobachtungszeit von 34,2 Monaten war die mediane Dauer des Ansprechens noch nicht erreicht. Nach 24 Monaten waren von den asymptomatischen Patienten 54% (Prüfärzte) bzw. 52% (BICR) ohne Progress und 75% am Leben. Auch nach 36 Monaten lebten 54% bzw. 52% der Patienten ohne Progress, die Gesamtüberlebens(OS)-Rate betrug 72%.
Symptomatische Patienten (n=18) hatten in 17% der Fälle ein komplettes intrakranielles Ansprechen. Es wurde laut Prüfärzten keine PR oder SD gesehen und laut BICR bei einem Patienten ein partielles Ansprechen (6%), aber ebenfalls keine SD. Auch für diese Patienten war ein Median bezüglich der Dauer des Ansprechens noch nicht erreicht. Die Rate des progressionsfreien Überlebens (PFS) betrug 19% (BCIR: 28%) sowohl nach 24 als auch 36 Monaten. Nach 24 Monaten lebten 44% und nach 36 Monaten 37% der Patienten.
Duale Blockade mit LAG-3-Inhibitor Relatlimab plus Nivolumab
Mit dem Checkpoint-Inhibitor Relatlimab wird eine weitere Optimierung der Melanomtherapie entwickelt. Relatlimab ist ein humaner LAG-3-gerichteter Antikörper, der die Effektorfunktion von ermüdeten T-Zellen wiederherstellt. Da LAG-3 und PD-1 häufig gemeinsam auf tumorinfiltrierenden Lymphozyten exprimiert werden, wurde ein synergistischer Effekt der doppelten Inhibition vermutet. Die randomisierte, doppelblinde Phase-II/III-Studie RELATIVITY-047 untersuchte bei 714 unbehandelten Patienten mit nicht resezierbarem oder metastasiertem Melanom die Therapie mit Relatlimab plus Nivolumab versus die Nivolumab-Monotherapie.3 Primärer Studienendpunkt war das PFS. In hierarchischer Reihenfolge wurden PFS, OS und anschließend das Ansprechen (ORR) analysiert. Die Studie verblieb über die Zeit der OS- und ORR-Analyse verblindet.
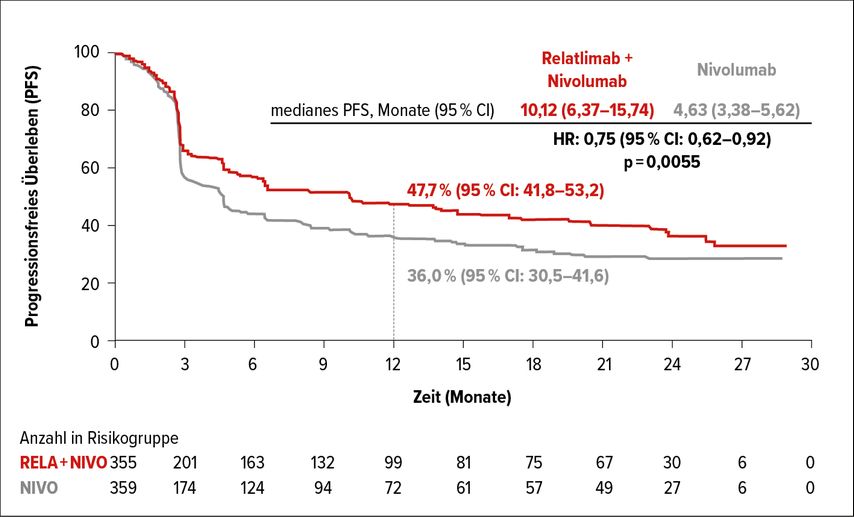
Das PFS wurde durch die zusätzliche Relatlimab-Gabe zu Nivolumab von median 4,63 auf 10,12 Monate signifikant verlängert (HR: 0,75; 95% CI: 0,62–0,92; p=0,0055) (Abb. 1). Nach 12 Monaten waren 47,7 versus 36,0% der Patienten ohne Progress. Eine nachfolgende Therapie erhielten 35,5% der Patienten im Relatlimab-Arm und 37,3% der Patienten im Nivolumab-Monotherapie-Arm. Die Zeit von der Randomisierung bis zum Progress unter der Nachfolgetherapie (PFS2) betrug median 20,04 Monate für Patienten im Nivolumab-Arm und war für den Kombinationsarm noch nicht erreicht (HR: 0,77; 95% CI: 0,61–0,97). Im Kombinationsarm traten Nebenwirkungen aller Grade bei 97,2% und von Grad 3–4 bei 40,3% der Patienten auf. Therapieassoziierte Nebenwirkungen wurden bei 81,1% (alle Grade) bzw. 18,9% (Grad 3–4) der Patienten beobachtet. Drei Patienten im Kombinationsarm und zwei Patienten im Nivolumab-Mono-Arm starben an therapieassoziierten Nebenwirkungen.
Abb. 1: Progressionsfreies Überleben (PFS) unter der Kombination Relatlimab plus Nivolumab versus Nivolumab mono bei Melanompatienten (modifiziert nach Hodi FS et al.)3
Dreifachkombination mit IL-6-Inhibitor Tocilizumab
Die Dreierkombination mit den CTLA4- und PD-1-gerichteten Checkpoint-Inhibitoren Ipilimumab und Nivolumab sowie der IL-6-Rezeptor-gerichteten Therapie mit Tocilizumab wurde in einer Phase-II-Studie bei Patienten mit nicht resezierbarem metastasiertem Melanom untersucht.4 Es wurden 29 Patienten bezüglich der Wirksamkeit ausgewertet, von denen 17 ein Ansprechen laut RECIST (58%) und 5 eine stabile Erkrankung zeigten. Die klinische Kontrollrate betrug somit 75%. Im Median hielt das Ansprechen 7,2 Monate an. Mit einer medianen Nachbeobachtungszeit von 8,2 Monaten waren 20 der 22 Patienten mit Ansprechen oder stabiler Erkrankung weiterhin in Remission. Drei Patienten waren aufgrund des Tumorprogresses gestorben.
41 Patienten hatten wenigstens eine Dosis der Studienmedikation erhalten und wurden bezüglich der Sicherheit der Therapie ausgewertet. In 7 Fällen (17%) wurden therapieassoziierte Nebenwirkungen Grad 3–4 berichtet, einschließlich drei Episoden einer Kolitis. Die Rate an Therapieabbrüchen aufgrund von therapieassoziierten Nebenwirkungen lag bei 14%. Alle Grad-3–4-Nebenwirkungen waren reversibel.
5-Jahres-Daten für BRAF/MEK-gerichtete Kombinationstherapie
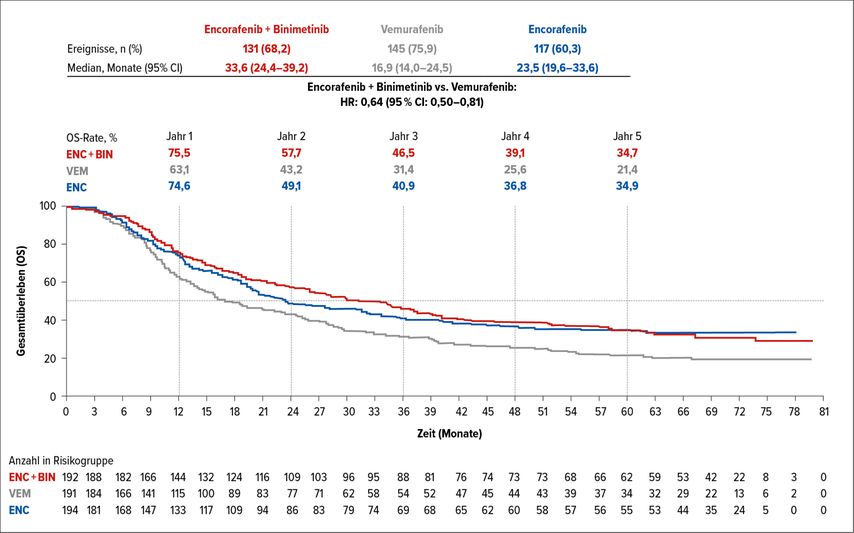
Beim ESMO wurden auch die 5-Jahres-Daten der COLUMBUS-Studie präsentiert, einer Phase-III-Studie, die die Wirksamkeit und Sicherheit der BRAF- und MEK-gerichteten Kombination mit BRAF-gerichteten Monotherapien verglich.5 Insgesamt 577 Patienten mit BRAFV600-mutiertem Melanom erhielten Encorafenib plus Binimetinib oder Encorafenib oder Vemurafenib. Es sprachen 64,1% der Patienten auf die Kombinationstherapie sowie 51,5% bzw. 40,8% der Patienten auf die Monotherapien an. Im Vergleich der Kombination und der Therapie mit Vemurafenib wurde das Risiko für einen Progress um 49% (HR: 0,51; 95% CI: 0,40–0,67) unddas Risiko zu sterben um 36% reduziert (HR: 0,64; 95% CI: 0,50–0,81). Nach 5 Jahren waren 22,9 vs. 19,3 vs. 10,2% der Patienten ohne Progress und 34,7 vs. 34,9 vs. 21,4% am Leben (Abb. 2). Das Auftreten von Nebenwirkungen verringerte sich im Verlauf der Therapie.
Abb. 2: 5-Jahres-Daten zum Gesamtüberleben (OS) in der COLUMBUS-Studie (modifiziert nach Dummer R et al.)5
Eine Analyse des Langzeitüberlebens in Abhängigkeit vom Ansprechen nach 6 Monaten zeigte für Patienten im Studienarm mit Encorafenib plus Binimetinib bei Remission kein verlängertes PFS (HR: 1,38; 95% CI: 0,79–2,24) oder OS (HR: 1,05; 95% CI: 0,73–1,53) im Vergleich mit Patienten ohne Remission.
Quelle:
European Society for Medical Oncology (ESMO) Congress 2021, Paris/virtuell, 16.–21. Sept. 2021
Literatur:
1 Luke JJ et al.: Pembrolizumab versus placebo after complete resection of high-risk stage II melanoma: Efficacy and safety results from the KEYNOTE-716 double-blind phase 3 trial. ESMO 2021; Abstr. #LBA3_PR 2 Margolin KA et al.: CheckMate 204: 3-year outcomes of treatment with combination nivolumab plus ipilimumab for patients with active melanoma brain metastases. ESMO 2021; Abstr. #1039O 3 Hodi FS et al.: Relatlimab + nivolumab vs. nivolumab in previously untreated metastatic or unresectable melanoma: Additional efficacy in RELATIVITY-047. ESMO 2021; Abstr. #1036O 4 Weber JS et al.: Phase II trial of ipilimumab, nivolumab and tocilizumab for unresectable metastatic melanoma. ESMO 2021; Abstr. #1040O 5 Dummer R et al.: 5-year update on COLUMUS: A randomized phase III trial of encorafenib + binimetinib versus encorafenib or vemurafenib in patients with BRAF V600-mutant melanoma. ESMO 2021; Abstr. #1041O
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...