Stellenwert der 177Lutetium-PSMA-Therapie beim metastasierten kastrationsresistenten Prostatakarzinom
Autoren:
Univ.-Prof. Dr. med. Hubert Kübler1
Ass. Maximilian Weinke1
Ass. Dr. med. Peter Hartrampf2
1 Klinik für Urologie und Kinderurologie
2 Klinik für Nuklearmedizin
Uniklinikum Würzburg
Korrespondenz:
E-Mail: weinke_M2@ukw.de
Das Prostatakarzinom ist in Deutschland weiterhin mit Abstand die häufigste Krebserkrankung des Mannes.1 Obwohl das Prostatakarzinom in den meisten Fällen – nicht zuletzt durch die urologische Vorsorgeuntersuchung – früh erkannt und somit kurativ behandelt werden kann, gewinnt auch die Therapie des metastasierten Prostatakarzinoms immer mehr an Bedeutung.
Keypoints
-
177Lu-PSMA-RLT zeigt ein gutes Therapieansprechen und gute Verträglichkeit in retrospektiven und ersten prospektiven Studien.
-
Sie ist eine vielversprechende Behandlungsoption als individueller Heilversuch nach Ausschöpfen aller zugelassenen Therapien.
-
Die Indikationsstellung sollte durch ein interdisziplinäres Tumorboard erfolgen.
-
Die breitere Zulassung ist abhängig von einer derzeit laufenden Phase-III-Studie.
Trotz der vielversprechenden Effektivität der Erstlinien-Hormontherapie entwickelt sich im Krankheitsverlauf häufig eine Resistenz gegenüber der antiandrogenen Therapie. Kommt es beim fortgeschrittenen Prostatakarzinom unter suffizienter antiandrogener Therapie zu einem Progress der Erkrankung (bildmorphologisch oder biochemisch), spricht man von einem kastrationsresistenten Tumorstadium.2 Beim kastrationsresistenten Prostatakarzinom verlängern verschiedene Substanzklassen signifikant das Überleben, u.a. die Androgenrezeptor-Signalinhibitoren der nächsten Generation wie Abirateron und Enzalutamid, die Chemotherapien mit Docetaxel und Cabazitaxel und die Therapie mit Radium-223.3 Zusätzlich wird in den letzten Jahren mit zunehmender Häufigkeit die Radioligandentherapie, welche sich gegen das prostataspezifische Membranantigen (PSMA) richtet, als palliative Therapie in weit fortgeschrittenen Stadien angeboten.
Nuklearmedizinische Theranostik
Die Theranostik (Kombination von Therapie und Diagnostik) ist ein zentrales Prinzip in der modernen Nuklearmedizin. Dabei werden radioaktiv markierte Liganden, welche gegen ein spezifisches Oberflächenprotein einer Karzinomzelle gerichtet sind, verwendet. Diese Liganden werden für die Diagnostik mit einem Positronenstrahler (z.B. Gallium-68 oder Fluor-18) gekoppelt und in der kombinierten Positronenemissionstomografie/Computertomografie (PET/CT) verwendet. Für die Therapien besteht dann die Möglichkeit, die verwendeten Liganden mit einem β-strahler (z.B. Lutetium-177 oder Yttrium-90) oder einem α-Strahler (z.B. Actinium-225) als therapeutisches Nuklid zu koppeln und den Tumor gezielt zu bestrahlen.
Im Fall des metastasierten Prostatakarzinoms dient das prostataspezifische Membranantigen (PSMA) als Zielstruktur. Abgesehen von neovaskulären Endothelien anderer Tumoren weist es eine hohe Spezifität für die Prostata auf und wird dort um ein Vielfaches höher exprimiert als in anderen Geweben.4,5 Zudem ist die PSMA-Expression in Prostatakarzinomen und seinen Metastasen sehr häufig erhöht und wird mit einem fortgeschrittenen Stadium in Verbindung gebracht.6–8 Nach Feststellung einer erhöhten und ausreichenden PSMA-Expression des Prostatakarzinoms und der Metastasen im PSMAPET/CT kann im Anschluss eine Radioligandentherapie, z.B. mit 177Lutetium(177Lu)-PSMA, angeboten werden.
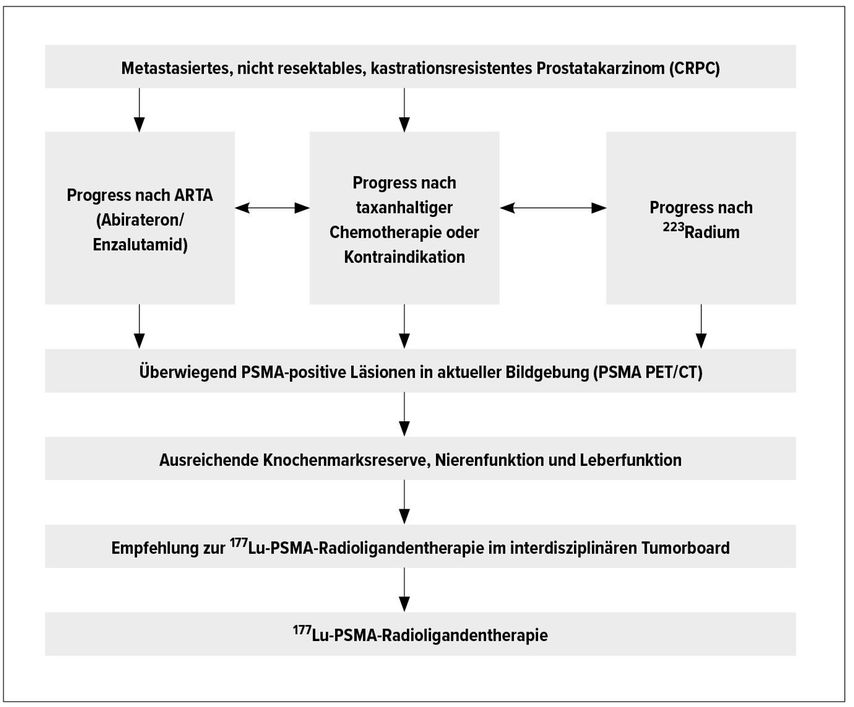
Die 177Lu-PSMA-Radioligandentherapie (RLT) wird in Deutschland bislang als individueller Heilversuch nach Ausnutzen der Standardtherapien und Erfüllung der durch die Deutsche Gesellschaft für Nuklearmedizin festgelegten Kriterien angeboten (Abb.1). Außerdem wird sie in der aktuellen Fassung der S3-Leitlinie „Prostatakarzinom“ bereits erwähnt.9
Abb. 1: Schematische Darstellung der Voraussetzungen, welche in der Regel vor Therapieindikation geprüft werden sollten:1. Tumorprogress bei nicht resektablem, metastasiertem Prostatakarzinom unter leitliniengerechter Therapie (nach Abirateron/Enzalutamid, Xofigo; nach Docetaxel/Cabazitaxel oder „unfit for chemotherapy“) 2. Überwiegend PSMA-positive Läsionen der Tumormanifestationen in aktueller PSMA Bildgebung 3. Ausreichende Knochenmarksreserve (Leukozytenzahl >3000/µl; Thrombozytenzahl >75000/µl), Nierenfunktion (Kreatinin <2x „upper limit of normal“ [ULN]) und Leberfunktion (ALT/AST <5xULN) 4. Empfehlung zur RLT durch interdisziplinäres Tumorboard (nach Bögemann et al.)15
Ansprechen und Verträglichkeit
In einer ersten multizentrischen retrospektiven Studie untersuchten Rahbar et al. 145 Patienten aus 12 Zentren, welche zwischen 2014 und 2015 zwischen 1 und 4 Zyklen der Therapie mit 177Lu-PSMA-RLT erhalten haben. Insgesamt konnte bei 68% der Patienten ein PSA-Abfall beobachtet und bei 45% der Patienten konnte sogar ein signifikantes biochemisches Therapieansprechen mit einem PSA-Abfall um ≥50% des Baseline-Wertes nachgewiesen werden. Da lediglich bei 12–13% Hämatotoxizität ≥ Grad 3 auftrat, zeigte sich zudem eine verglichen mit 223Radium (13–14%) oder Cabazitaxel (68%) sehr gute Verträglichkeit.10
Eine spätere systematische Metaanalyse konnte diese Ergebnisse weiter untermauern. Hierfür wurden die Daten von insgesamt 744 Patienten nach Radioligandentherapie mit 177Lu-PSMA zusammenfassend analysiert. Demnach zeigten 75% der Patienten einen beliebig hohen PSA-Abfall und 46% der Patienten einen Abfall um ≥50%. In den Arbeiten, welche auch das bildmorphologische objektive Therapieansprechen untersuchen, zeigten sich ein Therapieansprechen im Sinne einer partiellen Remission bei 37,2% und eine stabile Erkrankung bei 38,3%. Lediglich 24,5% der Patienten zeigten bildmorphologisch einen Progress.11
Im Jahr 2018 wurden erstmals Ergebnisse einer prospektiven Phase-II-Studie präsentiert (LuPSMA-Studie). In dieser einarmigen Studie wurden 30 Patienten mit einem Progress unter der Standardtherapie eingeschlossen, welche mindestens einen Zyklus der Radioligandentherapie erhielten. Dabei erreichten 29 von 30 Patienten (97%) einen PSA-Abfall und 17 von 30 Patienten (57%) einen PSA-Abfall von mindestens 50%. 40% der Patienten zeigten im 68Ga-PSMAPET/CT keinen bildmorphologischen Progress (im Sinne eines komplettes/partiellen Ansprechens oder einer stabilen Erkrankung). Von den Patienten mit einer viszeralen oder nodulären Metastasierung und einer im CT messbaren Erkrankung (17 von 30 Patienten) zeigten sogar 82% ein objektives Therapieansprechen nach Response Evaluation Criteria In Solid Tumors (RECIST) 1.1. Auch in diesem Kollektiv konnte eine gute Verträglichkeit der Therapie gezeigt werden. Als relevante Nebenwirkungen wurden Mundtrockenheit (Grad 1: 87%) und Hämatotoxizität (therapieassoziierte Thrombopenie Grad ≥3 bei 13% und Lymphozytopenie Grad ≥ 3 bei 37%) angegeben.12
Um einen Vergleich zu anderen Therapieoptionen herstellen zu können, wurde mit der TheraP-Studie in einer weiteren prospektiven Phase-II-Studie randomisiert die 177Lu-PSMA-Therapie mit der Cabazitaxel-Chemotherapie bei 200 Patienten verglichen. Einschlusskriterium war dabei der Progress nach Chemotherapie mit Docetaxel. Als primärer Endpunkt wurde der PSA-Abfall auf ≤50% bestimmt. Die 2020 auf der Jahrestagung der American Society of Oncology (ASCO) vorgestellten ersten Ergebnisse dieser randomisierten Studie zeigen einen PSA-Abfall auf ≤50% bei 66% der Patienten nach Radioligandentherapie verglichen mit lediglich 37% der Patienten nach Chemotherapie mit Cabazitaxel. Zudem fanden sich ein besseres PSA-progressionsfreies Überleben sowie ein geringeres Nebenwirkungsprofil der RLT (32% Grad- 3/4-Toxizität) verglichen mit Cabazitaxel (49%).13Die Langzeitergebnisse dieser Studie dürfen mit Spannung erwartet werden.
Phase-III-Studie VISION
Als groß angelegte Phase-III-Studie mit 814 eingeschlossenen Patienten untersucht die zweiarmige randomisierte VISION-Studie derzeit Patienten mit einem metastasierten Prostatakarzinom, welche bereits eine Standardchemotherapie sowie eine erweiterte Androgenblockade mit einem ARTA („androgen receptor targeted agent“) erhalten haben. Diese werden 2:1 randomisiert und erhalten entweder die Standardtherapie („best standard of care“) in Kombination mit 177Lu-PSMA-RLT oder nur die Standardtherapie („best standard of care as determined by the investigator“). Primäre Endpunkte sind das progressionsfreie Überleben (PFS) und das allgemeine Überleben (OS).14 Sollte sich hierbei ein Vorteil für die Kombination der ARTA mit der Radioligandentherapie zeigen, ist mit einer Zulassung der Radioligandentherapie für spätere Therapielinien beim metastasierten kastrationsresistenten Prostatakarzinom zu rechnen. Zudem sind bereits weitere Studien zur Behandlung früherer Stadien in Planung.
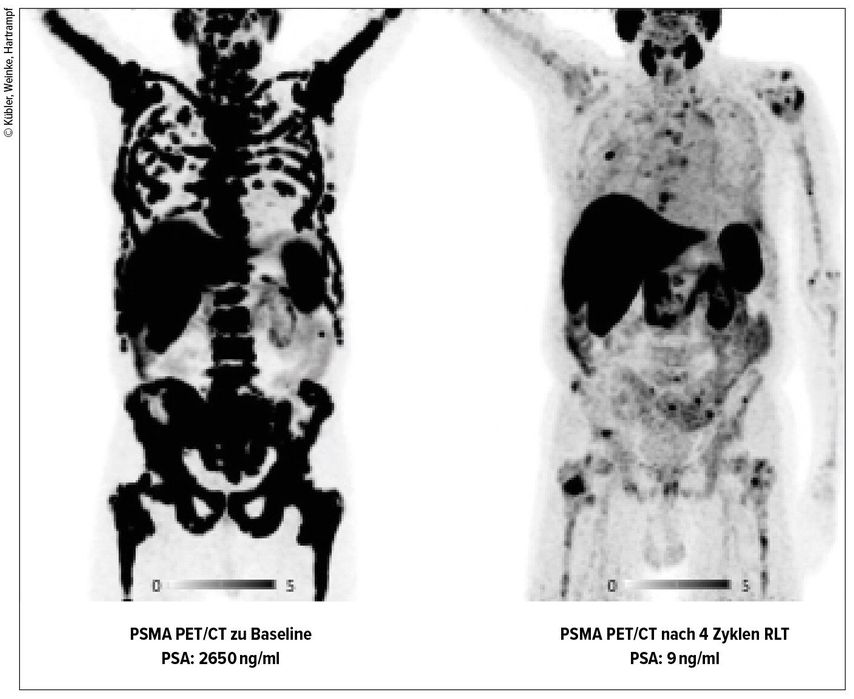
Abb. 2: 73-jähriger Patient mit Prostatakarzinom (Gleason Score 9) nach TUR-Prostata, LHRH-Analogon, Chemotherapie mit Docetaxel und Cabazitaxel sowie Enzalutamid. In der Baseline-Untersuchung zeigt sich eine disseminierte, konfluierend PSMA-positive, gemischt osteolytisch-osteoblastische Metastasierung im gesamten erfassten Skelettsystem bei einem PSA-Wert von 2650ng/ml. Lymphogene oder viszerale Metastasen konnten nicht nachgewiesen werden. Im Abschluss-Staging nach vier Zyklen Radioligandentherapie zeigte sich ein sehr gutes Therapieansprechen mit stark rückläufigem PSA-Wert und deutlich rückläufiger PSMA-Expression in den CT-grafisch stabilen Metastasen. Neue Metastasen traten nicht auf.
Zusammenfassung
Insgesamt bietet die 177Lu-PSMA-RLT einen neuen, innovativen und nebenwirkungsarmen Therapieansatz, welcher als Drittlinientherapie nach Docetaxel und ARTA als sinnvolle Behandlungsoption betrachtet werden muss. Die Effektivität wurde bislang in mehreren retrospektiven Analysen gezeigt und auch die bisherigen prospektiven Studien konnten ein gutes Therapieansprechen nachweisen. Die Indikation zur Therapie sollte in einem interdisziplinären Tumorboard gestellt werden und kommt unter Berücksichtigung der in Abbildung1 aufgelisteten Kriterien als individueller Heilversuch nach Ausschöpfen aller weiteren Therapieformen zum Einsatz. Ohne aktuell ausreichende Studienlage sollte das Auslassen von etablierten Therapielinien zugunsten der RLT kritisch gesehen werden und nur in Ausnahmefällen erfolgen. Eine Zulassung im Rahmen früherer Behandlungslinien wird aufgrund der vielversprechenden Daten nun in Phase-III-Studien geprüft. Aktuell wird eine Applikation von vier Zyklen alle 6–8 Wochen im Rahmen der RLT empfohlen; bei insgesamt guter Verträglichkeit und gutem Therapieansprechen kann diese jedoch auch um weitere Zyklen erweitert werden.
Literatur:
1 Robert-Koch-Institut, Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V.: Krebs in Deutschland für 2015/2016. 12. Ausgabe. Berlin: 2017 2 Mottet N et al.: EAU – ESTRO – ESUR – SIOG Guidelines on prostate cancer. Online unter: https://uroweb.org/guideline/prostate-cancer/. Abgerufen im Januar 2021 3Sonpavde G et al.: Cytotoxic chemotherapy in the contemporary management of metastatic castration-resistant prostate cancer (mCRPC). BJU Int 2015; 116(1): 17-294 Ghosh A, Heston WD: Tumor target prostate specific membrane antigen (PSMA) and its regulation in prostate cancer. J Cell Biochem 2004; 91(3): 528-39 5 Sokoloff RL et al.: A dual-monoclonal sandwich assay for prostate-specific membrane antigen: levels in tissues, seminal fluid and urine. Prostate 2000; 43(2): 150-7 6 Perner S et al.: Prostate-specific membrane antigen expression as a predictor of prostate cancer progression. Human Pathology 2007; 38(5): 696-701 7 Bostwick DG et al.: Prostate specific membrane antigen expression in prostatic intraepithelial neoplasia and adenocarcinoma: a study of 184 cases. Cancer 1998; 82(11): 2256-61 8 Sweat SD et al.: Prostate-specific membrane antigen expression is greatest in prostate adenocarcinoma and lymph node metastases. Urology 1998; 52(4): 637-40 9 Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Interdisziplinäre Leitlinie der Qualität S3 zur Früherkennung, Diagnose und Therapie der verschiedenen Stadien des Prostatakarzinoms, Kurzversion 5.1, 2019, AWMF-Registernummer: 043/022OL. Online unter: https://www.leitlinienprogramm-onkologie.de/leitlinien/prostatakarzinom/. Abgerufen am: 15.01.2021 10 Rahbar K et al.: German multicenter study investigating 177Lu-PSMA-617 radioligand therapy in advanced prostate cancer patients. J Nucl Med 2017; 58(1): 85-90 11 Yadav MP et al.: Radioligand therapy with (177)Lu-PSMA for metastatic castration-resistant prostate cancer: a systematic review and meta-analysis. AJR Am J Roentgenol 2019; 213(2): 275-85 12 Hofman MS et al.: [(177)Lu]-PSMA-617 radionuclide treatment in patients with metastatic castration-resistant prostate cancer (LuPSMA trial): a single-centre, single-arm, phase 2 study. Lancet Oncol 2018; 19(6): 825-33 13 Hofman MS et al.: TheraP: a randomised phase II trial of 177Lu-PSMA-617 (LuPSMA) theranostic versus cabazitaxel in metastatic castration resistant prostate cancer (mCRPC) progressing after docetaxel: initial results (ANZUP protocol 1603). J Clin Oncol 2020; 38(15_suppl): 5500- 14 Sartor AO et al.: VISION: an international, prospective, open-label, multicenter, randomized phase III study of 177Lu-PSMA-617 in the treatment of patients with progressive PSMA-positive metastatic castration-resistant prostate cancer (mCRPC). J Clin Oncol 2020; 38(6_suppl): TPS259-TPS 15 Bögemann M et al.: Radionuklidtherapie mit PSMA-Liganden bei fortgeschrittenem Prostatakarzinom. Der Urologe 2020; 59(6): 680-6
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...