Spannende Resultate zu HCC, BTC und Lebermetastasen des mCRC
Autor:
Prim. Univ.-Prof. Dr. Thomas Grünberger
Abteilungsvorstand
Chirurgische Abteilung und Ambulanz
Klinikum Favoriten
Wiener Gesundheitsverbund
E-Mail: tgruenberger@icloud.com
Das heurige Jahresmeeting der American Society of Clinical Oncology (ASCO) war bedingt durch Covid-19 und die Virtualisierung aller Meetings nicht das gewohnte Highlight vor Ort in Chicago. Trotzdem konnte sich die onkologisch interessierte Welt wieder an neuen Erkenntnissen und zum Teil „practice changing results“ erfreuen.
In dieser Zusammenfassung beschränke ich mich auf die Highlights der Abstracts, die sich mit der chirurgischen Behandlung des lebermetastasierten Kolorektalkarzinoms (CRC) beschäftigt haben und die potenziell zu einem geänderten Vorgehen beim hepatozelluläre Karzinom (HCC) bzw. beim cholangiozellulären Karzinom führen werden. Zusammengefasst wird die Chirurgie von Lebermetastasen differenzierter und spezialisierter. Die auch heuer in aller Munde befindliche Immuntherapie hat beim mCRC aktuell ihren Stellenwert lediglich beim Mikrosatelliten-instabilen Patienten bestätigt, dort allerdings eindrucksvoll; beim HCC und Gallengangkrebs (BTC) hat sie eine große Zukunftsperspektive.
Nur Hepatektomie vs. mFOLFOX-6 + Hepatektomie
In der japanischen Studie JCOG06031 wurden 300 resektable Leber-metastasierte CRC-Patienten entweder postoperativ über 6 Monate mit mFOLFOX adjuvant behandelt oder es wurde lediglich Nachsorge betrieben. Primärer Endpunkt war das „disease-free survival“ (DFS), mit dem Gesamtüberleben (OS) als sekundärem Endpunkt. Interessanterweise war der primäre Endpunkt mDFS beim 5 Jahres-Follow-up mit 4,3 Jahren vs. 1,7 Jahre signifikant besser in der CTx behandelten Gruppe (HR=0,67; p=0,006), jedoch wurde die Studie wegen inferiorem OS in der Chemotherapie-Gruppe abgebrochen (HR=1,25; 5-Jahres-OS 71,2 vs. 83,1%). Nun war der Studienzeitraum mit 13 Jahren sehr lange, 300 randomisierte Patienten sind jedoch in diesem Setting selten erreicht, daher gilt es die Ergebnisse genau zu analysieren. Es waren rund 60% synchron metastasiert, 80% linksseitig, 90% hatte 1–3 Metastasen und alle mussten vor Inklusion ihr Primum reseziert haben, zusätzlich war eine vorangegangene Oxaliplatin-Adjuvanstherapie (bei metachroner Metastasierung) nicht erlaubt. Das DFS als auch im Besonderen die OS-Daten sind beeindruckend und lassen sich sicher mit der Tatsache korrelieren, dass chirurgische Onkologen in Japan einen Großteil dieser Patienten behandeln. So lässt sich auch die Tatsache interpretieren, dass bis zu 60% (im Chirurgie-alleine-Arm vs. 53% in CTx-Arm) nach Relaps neuerlich mit Chirurgie behandelt wurden.
CAPOX-Bev prä- vs. postoperativ
Eine weitere japanische Studie mit interessanten Ergebnissen war die randomisierte Phase-II/III-Studie HiSCO-012. Es wurde bei 81 Patienten eine rein neoadjuvante CAPOX+Bevacizumab-Therapie über 6 Zyklen vor Metastasenchirurgie mit der rein adjuvanten Gabe der gleichen Zusammensetzung postoperativ verglichen. Primärer Endpunkt des Phase-II-Protokolls war die Durchführbarkeit gefolgt vom DFS. Mit 89%iger Protokoll-Adhärenz im neoadjuvanten Setting vs. 72% im adjuvanten Arm wurde ein deutlicher Unterschied aufgezeigt. Das mPFS war mit 17 Monaten vs. 18 Monate praktisch ident, ebenso das mOS mit „not reached“ vs. 65 Monate und das 5-Jahres OS mit 61% vs. 57%. Die „objective resonse rate“ (ORR) im neoadjuvanten Arm war mit 64% deutlich höher als in bekannten Studien, die die Chemotherapie alleine in dieser Patientenpopulation untersucht haben. Sicher handelt es sich hier um einen ungewöhnlichen Vergleich, der seinesgleichen sucht und mit seinen Ergebnissen wohl keinen Nachahmer in einem Phase-III-Protokoll finden wird.
Immuntherapeutische Kombis
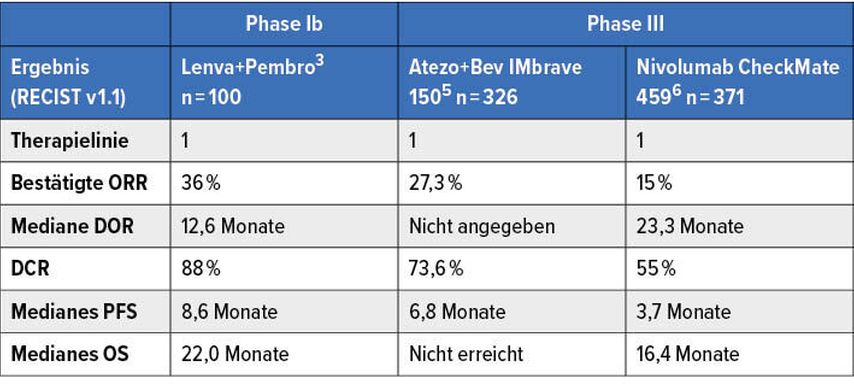
Die Kombination aus „Vascular endothelial growth factor“(VEGF)-Blockade und Immuntherapie hat gerade mit Bevacizumab und Atezolizumab die FDA-Zulassung beim HCC erlangt, schon gibt es weitere Ergebnisse gleichartiger Kombinationen. Bei der auf Safety, Tolerability und ORR sowie „duration of response“ (DOR)ausgelegten Kombi-Studie von Lenvatinib plus Pembrolizumab3 konnten beeindruckende Ergebnisse dieser vielversprechenden Kombination gezeigt werden: Bei 100 ausgewerteten Patienten konnte eine ORR von zumindest 36% erreicht werden, mit einer medianen Responsedauer von 12,6 Monaten. Zusätzlich gab es keine neuen Sicherheitserkenntnisse mit Hypertension (Grad 3: 17%) und Aspartat-Aminotransferase(AST)-Erhöhung (Grad 3: 11%) als den häufigsten Nebenwirkungen. Dr. Kelley diskutierte die Ergebnisse im Kontext mit bekannten Immuntherapiestudien (Tab.1) und konnte damit zeigen, dass wir auch die Patienten, die wir initial nicht als potenziell kurativ behandelbar im Tumorboard besprechen, nach Immuntherapiekombinationen, die uns zum Teil schon zur Verfügung stehen, unbedingt – sowie auch bei anderen gastrointestinalen Entitäten – ein zweites Mal diskutieren sollten.
Tab. 1: Ergebnisse einer am ASCO-Kongress präsentierten Studie3 an Patienten mit HCC im Vergleich mit anderen immuntherapeutischen Regimen. Modifiziert nach Kelley RK et al. 20207
Chemo- + Immuntherapie bei BTC
In einer koreanischen Phase-II-Studie4 untersuchten die Autoren eine Erstlinien- Kombination aus Chemotherapie (GemCis) plus Immuntherapie (Anti-PD-L1 +/– Anti-CTLA-4) bei Patienten mit fortgeschrittenem BTC. Gerade bei dieser Entität haben wir bei initialer Inoperabilität oder bildgebender Borderline-Resektabilität keine Induktionstherapie bei der Hand, mit der wir mit großer Wahrscheinlichkeit ein Downsizing erreichen können. Umso erfreulicher sind die hierbei präsentierten Ergebnisse: Bei 121 untersuchten Patienten konnte eine ORR von 73% gezeigt werden, mit einer „disease control rate“ (DCR) bis zu 100% und einer medianen DOR von bis zu 11 Monaten. Daraus resultierte ein mPFS (progressionsfreies Überleben) von 13 Monaten und ein mOS von 15 Monaten. Es läuft eine Phase-III-Studie (TOPAZ-1 Trial) mit der Kombination GemCis +/– Durvalumab, deren Ergebnisse für diese Tumorentität von großer Bedeutung sein werden.
Fazit
Die Therapie des mCRC wird deutlich individualisiert. Ein „Standardvorgehen“ ist sowohl im neoadjuvanten wie auch im Induktionssetting und auch im adjuvanten Behandlungsalgorithmus unbedingt einer erweiterten Analyse von Patienten- und Tumorcharakteristika anzupassen. Die lange Zeit übliche perioperative Chemo-/Antikörper-Therapie bei jedem lebermetastasierten Patienten wird aufgegeben und ist heute wesentlich vom Tumorstadium bei der Erstdiagnose und spezifischer Molekulargenetik abhängig. Sehr erfreulich ist die Entwicklung der systemischen Behandlungsmöglichkeiten bei den primären Lebertumoren, bei denen die Immuntherapie eine Revolution der Therapieoptionen eingeleitet hat und unseren Patienten in naher Zukunft erfreuliche Verläufe bescheren wird.
Literatur:
1 Kanemitsu Y et al.: J Clin Oncol 2020; 38(15_suppl): abstr 4005 2 Takakura Y et al.: J Clin Oncol 2020; 38(15_suppl): 4021 3 Zhu AX et al.: J Clin Oncol 2020; 38(15_suppl): 4519 4 Oh DY et al.: J Clin Oncol 2020; 38(15_suppl): 4520 5 Finn et al.: N Eng J Med 2020; 382(20): 1894-905 6 Yau T et al.: Ann Oncol 2019; 30(suppl_5): v851-934 7 Kelley RK et al.: ASCO 2020; eingeladener Kommentar
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...