Revolution der Systemtherapie beim hepatozellulären Karzinom
Autoren:
Dr. Sabrina Welland
Prof. Dr. Arndt Vogel
Department of Gastroenterology,
Hepatology and Endocrinology
Hannover Medical School, Hannover
Korrespondierender Autor:
E-Mail: Vogel.Arndt@mh-hannover.de
Während über Jahre Sorafenib die einzige zugelassene Option in der Systemtherapie des hepatozellulären Karzinoms (HCC) darstellte, hat sich in den letzten Jahren das Spektrum der verfügbaren Substanzen deutlich erweitert, und insbesondere die immunonkologisch-basierten Kombinationstherapien finden zunehmend Einsatz in früheren Stadien des HCC.
Keypoints
-
Den aktuellen Goldstandard in der Erstlinie für Patienten mit HCC stellt die Kombination aus dem PD-L1-Inhibitor Atezolizumab und dem VEGF-Inhibitor Bevacizumab dar.
-
Für Patienten mit Kontraindikation für eine Immuntherapie oder Bevacizumab stellen die Tyrosinkinaseinhibitoren Sorafenib und Lenvatinib sinnvolle Alternativen in der Erstlinie dar.
-
Wenn möglich sollte HCC-Patienten eine Zweitlinientherapie angeboten werden. In der Zweitlinie stehen nach Versagen von Sorafenib die Kinaseinhibitoren Cabozantinib und Regorafenib zur Verfügung. Bei Patienten mit hohen AFP-Spiegeln kann der VEGF-Antikörper Ramucirumab eingesetzt werden. Bei Patienten mit Progress unter Atezolizumab und Bevacizumab oder Lenvatinib sollten Substanzen mit Phase-III-Evidenz eingesetzt werden, wobei die Kostenerstattung durch die Krankenkasse zu beachten ist.
Das hepatozelluläre Karzinom (HCC) gehört zu den Malignomen mit einer weiterhin steigenden Inzidenz und mit einer sehr hohen Mortalität.1,2 Da sich das HCC in über 90% der Fälle auf dem Boden einer Leberfibrose oder -zirrhose entwickelt, tragen die Komplikationen der Leberzirrhose und die eingeschränkte Leberfunktion signifikant zur hohen Mortalität bei.3 Weltweit ist in den letzten drei Jahrzehnten die Zahl Hepatitis-bedingter Tumoren zurückgegangen, während gleichzeitig ein Anstieg von HCC aufgrund einer nicht alkoholischen Steatohepatitis (NASH) zu beobachten ist.
Die eingeschränkte Leberfunktion kann bei einem relevanten Anteil der Patienten den Einsatz lokaler und systemischer Therapien limitieren. Die Komplexität des HCC erfordert daher eine interdisziplinäre Betreuung der Patienten und die Expertise von Transplantationschirurgen, Pathologen, interventionellen Radiologen und Hepatologen bzw. Onkologen. Ein therapeutisches Gesamtkonzept muss nicht nur die aktuelle onkologische Situation erfassen, sondern auch das mögliche Ergebnis der Tumortherapie als auch deren Einfluss auf die zugrunde liegende Lebererkrankung/Zirrhose antizipieren.
Das klinische Management von Patienten mit HCC erfolgt somit unter besonderer Berücksichtigung sowohl der Leberfunktion und des Allgemeinzustandes des Patienten als auch der Tumorausdehnung. Trotz großer Fortschritte bei den Systemtherapien bleiben lokale Optionen wie Resektion/Transplantation, lokale Ablation sowie die intraarteriellen Therapien (transarterielle Chemoembolisation [TACE]; selektive interne Radiotherapie [SIRT]) integraler Bestandteil der Behandlung von HCC-Patienten im frühen und intermediären Stadium ohne extrahepatische Metastasierung.
Die Therapie mit Sorafenib stellte über fast ein Jahrzehnt die einzige zugelassene Option zur systemischen Therapie des fortgeschrittenen HCC dar. Neben anderen Mulitikinasinhibitoren wie Lenvatinib, Cabozantinib und Regorafenib oder dem „Vascular endothelial growth factor (VEGF)“-Rezeptor-Antikörper Ramucirumab steht nun auch eine Kombinationstherapie mit Atezolizumab und Bevacizumab zur Verfügung.
Erstlinientherapie des fortgeschrittenen HCC
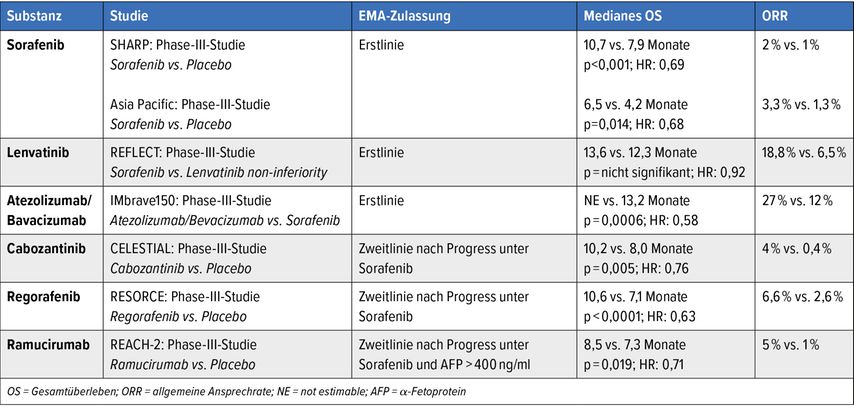
Der Tyrosinkinaseinhibitor Sorafenib war die erste systemisch wirksame Substanz, die zur Therapie des HCC 2008 zugelassen worden war. Im Rahmen der SHARP-Studie konnte erstmalig eine Verlängerung des medianen Gesamtüberlebens (mOS) von 7,9 auf 10,7 Monate gezeigt werden.6 Über zehn Jahre konnte anschließend in keiner Phase-III-Studie eine Verlängerung des Überlebens in der Erst- oder Zweitlinie erreicht werden, bevor 2017 eine Revolution in der Systemtherapie begann und mehrere Substanzen aufgrund von positiven Phase-III-Daten eine Zulassung durch die European Medicines Agency (EMA) erhielten.
Lenvatinib
Der Multikinasinhibitor Lenvatinib wurde 2018 in der Erstlinie zugelassen; basierend auf den Daten der REFLECT-Studie, die eine Nichtunterlegenheit im Gesamtüberleben im Vergleich zu Sorafenib zeigen konnte (mOS Sorafenib 13,6 Monate vs. mOS Lenvatinib 12,3 Monate).7 Die positiven Daten zu den sekundären Endpunkten progressionsfreies Überleben (PFS), Zeit bis zur Tumorprogression (TTP) und allgemeine Ansprechrate (ORR) in dieser Studie sind dabei weiterhin klinisch relevant und können noch heute ein Argument für den Einsatz von Lenvatinib im klinischen Alltag sein.
Pembrolizumab & Nivolumab
Nachdem zunächst nur mit Tyrosinkinaseinhibitoren eine Wirksamkeit in Phase-III-Studien beim HCC gezeigt werden konnte, ergaben die ersten Phase-II-Studien mit den Checkpoint-Inhibitoren Pembrolizumab und Nivolumab bereits früh Hinweise für die Wirksamkeit dieser Substanzklasse zumindest bei einer Subgruppe der Patienten mit fortgeschrittenem HCC. Trotz der zunächst sehr vielversprechenden Daten konnten die nachfolgend durchgeführten Phase-III-Studien mit beiden Substanzen weder in der Erstlinie noch in der Zweitlinie ihre primären Endpunkte mit einer Verlängerung des Überlebens erreichen.8,9
Atezolizumab & Bevacizumab
Nach insgesamt ernüchterndem Ergebnis von PD-1-Inhibitoren in der Monotherapie gelang in der Phase-III-Studie IMbrave150 mit der Kombination aus dem „Programmed death ligand-1 (PD-L1)“-Rezeptor Atezolizumab und dem VEGF-Inhibitor Bevacizumab ein überzeugender Durchbruch der immunonkologisch basierten Kombinationstherapie beim HCC. Bemerkenswert war in dieser Studie insbesondere die überzeugende Verlängerung des Überlebens von fast 6 Monaten auf 19,4 Monate im Vergleich zu Sorafenib.
Neben einer hohen Ansprechrate von 30% zeichnet sich die Kombination auch durch eine deutlich bessere Verträglichkeit und längeren Erhalt der Lebensqualität aus. Aufgrund des erhöhten Risikos für gastrointestinale Blutungen sollte vor Einsatz von Bevacizumab allerdings bei allen Patienten mit einer portalen Hypertension der Varizenstatus vor Therapiebeginn erhoben werden und diese ggf. einer entsprechenden Behandlung zugeführt werden.10
Aufgrund der überzeugenden Ergebnisse wurde die Kombination 2020 in der Erstlinientherapie nicht nur von der Food and Drug Administration (FDA) in den USA, sondern auch von der EMA zugelassen, und sie wird derzeit von den nationalen und internationalen Leitlinien als „standard of care“ in der Erstlinientherapie des HCC empfohlen. Für Patienten mit Kontraindikationen gegen diese immunonkologisch basierte Kombination stehen mit Sorafenib und Lenvatinib zwei wirksame Alternativen weiterhin zur Erstlinienbehandlung des HCC zur Verfügung.
Weitere vielversprechende Substanzen
Die Wirksamkeit weiterer immunonkologisch basierter Kombinationstherapien wird aktuell im Rahmen mehrerer Phase-III-Studien geprüft. Laut aktueller Pressemitteilungen konnte dabei in der Phase-III- Studie HIMALAYA der primäre Endpunkt – eine Verlängerung des mPFS und mOS – mit der Kombination des PD-L1-Inhibitors Durvalumab mit Tremelimumab, einem Inhibitor des „cytotoxic T-lymphocytic-associated-protein-4“ (CTLA-4), erreicht werden.
Auch in der COSMIC-312-Studie konnte mit der Kombination von Cabozantinib und Atezolizumab das PFS, allerdings nicht das mOS im Vergleich zu Sorafenib signifikant verlängert werden. In der Zukunft werden damit sehr wahrscheinlich weitere Optionen für die Erstlinienbehandlung zur Verfügung stehen, die eine individualisierte Therapieauswahl beim HCC ermöglichen wird.
Zweitlinientherapie
In der Zweitlinie sind in den letzten Jahren ebenfalls mehrere Substanzen etabliert worden. Mit Cabozantinib und Regorafenib stehen zwei Multikinaseinhibitoren mit positiven Phase-III-Daten in der Zweitlinie zur Verfügung. Mit einer Verlängerung des Überlebens von 7,8 Monaten auf 10,6 Monate verglichen mit Placebo wurde Regorafenib 2017 zugelassen.11 Auch Cabozantinib erhielt 2019 nach positiven Daten der CELESTIAL-Studie mit einer Überlebensverlängerung von 8,0 Monaten auf 10,2 Monate im Vergleich zu Placebo die EMA-Zulassung für die Zweitlinie.12,13
Neben Tyrosin- und Multikinaseinhibitoren wurde ebenfalls ein VEGFR-2-Inhibitor in der Zweitlinie zugelassen. Nach Progress unter Sorafenib wurde mit Ramucirumab für Patienten mit α-Fetoprotein (AFP) >400ng/ml ein signifikant längeres Überleben als unter Placebo beobachtet. Die Phase-III-Studie REACH-2 konnte eine signifikante Verlängerung des Gesamtüberlebens von 7,3 Monaten in der Placebogruppe auf 8,5 Monate unter Ramucirumab-Einnahme zeigen.14
Behandlungssequenz
Bisher sind diese Substanzen in der Zweitlinie nach Progress oder Unverträglichkeit einer Erstlinientherapie mit Sorafenib getestet, sodass es keine Studiendaten zur Wirksamkeit nach Anwendung anderer in der Erstlinie verwendeten Therapien gibt. Auch ohne Daten wird aber von allen Leitlinien unbedingt eine Sequenztherapie für Patienten mit HCC empfohlen.
Anhand der bislang publizierten Daten aus Real-World-Kohorten oder auch den Post-hoc-Analysen der Phase-III-Studien lässt sich noch keine „optimale Behandlungssequenz“ für HCC-Patienten in der systemischen Therapie ablesen, sodass nur eine uneingeschränkte Empfehlung für alle Substanzen mit Phase-III-Evidenz ausgesprochen werden kann.
Für eine Drittlinientherapie liegen mit Ausnahme einer kleinen Subgruppe in der CELESTIAL-Studie bislang keine Studiendaten vor, sodass die Entscheidung hierfür auf individueller Basis entsprechend der bisherigen Therapiesequenz durch das lokale Tumorboard getroffen werden muss.
Patienten mit eingeschränkter Leberfunktion
Insbesondere die Therapie von Patienten mit höhergradiger Leberfunktionseinschränkung (ALBI 2 und 3 oder Child Pugh Stadium B und C) stellt eine Herausforderung dar, da das in Studien eingeschlossene Patientenkollektiv ausschließlich Patienten mit kompensierter Leberzirrhose einem Child-Pugh-Stadium A entsprechend beinhaltet. Nicht nur nach Einsatz von lokalen Therapien, sondern auch durch Tumorprogress oder aber auch als Nebenwirkung der eingesetzten Medikamente ist im Verlauf der Therapie bei einem großen Teil der Patienten eine weitere Verschlechterung der Leberfunktion zu beobachten. Es existieren bislang keine Phase-III-Studiendaten zur Wirksamkeit und Verträglichkeit der eingesetzten Substanzen bei Patienten mit höhergradiger Leberfunktionseinschränkung.
Daten aus Real-World-Kohorten und kleinen Phase-II-Studien lassen jedoch vermuten, dass insbesondere die immunonkologisch basierten Kombinationstherapien auch Patienten mit Child Pugh B7/8 oder ALBI 2 von einer HCC-Therapie profitieren können. Diese Patienten müssen aber entsprechend über ein erhöhtes Risiko für Nebenwirkungen wie eine Dekompensation der Leberzirrhose aufgeklärt werden und insbesondere bei Therapiebeginn engmaschig kontrolliert werden.
Literatur:
1 Balogh J et al.: Hepatocellular carcinoma: a review. JHepatocell Carcinoma 2016; 3: 41-53 2 Ferlay J et al.: Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods. Int J Cancer 2019; 144(8): 1941-53 3 Villanueva A: Hepatocellular carcinoma. N Engl J Med 2019; 380(15): 1450-62 4 Bosetti C et al.: Trends in mortality from hepatocellular carcinoma in Europe, 1980-2004. Hepatology 2008; 48(1): 137-45 5 Rinella ME: Nonalcoholic fatty liver disease: a systematic review. JAMA 2015; 313(22): 2263-73 6 Llovet JM et al.: Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 2008; 359(4): 378-90 7 Kudo M et al.: Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. Lancet 2018; 391(10126): 1163-73 8 Finn RS et al.: Pembrolizumab as second-line therapy in patients with advanced hepatocellular carcinoma in KEYNOTE-240: a randomized, double-blind, phase III trial. JClin Oncol 2020; 38(3): 193-202 9 Ascierto PA et al.: Adjuvant nivolumab versus ipilimumab in resected stage IIIB-C and stage IV melanoma (CheckMate 238): 4-year results from a multicentre, double-blind, randomised, controlled, phase 3 trial. Lancet Oncol 2020; 21(11): 1465-77 10 Finn RS et al.: Atezolizumab plus bevacizumab in unresectable Hepatocellular Carcinoma. N Engl J Med 2020; 382(20): 1894-905 11 Bruix J et al.: Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2017; 389(10064): 56-66 12 Abou-Alfa GK et al.: Cabozantinib in patients with advanced and progressing hepatocellular carcinoma. N Engl J Med 2018; 379(1): 54-63 13 Kelley RK et al.: Second-line cabozantinib after sorafenib treatment for advanced hepatocellular carcinoma: a subgroup analysis of the phase 3 CELESTIAL trial. ESMO Open 2020; 5(4): e000714 14 Zhu AX et al.: Ramucirumab after sorafenib in patients with advanced hepatocellular carcinoma and increased α-fetoprotein concentrations (REACH-2): arandomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2019; 20(2): 282-96
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...