Von „One size fits all“ zur Präzisionsmedizin: neue Therapieziele für muzinöse Ovarialkarzinome
Autor:
Dr. Thomas Bartl, MA
Universitätsklinik für Frauenheilkunde
Klinische Abteilung für Allgemeine Gynäkologie und Gynäkologische Onkologie
Medizinische Universität Wien
E-Mail: thomas.bartl@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Muzinöse Ovarialkarzinome werden aufgrund ihrer niedrigen Inzidenz in Studien oft vernachlässigt. Dabei zeigen sie auf klinischer und molekularpathologischer Ebene durchaus Merkmale, die personalisierte, zielgerichtete Therapien ermöglichen.
Keypoints
-
Zielgerichtete Therapiestrategien könnten die Limitationen von „One size fits all“-Therapiekonzepten bei seltenen Tumortypen wie dem muzinösen Ovarialkarzinom überkommen.
-
Patientinnen mit fortgeschrittenen und/oder rezidivierten muzinösen Ovarialkarzinomen sollten zur Evaluierung zielgerichteter Therapien und/oder für klinische Studien an onkologische Zentren überwiesen werden.
-
Checkpoint-Inhibitoren könnten für eine Subgruppe muzinöser Ovarialkarzinome mit hoher PD-L1-Expression und/oder Mikrosatelliteninstabilität eine vielversprechende Therapieoption darstellen.
Muzinöse Ovarialkarzinome (mEOC) umfassen eine seltene histologische Untergruppe epithelialer Ovarialkarzinome. Sie zeigen ein distinktes klinisches Verhalten und haben spezifische molekularpathologische Charakteristika, welche eher gastrointestinalen Tumoren denn anderen Ovarialkarzinom-Subtypen gleichen.
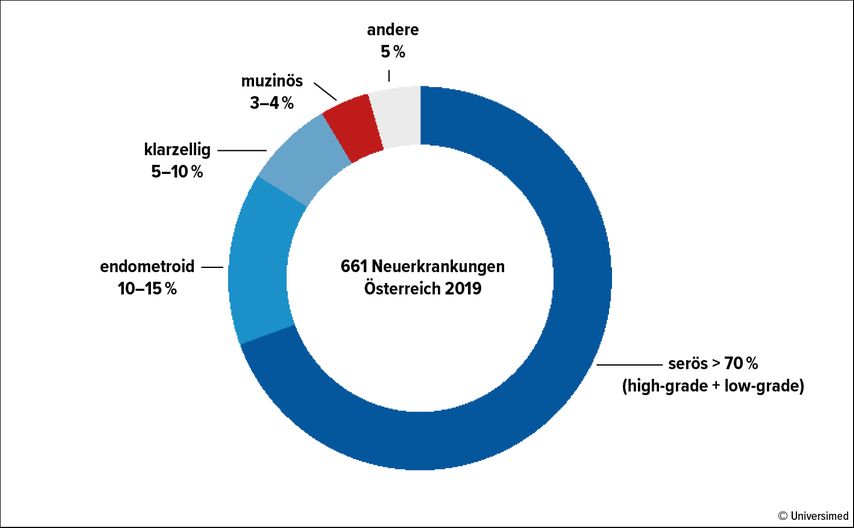
Die niedrige Inzidenz dieser Erkrankung hemmt sowohl klinische als auch translationale Forschungsbestrebungen zur Definition optimaler Therapiestrategien (Abb. 1): Während die Behandlungsoptionen für die häufigste Subgruppe seröser High-Grade-Ovarialkarzinome (HGSOC) zuletzt beträchtlich erweitert wurden, sind für das mEOC in absehbarer Zeit keine vielversprechenden klinischen Studien zu erwarten. Sinnbildlich dafür steht das Scheitern der GOG-241:1,2 Im Rahmen der GOG-241-Studie sollte die adjuvante Standardtherapie Carboplatin/Paclitaxel mit einem von gastrointestinalen Tumoren entlehnten Schema, dem Schema Oxaliplatin/Gemcitabin, jeweils +/– Bevacizumab, verglichen werden. Aufgrund zu langsamer Rekrutierung wurde die Studie nach 50/330 Patientinnen abgebrochen.
Abb. 1: Von 661 neu diagnostizierten Ovarialkarzinomen entfallen <4% auf muzinöse Subtypen, das entspricht weniger als 30 Neudiagnosen pro Jahr in Österreich (Quelle: Statistik Austria)
Mangels belastbarer Evidenz zu optimalen Therapiestrategien erhalten Patientinnen mit mEOC folglich die onkologische Standardtherapie für HGSOC, welche eine radikale zytoreduktive Primäroperation, gefolgt von einer adjuvanten platinbasierten Kombinationschemotherapie, umfasst. Eine verminderte Sensitivität gegenüber zytotoxischen Chemotherapien und das Ausbleiben therapeutischer Durchbrüche resultieren in einem deutlich kürzeren Gesamtüberleben von etwa 12–33 Monaten nach Diagnosestellung in fortgeschrittenen Stadien. Im Vergleich dazu liegt das Gesamtüberleben für Patientinnen mit HGSOC bei gleicher Therapie bei 35–60 Monaten. Die Überlebensraten haben sich für muzinöse Ovarialkarzinome in den vergangenen Jahrzehnten nicht verbessert.3,4
Um diesen Limitationen zu begegnen, erscheint in einer Ära zunehmender Präzisionsmedizin daher die Definition neuer molekularer Therapieziele als der vielversprechendste Ansatz.
Molekularpathologischer Hintergrund: die BRCA-Mutation
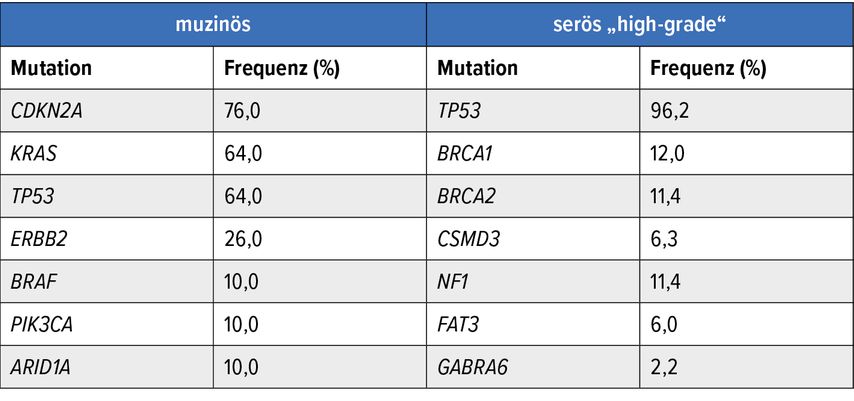
mEOC zeigen im Vergleich zu anderen Ovarialkarzinom-Subtypen ein distinktes molekularpathologisches Profil (Tab. 1): Bei HGSOC stehen Mutationen des Tumorsuppressorgens TP53 im Vordergrund. Darüber hinaus finden sich in ca. 50% der HGSOC Defekte der DNA-Reparatur, zu denen BRCA-Mutationen zählen („homologe Rekombinationsdefizienz“, HRD). Demgegenüber dürfte die Treibermutation für das Entstehen von mEOC im MAPK/ERK-Pathway, zumeist in einer KRAS-Mutation, liegen, deren Überaktivierung unkontrollierte Zellteilung begünstigt.
Tab. 1: Häufigste Mutationen muzinöser Ovarialkarzinome in Vergleich zu serösen High-Grade-Subtypen. Das spezifische Mutationsprofil muzinöser Ovarialkarzinome könnte für personalisierte, zielgerichtete Therapiestrategien nutzbar gemacht werden (Quellen: TCGA, Nature 2011; Cheasley, Nature 2019)
Da BRCA-Mutationen bei mEOC nach derzeitigem Kenntnisstand keine pathogenetische Relevanz haben und das Vorliegen einer HRD auf Basis einer „loss of heterozygosity“ (LOH) mit nur 8,1% aller Fälle beziffert wird, fehlt die Rationale für eine breite klinische Anwendung von PARP-Inhibitoren, wie sie für HGSOC und endometroide Subtypen klinischer Standard geworden ist. Klinische Studiendaten zur Wirksamkeit von PARP-Inhibitoren liegen für mEOC nicht vor. In der Routinetherapie nehmen PARP-Inhibitoren für mEOC daher derzeit keinen Stellenwert ein.5
Checkpoint-Inhibitoren und mEOC
Das Vorliegen einer Mikrosatelliteninstabilität (MSI) oder einer Expression von PD-L1 stellt den klinisch am besten validierten Biomarker für das Ansprechen auf Checkpoint-Inhibitoren dar. So beruhen die EMA(Europäische Arzneimittel-Agentur)-Zulassungen von Dostarlimab für das rezidivierte Endometriumkarzinom auf dem Vorliegen einer MSI und von Pembrolizumab für das primär fortgeschrittene oder rezidivierte Zervixkarzinom auf einer positiven PD-L1-Expression.
Während HGSOC auf Basis von Studiendaten als „immunologisch kalte“ Tumoren gelten und Checkpoint-Inhibitoren aufgrund lediglich moderater Ansprechraten bislang keinen therapeutischen Stellenwert einnehmen konnten, stehen keine entsprechenden klinischen Daten für mEOC zur Verfügung. Das Vorliegen einer MSI, respektive einer PD-L1-Expression, könnte jedoch eine Rationale für Therapieversuche mit Checkpoint-Inhibitoren für eine definierte Subgruppe von mEOC bieten. Obwohl eine MSI bei HGSOC ausgesprochen selten vorliegt, ist diese für mEOC in bis zu 20% der Fälle beschrieben und wird daher auch von der American Society of Clinical Oncology (ASCO) für mEOC als Routinetestung empfohlen.6,7
Im Einklang damit weist eine kleine Subgruppe muzinöser Ovarialkarzinome ebenfalls teils hohe PD-L1-Expressionsraten auf, welche mit spezifischen Infiltrationsmustern tumorinfiltrierender Lymphozyten sowie einem distinkten klinischen Verhalten assoziiert zu sein scheinen. Dies könnte mit dem Vorliegen von ARID1A-Mutationen zu tun haben, welche mit hypermutierten Genotypen einhergehen könnten und bereits zuvor als mögliches Therapieziel für Checkpoint-Inhibitoren diskutiert wurden.8,9
Zusammenfassend kann festgestellt werden, dass das molekularpathologische Profil einiger Subgruppen muzinöser Ovarialkarzinome eine starke Begründung für einen Therapieversuch mit Checkpoint-Inhibitoren bietet. Insbesondere die – etwa im Gegensatz zu einer HRD-Testung – kostengünstige und schnelle Evaluierung mittels Immunhistochemie im Fall einer PD-L1-Bestimmung lässt diese Therapieoption klinisch interessant erscheinen. Zur Bestätigung dieser Hypothese sind weitere präklinische und/oder frühe klinische Studien erforderlich.
Weitere potenzielle Therapien für mEOC
Das immunhistochemische sowie molekularpathologische Profil von mEOC lässt eine Reihe weiterer experimenteller Therapiezugänge denkbar erscheinen:
So exprimiert eine Subgruppe muzinöser Ovarialkarzinome das in erster Linie in der Senologie etablierte HER2, welches eine zielgerichtete Therapie mit Trastuzumab erlauben könnte. Anekdotische Berichte für einen klinischen Effekt bei HER2-positiven mEOC liegen vor.10
Gershenson et al. zeigten kürzlich den klinischen Effekt des MEK-Inhibitors Trametinib für stark vorbehandelte seröse Low-Grade-Ovarialkarzinome, welche ebenso wie mEOC häufig mit MAPK/ERK-Pathway-Aberrationen assoziiert sind. Eine Translation dieser Ergebnisse auf mEOC scheint plausibel. Präklinische Arbeiten zur In-vitro-Aktivität von MEK-Inhibitoren in mEOC-Zelllinien unterstützen diese Rationale.11
Etwa 10% der muzinösen Ovarialkarzinome weisen ARID1A-Mutationen auf. Wurde dieser Sachverhalt zunächst für die Subgruppe klarzelliger Ovarialkarzinome nachgewiesen, zeigen präklinische Daten auch bei mEOC im Fall des Vorliegens einer ARID1A-Mutation in vitro eine über 100-fache Sensitivität gegenüber dem zytotoxischen Wirkstoff Gemcitabin. Eine retrospektive Fallserie von Patientinnen mit klarzelligen Ovarialkarzinomen, die bei einem Rezidiv eine Gemcitabin-Monotherapie erhalten haben, berichtet im Fall des Vorliegens einer ARID1A-Mutation von deutlich höheren Überlebensraten. Nach klinischer Bestätigung erscheint eine Präferenz für Gemcitabin bei Vorliegen von ARID1A-Mutationen denkbar.12
Fazit
Das molekularpathologische Profil muzinöser Ovarialkarzinome erlaubt eine Reihe potenzieller zielgerichteter Therapieversuche, mit denen die Limitationen mangelnder Chemotherapiesensitivität kompensiert werden könnten.
Entsprechend geförderte Arzneimittelstudien, die diese Therapieziele mit hoher Evidenz bestätigen können, sind aufgrund der niedrigen Inzidenz dieser Erkrankung auch weiterhin unwahrscheinlich. Um weitere Evidenz generieren zu können, erscheint daher eine Zuweisung betroffener Patientinnen an onkologische Zentren, an denen experimentelle Therapiemöglichkeiten etwa über Präzisionsmedizin-Tumorboards mit anschließender wissenschaftlicher Evaluation zur Verfügung stehen, zunehmend unabdingbar.
Literatur:
1 Gore M et al.: An international, phase III randomized trial in patients with mucinous epithelial ovarian cancer (mEOC/GOG 0241) with long-term follow-up: and experience of conducting a clinical trial in a rare gynecological tumor. Gynecol Oncol 2019; 153(3): 541-8 2 Hackshaw A et al.: Mucinous ovarian carcinoma. N Engl J Med. 2019; 381(1): e3 3 Ricci F et al.: Recent insights into mucinous ovarian carcinoma. Int J Mol Sci 2018; 19(6): 1569 4 Morice P et al.: Mucinous ovarian carcinoma. N Engl J Med 2019; 380(13): 1256-6 5 Elvin JA et al.: Comprehensive genomic profiling (CGP) with loss of heterozygosity (LOH) to identify therapeutically relevant subsets of ovarian cancer (OC). J Clin Oncol 2017; 35(15_suppl): 5512 6 Konstantinopoulos PA et al.: Germline and somatic tumor testing in epithelial ovarian cancer: ASCO Guideline. JClin Oncol 2020; 38(11): 1222-45 7 Leskela S et al.: Mismatch repair deficiency in ovarian carcinoma: frequency, causes, and consequences. Am J Surg Pathol 2020; 44(5): 649-56 8 Bartl T et al.: PD-L1 als potentielles Therapieziel für eine Subgruppe muzinöser Ovarial-karzinome mit hypermutiertem Genotyp. Geburtshilfe Frauenheilkd 2022; 82(04): 1 9 Kuroda Y et al.: ARID1A mutation/ARID1A loss is associated with a high immunogenic profile in clear cell ovarian cancer. Gynecol Oncol 2021; 162(3): 679-85 10 McAlpine JN et al.: HER2 overexpression and amplification is present in a subset of ovarian mucinous carcinomas and can be targeted with trastuzumab therapy. BMC Cancer 2009; 9(1): 433 11 Inaba K et al.: Synergistic antitumor effects of combination PI3K/mTOR and MEK inhibition (SAR245409 and pimasertib) in mucinous ovarian carcinoma cells by fluorescence resonance energy transfer imaging. Oncotarget 2016; 7(20): 29577-91 12 Kuroda T et al.: Therapeutic preferability of gemcitabine for ARID1A-deficient ovarian clear cell carcinoma. Gynecol Oncol 2019; 155(3): 489-98
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...