Patienten mit Risikozytogenetik bleiben größte therapeutische Herausforderung
Autoren:
Univ.-Prof. Dr. Heinz Ludwig1
OA Dr. Martin Schreder2
Priv.-Doz. Dr. Niklas Zojer, PhD2
1 Wilhelminen-Krebsforschungsinstitut
c/o 1. Medizinische Abteilung
Zentrum für Onkologie, Hämatologie und Palliativmedizin
Klinik Ottakring, Wien
2 1. Medizinische Abteilung
Zentrum für Onkologie, Hämatologie und Palliativmedizin
Klinik Ottakring, Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Meeting der American Society of Hematology (ASH) fand 2022 in New Orleans, der Wiege des Jazz, statt. Obwohl New Orleans nur knapp 400000 Einwohner zählt, ist die Stadt immer wieder Gastgeber für 30000 ASH-Besucher, die sich nicht nur wegen des angenehmen Klimas, sondern auch wegen der historischen Altstadt im French Quarter gerne dort treffen. Bezüglich des multiplen Myeloms gab es natürlich eine Fülle von neuen Daten, wobei hier nur ein kleiner, subjektiv gewählter Ausschnitt präsentiert werden kann.
Kann die Sensitivität der MRD-Untersuchung weiter optimiert werden?
Dieser Frage gingen zwei Studiengruppen nach. Um die Sensitivität zu erhöhen, muss eine wesentlich größere Anzahl an kernhaltigen Zellen untersucht werden als bei der konventionellen Methode, die immerhin eine Sensitivität von 10–6 aufweist. Ben Derman et al.1 konnten nun anhand von ca. 5x größeren Volumina der Knochenmarksaspirate eine mediane Anzahl von 59 Millionen Zellen untersuchen. Aus diesem Pool wurden CD138+ Zellen angereichert und die erhaltene Probe wurde mittels „next-generation sequencing“ (NGS) auf residuale Myelomzellen untersucht, womit eine MRD(minimale Resterkrankung)-Sensitivität von 10–7 erreicht wurde. Bei einer kleinen Gruppe von 38 Patienten bestand bei Vorliegen eines MRD 10–6-negativen, jedoch 10–7-positiven Befundes ein größeres Risiko, wieder MRD 10–6-positiv zu werden, als bei Patienten, die bei beiden Testverfahren negativ waren.
Ein ähnlicher Ansatz zur Sensitivitätserhöhung des Nachweises von zirkulierenden Plasmazellen wurde von der Gruppe von Bruno Paiva in Pamplona verfolgt.2 Bekanntlich liegt die Menge von im peripheren Blut zirkulierenden Plasmazellen etwa drei logarithmische Stufen niedriger als im Knochenmark. Um eine Sensitivität von 10–7 zu erreichen, müssen etwa 2x108 kernhaltige Zellen untersucht werden. In der spanischen Arbeit wurden CD138+ Zellen aus insgesamt etwa 50ml Peripherieblut angereichert und mittels „next-generation flow“ (NGF) untersucht. Durch das große Blutvolumen konnte für die MRD-Detektion eine Sensitivität von 10–7 erreicht werden („blood flow“ NGF). Ein Vergleich von „blood flow“ NGF mit routinemäßig eingesetztem NGF an Knochenmarkproben zeigte eine gute Übereinstimmung beider Untersuchungstechniken.
Zum gegenwärtigen Zeitpunkt ist es noch fraglich, ob der klinische Nutzen der Sensitivitätserhöhung den hohen Aufwand und die Notwendigkeit der Gewinnung größerer Mengen an Knochenmark/Peripherieblut rechtfertigen kann. Aus unserer Sicht handelt es sich jedenfalls um interessante Bemühungen, die diagnostischen Möglichkeiten bezüglich MRD-Testung zu optimieren.
MGUS: öfter als vermutet
Die Prävalenz der monoklonalen Gammopathie unbestimmter Signifikanz (MGUS) ist höher als frühere Untersuchungen vermuten lassen. Zu diesem Schluss kommt die IsTopMM-Studie, welche mehr als 72000 Isländer inkludiert hat.3 Bei 4,4% der über 40 Jahre alten Bevölkerung ließ sich mittels Serumelektropherese eine M-Komponente nachweisen. Am häufigsten wurden M-Proteine des Isotyps IgG, gefolgt von IgA und IgM, detektiert, weiter auch biklonale Komponenten.
Bekanntermaßen steigt die Häufigkeit von MGUS mit zunehmendem Lebensalter stark an. Bemerkenswert erscheint die Beobachtung von transienten M-Proteinen, die immerhin bei 9,8% der untersuchten Probanden mittels Serumelektropherese festgestellt wurden. Bei Anwendung der sensitiveren Massenspektrometrie lag der Prozentsatz transienter M-Komponenten bei 2,6%. Dies weist darauf hin, dass die Konzentration eines M-Gradienten wieder abnehmen kann, wenn ein vermeintlicher inflammatorischer Stimulus wegfällt (häufig unter die Nachweisgrenze der Serumelektropherese, aber selten unter jene der Massenspektrometrie). Dieses Phänomen war gehäuft bei Personen mit akuten Infektionen, Autoimmunerkrankungen, chronisch obstruktiver Lungenerkrankung (COPD) und Asthma und Krebs zu beobachten.
Vorzeitige Therapie der SMM? Es bleibt spannend
Die mögliche Relevanz einer frühzeitigen Behandlung von Patienten mit „smoldering multiple myeloma“ (SMM) war Gegenstand mehrerer Studien. Die Ergebnisse der ASCENT-Studie wurden beim ASH-Meeting 2022 zum ersten Mal vorgestellt.4
In diese Phase-II-Studie wurden 87 Patienten mit SMM, die mittels der rezenten Klassifikation der International Myeloma Working Group (IMWG) als Hochrisikopatienten eingestuft wurden, eingeschlossen. Das Risiko solcher Patienten, dass ihre Krankheit innerhalb von 2 Jahren in ein MM übergeht, liegt bei 44%. Die Patienten wurden einer intensiven Induktions- und Konsolidierungsbehandlung mit jeweils 4 Zyklen Daratumumab(Dara)-KRd, gefolgt von weiteren 12 Zyklen Erhaltungstherapie mit Daratumumab/Lenalidomid unterzogen.
Erwartungsgemäß konnten hohe Ansprechraten (≥VGPR 92%, ≥CR 64%) beobachtet werden. Nach einer kurzen Nachbeobachtungszeit von 26 Monaten wurden vier Todesfälle verzeichnet, drei aufgrund einer Virusinfektion (2x Covid und 1x RSV), einer aufgrund einer Progression.
Leider werden viele dieser Studien ohne unbehandelte Kontrollgruppe durchgeführt, sodass am Ende die zentrale Frage, ob mit einer vorzeitigen Behandlung im asymptomatischen Stadium eine Verbesserung der Lebenserwartung erreicht wird, nicht geklärt werden kann. Dies trifft auch auf die GEM-CESAR-Studie aus Spanien zu, bei der die Patienten einer KRd-Induktion, autologen Transplantation, KRd-Konsolidierung und Erhaltungstherapie mit KR unterzogen werden. Die Ansprechraten sind beachtlich, auch die Rate des progressionsfreien Überlebens (PFS) nach 5 Jahren ist mit 72% hoch.5
MAIA-Studie: bessere Lebensqualität für NTE-Patienten
Bei Patienten, die nicht für eine Transplantation geeignet (NTE) sind, gab es verschiedene Updates laufender Studien. Besonders bemerkenswert war das Langzeit-Follow-up der MAIA-Studie, die Dara-Rd mit Rd verglichen hat. Nach einem medianen Follow-up von etwa 65 Monaten konnte bei den 737 randomisierten Patienten der signifikante Vorteil der Dara-Rd-Kombination gegenüber Rd nicht nur in Bezug auf das PFS, sondern auch in Bezug auf das Gesamtüberleben (OS) untermauert werden. Die Überlebensrate nach 5 Jahren lag in der Kombinationsgruppe bei 66,6% und in der Rd-Gruppe bei 53,6%.6 Die Rate an MRD-negativen Befunden sowie jene an anhaltenden MRD-negativen Befunden war in der Kombinationsbehandlungsgruppe viermal höher als im Rd-Arm. Daten zur Lebensqualität zeigten eine signifikante Verbesserung durch die Antikörperkombination, insbesondere in Bezug auf eine Reduktion der Schmerzintensität.7
Weniger Dexamethason bei neu diagnostizierten Patienten?
Salomon Manier ging der Frage nach, ob bei neu diagnostizierten Patienten über 65 Jahre Dexamethason eingespart werden kann, was durch den Vergleich von Dara-R mit Rd evaluiert wurde.8 Insgesamt konnte mit Dara-R eine höhere Ansprechrate (89% vs. 77%) und eine höhere Rate an ≥VGPR (58% vs. 42%) nach 12 Monaten beobachtet werden.
Somit führte Dara-R zu tieferem und schnellerem Ansprechen, allerdings wurden unter Dara-R mehr Grad ≥3 hämatologische Toxizität und vermehrt Covid-Infektionen beobachtet. Die Häufigkeit von Grad-≥3-Infektionen war allerdings im Dara-R-Arm mit 13% numerisch geringer als in der Rd-Gruppe (17%).
Viele neue Daten zu Patienten mitRisikozytogenetik
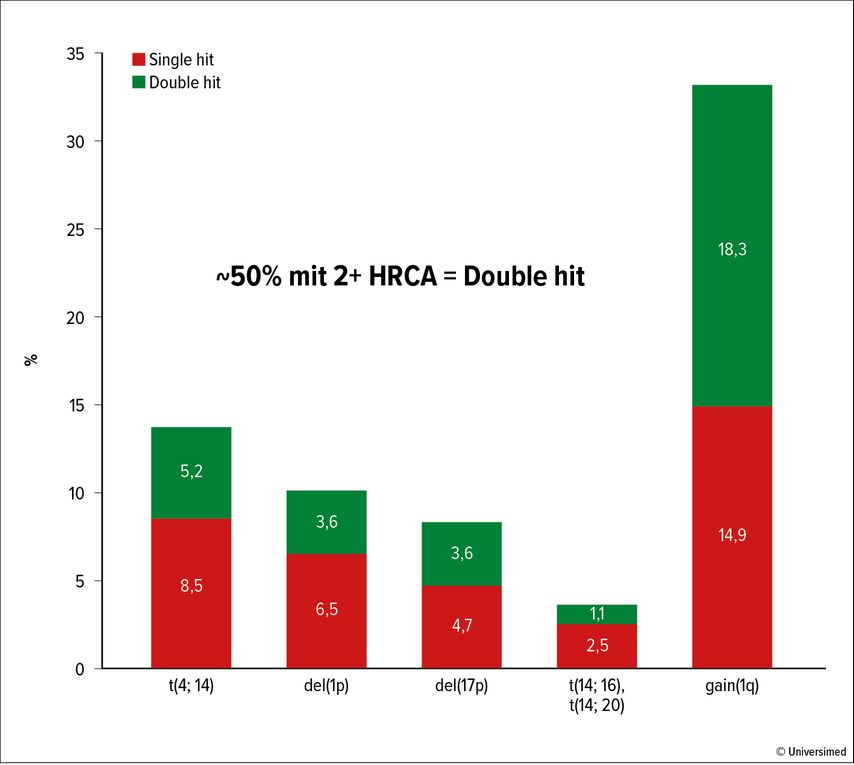
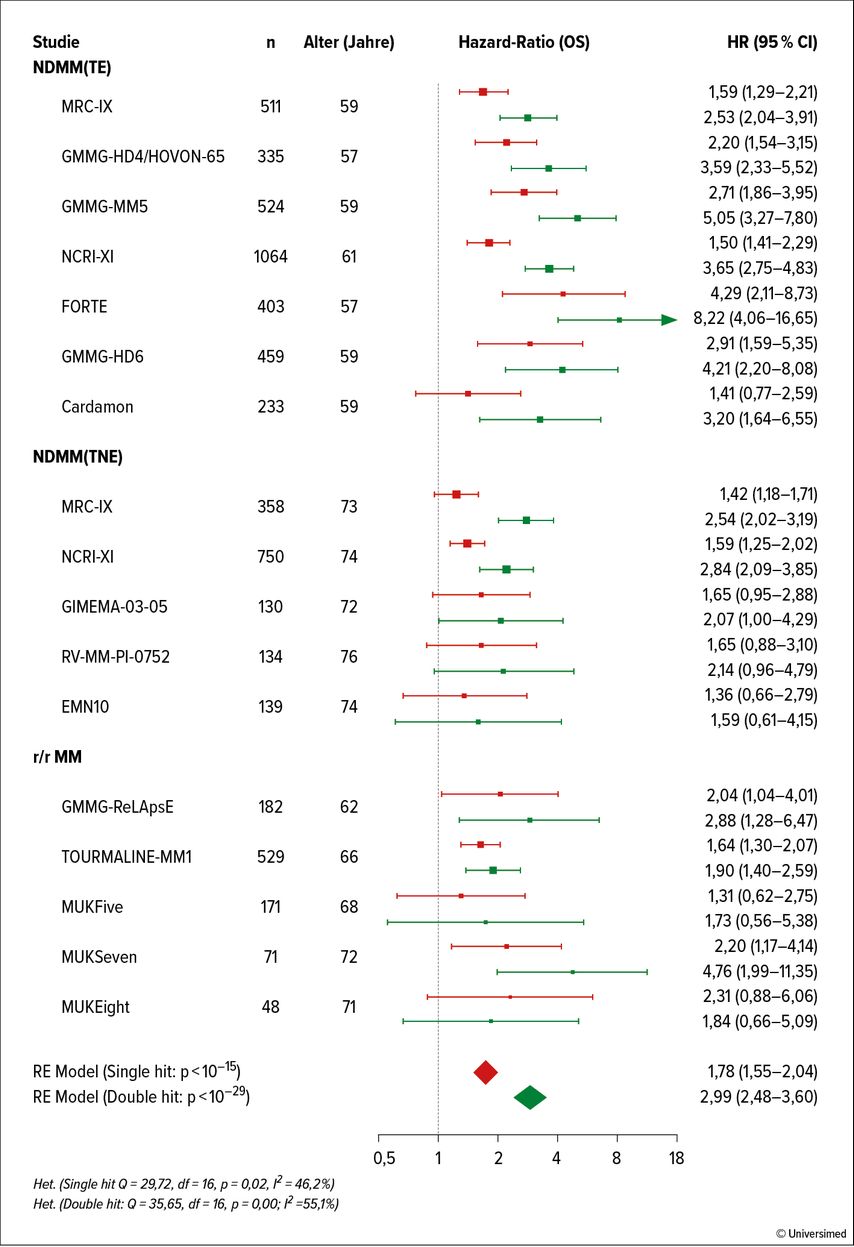
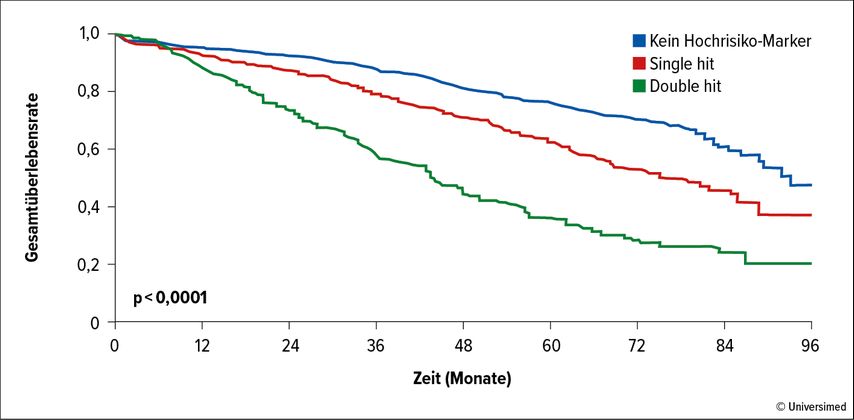
Nach wie vor stellen Patienten mit Risikofaktoren die größte therapeutische Herausforderung dar. Martin Kaiser und Kollegen haben die Häufigkeit von zytogenetischen Aberrationen sowie deren Relevanz für das Behandlungsergebnis in 17 Phase-III-Studien analysiert.9 Abbildung 1 zeigt die Häufigkeit der zytogenetischen Aberrationen t(4;14), del1p, del17p, t(14;16), t(14;20) und +1q21 bei 5808 Patienten. Die t(4;14)-Translokation wurde bei 14%, del17p bei 8% und eine Amp1q21 bei 33% der untersuchten Patienten festgestellt. 50% der Patienten mit einer dieser Risikoaberrationen wiesen eine zweite auf („Double hit“-Status). Patienten mit zytogenetischen Risikofaktoren, insbesondere jene mit „Double hit“-Status, zeigen selbst unter intensivierten Therapiemaßnahmen ein ungünstigeres Outcome. Abbildung 2 zeigt die Hazard-Ratios (HR) bezüglich PFS von neu diagnostizierten Patienten, die in 17 randomisierte Studien eingebracht wurden. In Abbildung 3 sind die entsprechenden Überlebenskurven von Patienten der Myeloma-XI-Studie dargestellt, die eine signifikante Reduktion der Überlebenswahrscheinlichkeit in der Risikogruppe mit einer, aber ganz besonders ausgeprägt in jener mit zwei („double hit“) Aberrationen zeigen.
Abb. 1: Inzidenz von zytogenetischen Aberrationen bei 5808 Patienten. HRCA, Hochrisikozytogenetische Aberrationen. Modifiziert nach Panopoulou A et al.25
Abb. 2: Hazard-Ratio bezüglich progressionsfreien Überlebens bei Patienten mit einer bzw. zwei (double hit) zytogenetischen Aberrationen in 17 prospektiv randomisierten Studien. NDMM, neu diagnostiziertes MM; TE, „transplant eligible“. Modifiziert nach Kaiser M et al.9
Abb. 3: Gesamtüberleben von Patienten mit Standardrisiko und mit einem oder zwei zytogenetischen Risikofaktoren in der Myeloma-XI-Studie. Modifiziert nach Shah V et al.26
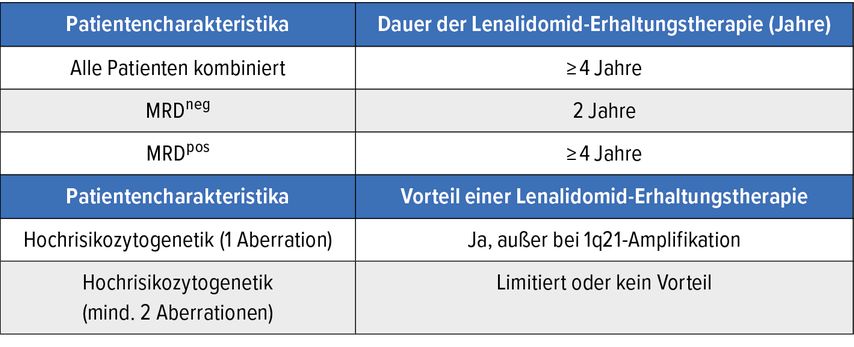
Bis heute ist es fraglich, ob die Behandlungsergebnisse bei Patienten mit Hochrisikozytogenetik mit einer längeren Therapiedauer, wie zum Beispiel in der CONCEPT-Studie mit 10 Zyklen Isatuximab-KRd gefolgt von einer Isatuximab/Lenalidomid-Erhaltungstherapie10, verbessert werden können. Ähnliches gilt für eine erhöhte Therapieintensität, wie die zusätzliche Kombination von Dara-KRd mit Cyclophosphamid, welche in der OPTIMUM-Studie evaluiert wurde.11 Durch Therapieeskalation können höhere Ansprechraten sowie eine Verlängerung des PFS erzielt werden. Bisher gibt es jedoch keine Hinweise, dass das OS der Hochrisikopatienten an jenes der Standardrisikopatienten herangeführt werden kann. Charlotte Pawlyn hat die Daten der Myeloma-XI-Studie in Hinsicht auf die optimale Dauer einer Lenalidomid-Erhaltungstherapie analysiert.12 Bei der Gesamtgruppe der Patienten führte eine über 4 Jahre hinausgehende Erhaltungstherapie mit Lenalidomid zu einer signifikanten Verlängerung des PFS. Analysiert man aber einzelne Subgruppen, so zeigen sich interessante Details. Auch bei Patienten mit einer einzigen zytogenetischen Risikoaberration wie del17p, t(4;14), del1p konnte mit Lenalidomid-Erhaltungstherapie eine Verlängerung des PFS beobachtet werden. Kein Vorteil für die Erhaltungstherapie wurde bei Patienten mit Amplifikation von 1q21 sowie bei jenen mit „Double hit“-Aberrationen gefunden. Bei MRD-negativen Patienten hat eine über zwei Jahre hinausgehende Erhaltungstherapie keinen PFS-Vorteil erbracht, wohl aber bei MRD-positiven Patienten. Bei der letztgenannten Gruppe sollte die Erhaltungsbehandlung – wenn möglich – über 4 Jahre verabreicht werden. Eine Zusammenfassung der für die klinische Praxis wichtigen Ergebnisse bietet Tabelle 1.
Tab. 1: Optimale Dauer einer Lenalidomid-Erhaltungsbehandlung in Abhängigkeit von zytogenetischen Risikofaktoren und dem MRD-Status. Modifiziert nach Pawlyn C et al.12
r/r MM: Fokus auf bispezifischen Antikörpern und CAR-T-Zellen
Auf die zahlreichen Studien bei Patienten mit relapsiertem bzw. refraktärem multiplem Myelom (r/r MM) kann hier aus Platzgründen nur beschränkt eingegangen werden. Paul Richardson hat Ergebnisse zu dem oralen Cereblon-Ligase-Modulator (CELMoD) Mezigdomid bei Patienten mit r/r MM und ≥3 Vortherapien vorgestellt.13 Die Ansprechrate lag in der Gesamtgruppe bei 40%, bei Patienten mit Weichteil-Plasmozytomen (extra- und paramedullär) bei 30% und bei jenen, die eine BCMA(B-Zellreifungsantigen)-gezielte Therapie erhalten hatten, bei 50%. Das PFS war allerdings mit etwa 4 Monaten nicht überzeugend. Die Behandlung wurde relativ gut vertragen, trotz hämatologischer Nebenwirkungen gab es nur 6% Grad-4-Infektionen.
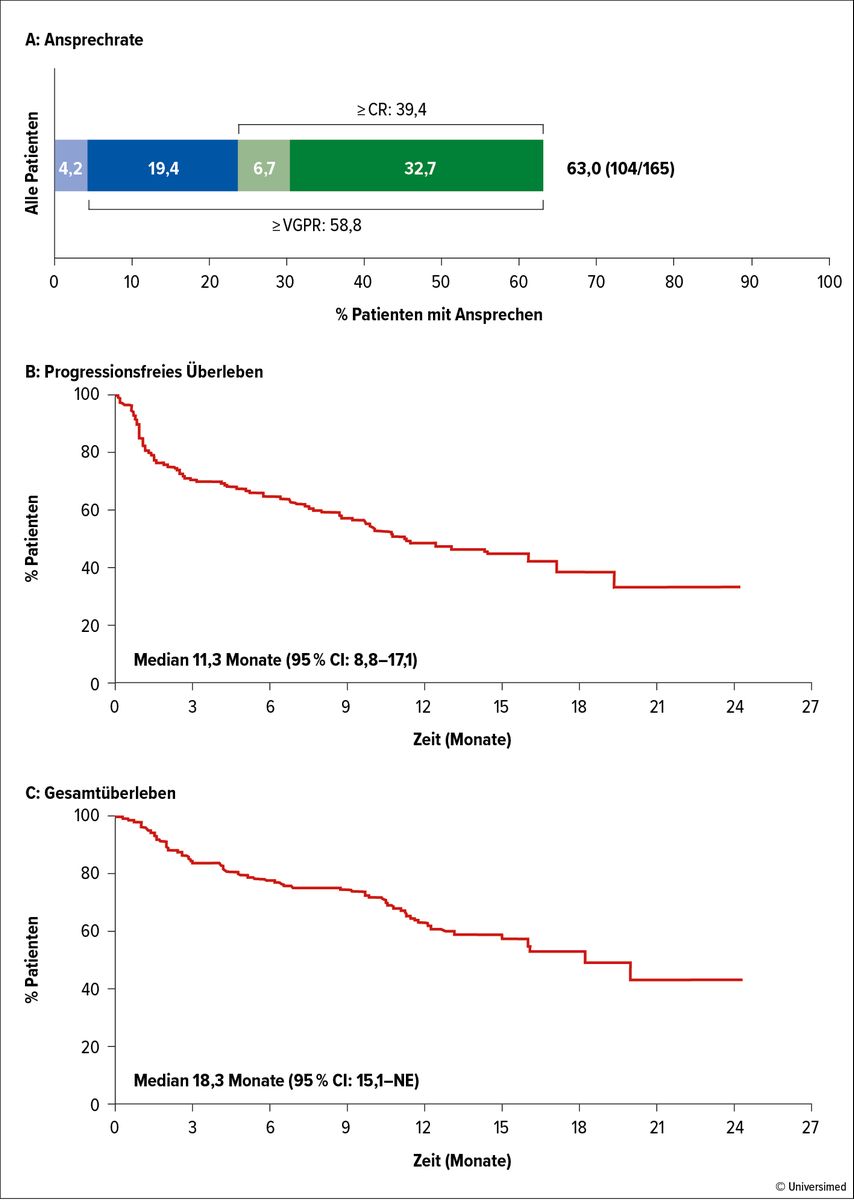
Besonderes Interesse wurde den neuen Immuntherapien, den bispezifischen Antikörpern sowie den zellulären Therapien entgegengebracht. Erwartungsgemäß wurden die zusätzlichen Erfahrungen mit dem bereits zugelassenen bispezifischen Antikörper Teclistamab und den weiter in der Entwicklung befindlichen Substanzen Talquetamab und Elranatamab ausführlich präsentiert und diskutiert. Außerdem wurden die Ergebnisse der noch früher in der klinischen Entwicklung befindlichen bispezifischen Antikörper vorgestellt. Mit Teclistamab wurden bei Patienten mit r/r MM und 5 Vortherapien eine Ansprechrate von 63% und ein medianes PFS von 11,3 Monaten beobachtet (Abb. 4).14 Vergleichbare Ergebnisse wurden mit Talquetamab berichtet: Die Patienten hatten ebenfalls 5 Vortherapien, erreichten eine Responserate von 74,1% und ein PFS von 7,5 Monaten.15 Das Target von Talquetamab ist GPRC5D („G protein-coupled receptor, class C group 5 member D“), welches allerdings nicht nur an Myelomzellen, sondern auch auf keratinhaltigen Geweben exprimiert wird. Letzteres erklärt die ungewöhnlichen Nebenwirkungen wie Geschmacksstörungen, Hautläsionen, Nagelveränderungen und Exantheme. Cevostamab ist ein gegen FcRH5 („Fc receptor-homolog 5“) gerichteter bispezifischer Antikörper, welcher bei multipel vorbehandelten Patienten mit r/r MM eine Responserate von 37,2% erbrachte. Bei Patienten, die zusätzlich Tocilizumab zur Mitigierung eines Zytokinfreisetzungssyndroms (CRS) erhielten, lag die Ansprechrate bei 54,8% und die Dauer des Ansprechens bei 11,3 Monaten.16
Abb. 4: Teclistamab-Therapie bei Patienten mit r/r MM mit ≥3 Vortherapielinien: Ansprechrate (A), progressionsfreies Überleben (B) und Gesamtüberleben (C). Modifiziert nach Moreau P et al.14
Es wird wohl in Zukunft möglich sein, bispezifische Antikörper mit verschiedenen Targets sequenziell bzw. in Kombination einzusetzen. Auf das unterschiedliche Dosierungsintervall dieser Substanzen sollte hingewiesen werden. Teclistamab und Talquetamab werden wöchentlich und Cevostamab in 3-wöchentlichen Intervallen verabreicht. Als Nebenwirkungen von bispezifischen Antikörpern sind in erster Linie Infektionen zu nennen, deren Häufigkeit mit 27% bis 67% angegeben wird, wobei jene von Grad-3- und -4-Infektionen zwischen 9% und 35% liegt.17,18 Zur Verhinderung eines CRS wird typischerweise eine „Step up“-Dosierung empfohlen.
Updates zu Ide-Cel und Cita-Cel
Eine ähnliche Dichte an Informationen zu klinischer Effizienz und Toleranz wurde über verschiedene CAR-T-Zell-Präparate geboten. Von den beiden zugelassenen Präparaten Ide-Cel (KarMMa-Studien) und Cilta-Cel (CARTITUDE-Studien) wurden Updates bzw. Analysen bei bestimmten Subgruppen vorgestellt. Beeindruckende Ergebnisse wurden mit Cilta-Cel erzielt, welches über einen bivalenten Rezeptor gegen BCMA verfügt. Fast 98% der mit median 6 Therapielinien vorbehandelten Patienten zeigten ein Ansprechen. Das mediane PFS war nach langer Nachbeobachtung noch nicht erreicht und liegt derzeit nach einer Beobachtungszeit von 27 Monaten bei 54,9%.19
Typischerweise kommt es bei den zugelassenen CAR-T-Zell-Präparaten fast regelmäßig zu CRS Grad 1–2. Grad >3 CRS wurden nur bei 4% bzw. 6% (Cilta-Cel vs. Ide-Cel) der Patienten beobachtet. Neurotoxizität ist ein weiteres Problem der CAR-T-Zell-Therapie und trat bei 21,6% respektive 20% der Patienten auf, wobei eine Grad-3- bzw. -4-Ausprägung bei 12,3% bzw. 6% beobachtet wurde.19–21 Mittlerweile liegen auch Daten vor, die zeigen, dass mit Ide-Cel in der „real world“ klinischen Praxis vergleichbare Resultate wie in der streng kontrollierten Phase-II-Studie erzielt werden können.22 Mit einer allogenen CAR-T-Zell-Präparation wurde eine Ansprechrate von 67% und eine Responsedauer von 8,3 Monaten gesehen.23
Natürlich sind weitere zahlreiche Bemühungen, die CAR-T-Zell-Therapie zu optimieren, im Gange. Dazu zählen die Transfektion mit einem bispezifischen Rezeptor, der sowohl CD19 als auch BCMA bindet, sowie optimierte Herstellungsprozesse, die zu einer starken Verkürzung der Produktionszeit von CAR-T-Zellen auf 24 bis 72 Stunden führen.24 Aufgrund dieser wahrlich beeindruckenden Ergebnisse sind mittlerweile Studien mit CAR-T-Zellen in der Erstlinientherapie sowohl bei jüngeren als auch älteren Patienten am Laufen. Es ist zu hoffen, dass damit eine weitere substanzielle Verbesserung der Behandlungsergebnisse erzielt werden kann.
Literatur:
1 Derman BA et al.: ASH 2022; Abstr. #870 2 Notarfranchi L et al.: ASH 2022; Abstr. #865 3 Love JT et al.: ASH 2022; Abstr. #103 4 Kumar S et al.: ASH 2022; Abstr. #757 5 Mateos MV et al.: ASH 2022; Abstr. #118 6 Kumar S et al.: ASH 2022; Abstr. #4559 7 Perrot A et al.: ASH 2022; Abstr. #472 8 Manier S et al.: ASH 2022; Abstr. #569 9 Kaiser MF et al.: ASH 2022; Abstr. #644 10 Weisel K et al.: ASH 2022; Abstr. #759 11 Kaiser M et al.: ASH 2022; Abstr. #758 12 Pawlyn C et al.: ASH 2022; Abstr. #570 13 Richardson PG et al.: ASH 2022; Abstr. #568 14 Moreau PH et al.: N Engl J Med 2022; 387: 495-505 15 Chari A et al.: ASH 2022; Abstr. #157 16 Trudel S et al.: ASH 2022; Abstr. #567 17 Raje N et al.: ASH 2022; Abstr. #158 18 Bahlis NJ et al.: ASH 2022; Abstr. #159 19 Martin T et al.: J Clin Oncol 2023; 41: 1265-74 20 Munshi NC et al.: N Engl J Med 2021; 384: 705-16 21 Berdeja JG et al.: Lancet 2021; 398: 314-24 22 Hansen DK et al.: J Clin Oncol 2023; JCO2201365 23 Mailankody S et al.: ASH 2022; Abstr. #2019 24 Du J et al.: ASH 2022; Abstr. #366 25 Panopoulou A et al.: Blood 2022; blood.2022018339 26 Shah V et al.: Leukemia 2020; 34: 3091-6
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...