Nur wer sein Ziel kennt, findet den Weg
Bericht:
Dr. Kassandra Settele
Review von:
OA Dr. Maximilian Hochmair
Leiter der pneumo-onkologischen
Ambulanz + Tagesklinik
Abteilung für Innere Medizin und Pneumologie
Karl-Landsteiner-Institut für Lungenforschung und pneumologische Onkologie
Klinik Floridsdorf, Wien
Kaum ein Feld hat die Lungenkrebsbehandlung so sehr revolutioniert wie die zielgerichteten Therapien. Die Möglichkeit, RET-Fusionen gezielt zu behandeln, stellt dabei die neueste Option für eine Gruppe von Patienten mit NSCLC dar. Ergebnisse aus den Zulassungsstudien zu RET-Inhibitoren und Real-World-Daten lesen Sie hier.
Um eine personalisierte Diagnostik und Therapie anbieten zu können, ist eine zunehmende Interaktion zwischen klinischer Onkologie, Pathologie und Radiologie immer mehr notwendig. Während die systemische Therapie bei Patienten mit nicht kleinzelligen Lungenkarzinomen (NSCLC) früher rein nach klinischen Kriterien erfolgte, hat sich die Stratifizierung nach molekularen Markern in der fortgeschrittenen Situation heute in den Leitlinien etabliert. Nur anhand der entsprechenden Testungen können zielgerichtete Therapien ausgewählt und den Patienten angeboten werden.
RET-Fusionen
Bei den verschiedenen Krebserkrankungen ist mittlerweile eine Fülle an Mutationsmarkern bekannt. Doch vieles befindet sich auch derzeit noch in klinischer Forschung. Erst 2020 sind die RET-Alterationen als therapierbares Ziel beim Lungenkarzinom hinzugekommen.
RET-Fusionen führen zu einer dauerhaften Aktivierung der Tyrosinkinase, was das Zellwachstum anregt. Sie sind als starke onkogenetische Treiber bei Lungen- und Schilddrüsenkarzinomen bekannt. 20% der papillären Schilddrüsenkarzinome weisen eine RET-Fusion auf, während beim NSCLC RET-Fusionen selten vorliegen, in etwa 1–2% der Fälle.
Trotz des seltenen Vorkommens sind RET-Alterationen hochrelevant für die Therapieentscheidung: Patienten mit RET-Fusionen sprechen nur beschränkt auf Immuntherapien, Multikinase-Inhibitoren und Chemotherapien an. Daher sollte mit der NSCLC-Behandlung wenn möglich zugewartet werden, bis sämtliche molekularpathologische Tests ausgewertet wurden. Die Subtypisierung nach Fusionspartnern von RET wiederum hat für die therapeutische Entscheidung keine Konsequenz.
Mit Selpercatinib und Pralsetinib stehen mittlerweile zwei spezifische, hochwirksame Tyrosinkinase-Inhibitoren für Patienten mit RET-Fusionen zur Verfügung. Bei beiden Substanzen handelt es sich um Multikinase-Inhibitoren, die neben RET weitere Targets abdecken.
LIBRETTO-001
Die „open-label“, multizentrische Phase-I/II-Studie LIBRETTO-001 untersuchte die Anwendung von Selpercatinib bei verschiedenen Krebsarten mit RET-Alteration. In Hinblick auf das NSCLC waren 253 Patienten mit RET-Fusion eingeschlossen. Eine Evaluierung bezüglich der Effektivität war bei 105 Patienten, die in der Vorgeschichte eine Platin-basierte Chemotherapie erhalten hatten, und 39 nicht vorbehandelten Patienten möglich. Der primäre Studienendpunkt war die objektive Ansprechrate (ORR) nach RECIST 1.1, sekundäre Endpunkte umfassten die Dauer des Ansprechens (DOR), das progressionsfreie Überleben (PFS) sowie die Sicherheit.
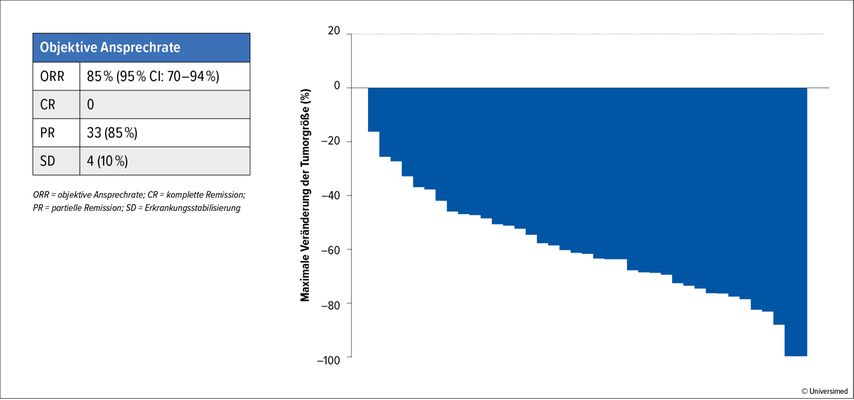
LIBRETTO-001 konnte beeindruckende Ansprechraten zeigen: 85% der nicht vorbehandelten Patienten erreichten ein objektives Ansprechen (Abb. 1). In der Gruppe der Patienten mit einer Platin-basierten Therapie in der Vorgeschichte lag die ORR bei 64%.
Abb. 1: Ansprechen der nicht vorbehandelten Patienten in LIBRETTO-001 (modifiziert nach Drilon A et al.)1
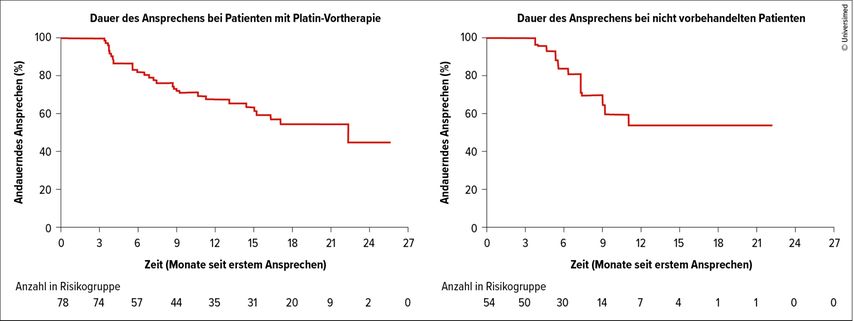
Nach einem medianen Follow-up von 7,4 Monaten war die mediane Ansprechdauer bei den nicht vorbehandelten Patienten noch nicht erreicht. Die 1-Jahres- PFS-Rate in dieser Gruppe wurde auf 75% geschätzt.
Für die Patienten mit einer Platin-basierten Therapie in der Vorgeschichte lag die mediane Ansprechdauer nach einem medianen Follow-up von 12,1 Monaten bei 17,5 Monaten und das mediane PFS wurde auf 16,5 Monate geschätzt.
Die Krankheitskontrollraten waren ebenfalls bemerkenswert und betrugen 95% bei den nicht vorbehandelten und 92% bei den Patienten mit vorheriger Platintherapie.
11 NSCLC-Patienten wiesen messbare Gehirnläsionen auf, sodass sie hinsichtlich des intrazerebralen Ansprechens evaluiert werden konnten. Dabei zeigte sich deutlich die hohe Wirksamkeit von Selpercatinib auch im Gehirn mit einer ORR von 91%.
In 15% der Fälle traten unerwünschte Wirkungen auf. Am häufigsten kam es zu Mundtrockenheit, die jedoch mit z.B. Kaugummis in den meisten Fällen gelindert werden kann. Weiters traten u.a. gastrointestinale Nebenwirkungen auf, es kam unter der Medikation zu Bluthochdruck, Ödemen, einer QT-Verlängerung, Ausschlägen oder einem Anstieg der Leberfunktionsparameter. Es ist empfehlenswert, die Patienten über die möglichen Nebenwirkungen aufzuklären und regelmäßige Blutdruckmessungen zu Hause zu empfehlen sowie EKG- und Laborkontrollen durchzuführen. Die unerwünschten Wirkungen lassen sich meistens durch supportive Maßnahmen (z.B. Stützstrümpfe bei Ödemen) und Dosisreduktion handhaben. 5% der Probanden brachen die Studienmedikation mit Selpercatinib aufgrund von Nebenwirkungen ab.
Die Anwendung erfolgt oral in zwei Dosen täglich mit insgesamt 160mg. Beim NSCLC ist Selpercatinib zugelassen als Zweitlinientherapie bis zum Auftreten einer Krankheitsprogression oder unakzeptabler Toxizität.
ARROW
In der Multikohorten-, „open-label“ Phase-I/II-Studie ARROW wurde der RET-Inhibitor Pralsetinib bei unterschiedlichen Tumorentitäten bei Vorliegen einer RET-Fusion untersucht. Es waren 216 RET-positive Patienten mit NSCLC eingeschlossen.
Auch in dieser Studie konnte ein bemerkenswertes Ansprechen von 69% in der Gruppe der NSCLC-Patienten gezeigt werden. Dabei lag die Ansprechrate bei den nicht vorbehandelten Patienten bei 79% und bei den Patienten, die zuvor eine Platin-basierte Chemotherapie erhalten hatten, bei 62%. Die mediane Ansprechdauer betrug bei den NSCLC-Patienten insgesamt 22,3 Monate und war in der Subgruppe der Platin-vorbehandelten Patienten ebenso lang (Abb. 2). Für die nicht vorbehandelten Patienten war zum Zeitpunkt der Analyse die mediane DOR noch nicht erreicht (Abb.2). Zur intrakranialen Wirksamkeit wurde in der ARROW-Studie eine Ansprechrate von 51% beschrieben.
Insgesamt betrug die Krankheitskontrollrate 92% und lag bei den Patienten mit Platin-Vortherapie bei 91%, bei den nicht vorbehandelten Patienten bei 93%. Das mediane PFS lag insgesamt bei 16,4 Monaten (16,5 Monate bei den Patienten mit Platin-Vortherapie und 13,0 Monate bei nicht vorbehandelten Patienten).
Das Nebenwirkungsprofil unterscheidet sich teilweise von dem von Selpercatinib. Unter Pralsetinib traten als häufigstes unerwünschtes Ereignis Neutropenien auf. Des Weiteren wurden u.a. erhöhte Leberfunktionsparameter, Bluthochdruck, gastrointestinale Nebenwirkungen und Pneumonitis berichtet. Zu einem Therapieabbruch kam es bei 4% der Patienten.
Pralsetinib wird einmal am Tag nüchtern eingenommen, in einer oralen Verabreichung von 400mg am Tag. Es ist beim RET-positiven NSCLC als Erstlinientherapie zugelassen.
Real World: SIREN
Die internationale, retrospektive Analyse SIREN befasste sich mit 50 Patienten mit RET-positivem, fortgeschrittenem NSCLC, die nicht in eine Studie eingeschlossen werden konnten und Selpercatinib im Rahmen eines „access program“ erhalten hatten. 37 Patienten waren bereits vorbehandelt. 28% der Patienten wiesen einen schlechten Performance Status (ECOG PS ≥ 2) auf.
Die Ansprechrate betrug 68% und eine Krankheitskontrolle wurde bei 92% der Patienten erzielt. Hinsichtlich dieser beiden Parameter fand sich in SIREN zwischen den vorbehandelten und nicht vorbehandelten Patienten kein Unterschied.
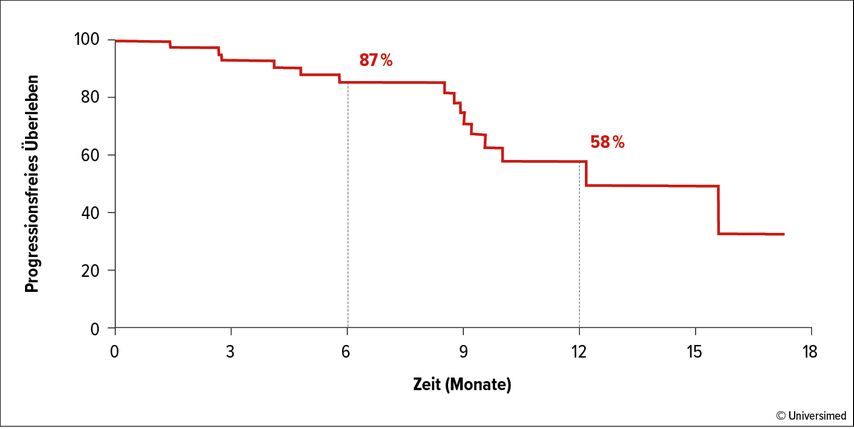
Das mediane PFS lag nach einem medianen Follow-up für die Gesamtpopulation und für die nicht vorbehandelten Patienten bei 15,6 Monaten. Bei den vorbehandelten Patienten lag das PFS im Median bei 12,2 Monaten. Die PFS-Rate insgesamt betrug nach einem Jahr 58% (Abb. 3). Bei allen 8 Patienten mit Hirnmetastasen, die bezüglich des intrakranialen Ansprechens evaluiert wurden, wurde ein objektives Ansprechen festgestellt.
Bei 88% traten unerwünschte Wirkungen auf, diese waren hauptsächlich von Grad 1–2. Insgesamt waren die Nebenwirkungen gut handhabbar. Bei 40% der Patienten veranlassten die auftretenden Nebenwirkungen eine Dosisreduktion bzw. bei 26% eine Therapieunterbrechung, jedoch kam es zu keinem Therapieabbruch aufgrund von Nebenwirkungen.
Fazit
Die Therapie mit einem RET-Inhibitor ist eine hocheffektive Option für RET-positive NSCLC-Patienten; eine Patientenpopulation, die auf andere Therapien wie Chemotherapien oder Immuntherapie nur unzureichend anspricht. Die aktuell zugelassenen RET-Inhibitoren Selpercatinib und Pralsetinib unterscheiden sich teilweise im Nebenwirkungsprofil sowie in der Art der Zulassung (Erstlinie vs. Zweitlinie). Ein Head-to-Head-Vergleich der beiden Substanzen wurde bisher nicht durchgeführt.
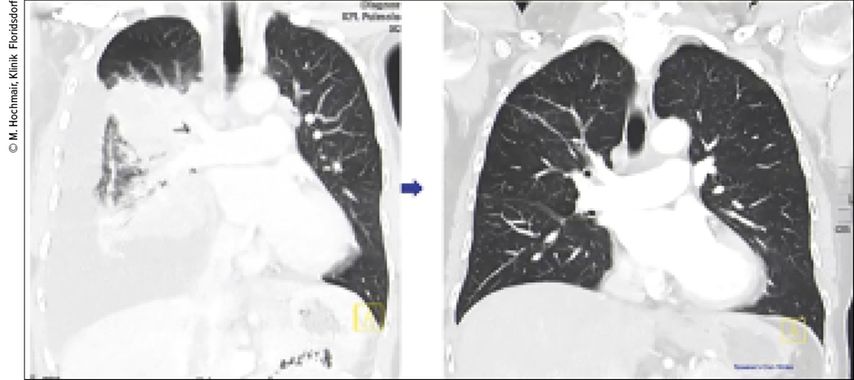
Abb. 4 zeigt bildkräftig das Beispiel einer 69-jährigen, hochsymptomatischen Patientin, die nach Erstlinienbehandlung mit einer Chemoimmuntherapie in der Zweitlinie nach Gabe von Selpercatinib eine komplette Remission erreichte. Erfolgserlebnisse wie dieser Schuss direkt aufs Ziel sind, was die Pneumoonkologie zu so einem spannenden und faszinierenden Fachgebiet machen.
Literatur:
1 Drilon A et al.: Efficacy of selpercatinib in RET fusion-positive non-small-cell lung cancer. N Engl J Med 2020; 383(9): 813-24 2 Curigliano G et al.: Safety and efficacy of pralsetinib in patients with advanced RET fusion-positive non-small cell lung cancer: update from the ARROW trial. ASCO 2021; Abstr. #9089 3 Illini O et al.: Selpercatinib in RET fusion-positive non-small-cell lung cancer (SIREN): a retrospective analysis of patients treated through an access program. Ther Adv Med Oncol 2021; 13: 17588359211019675
Übrige Literatur bei Dr. Hochmair
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...