
NSCLC im Stadium IIIA: die Perspektive der Strahlentherapie
Autorin:
Ao. Univ.-Prof. Dr. Heidi Stranzl-Lawatsch
Suppl. Klinikvorständin der Universitätsklinik für Strahlentherapie-Radioonkologie, Graz
E-Mail: heidi.stranzl@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Strahlenbehandlung ist eine nicht invasive Behandlung und integraler Bestandteil in der klinischen Behandlung von Patienten mit lokal fortgeschrittenem Bronchialkarzinom. Die Anwendung modernster Bestrahlungstechnik mit 4D-CT-Planung und bildgeführter Strahlentherapie reduziert mögliche Nebenwirkungen erheblich. Selbst im Falle eines oligometastasierten Progresses ist eine weitere kurative Therapie nicht auszuschließen.
Keypoints
-
Das NSCLC im Stadium IIIA umfasst eine sehr heterogene Gruppe von Erkrankungsmanifestationen und die Prognose wird entscheidend vom Lymphknotenstatus bestimmt. Eine kombinierte Radio-(Chemo)-Therapie (RCT) ist im Falle einer Inoperabilität der bisherige Behandlungsstandard.
-
Mit den Daten aus der PACIFIC-Studie steht mit dem PD-L1-Antikörper Durvalumab für das inoperable Stadium III ein überaus wirksames Präparat mit moderaten Nebenwirkungen zur Konsolidierung zur Verfügung. Die Zulassung betrifft Patienten mit einer PD-L1-Expression am Tumor von ≥1%, die nach platinbasierter RCT keinen progredienten Verlauf zeigen. Der Beginn der Therapie mit Durvalumab soll möglichst zeitnahe nach Ende der RCT (≤14 Tage) erfolgen.
-
Die Entscheidung bezüglich individuell optimaler Therapie ist im interdisziplinären Tumorboard vor Start der Behandlung unter Einbeziehung der individuellen Patientenpräferenz zu treffen.
Die multimodale Therapie beim Lungenkarzinom wurde in der Vergangenheit intensiv beforscht, ohne dass bahnbrechende Verbesserungen für Patienten entstanden wären. Erst in den letzten Jahren wurden durch den kombinierten Einsatz der Strahlenbehandlung mit Systemtherapien aufsehenerregende Fortschritte erzielt, die auf die neuen technischen Fortschritte der Strahlentherapie und mögliche Synergien mit der Immuntherapie zurückzuführen sind. Bei keiner anderen onkologischen Tumorerkrankung war in den letzten fünf Jahren die Aufmerksamkeit dafür annähernd so hoch wie beim NSCLC.
Die geeignete Therapie der Wahl im sehr heterogenen Stadium IIIA ist im Rahmen eines interprofessionellen Tumorboards multidisziplinär und unmittelbar nach Diagnosestellung festzulegen. Die jeweiligen Optionen Operation, Bestrahlung und Systemtherapie sind im Hinblick auf die individuelle Präferenz der Patienten ausführlich zu diskutieren und gegebenenfalls auch kombiniert sinnvoll anzuwenden. Die Strahlenbehandlung verbessert die lokoregionäre Kontrolle und ist oft in der Kombination mit der medikamentösen Tumortherapie effektiver als alleine angewendet.1 In den letzten Jahren wurden beim NSCLC auch der Einsatz der Immuntherapie und die Anwendung der Tyrosinkinaseinhibitoren bedeutend. Auf alle Fälle spielt die Strahlenbehandlung im Stadium IIIA eine große Rolle und ist bei Entscheidungen im Tumorboard jedenfalls zu berücksichtigen.
Therapiekonzepte im Stadium IIIA
Das Stadium IIIA umfasst eine sehr heterogene Gruppe von Patienten, vertreten sind Tumoren unterschiedlicher Primärtumorgröße und Muster in der Lymphknotenbeteiligung. Beim Lymphknotenstatus N2 ermöglicht die Klassifizierung von Robinson Unterteilungen in prognostisch unterschiedliche Gruppen. In den operablen Stadien IIIA (T3–4, N0–1) ist die Therapie der Wahl der operative Eingriff.
Im Falle einer Kontraindikation für eine Operation ist die lokale Bestrahlung eine gute Alternative. Bei gut resektablem N2-Status ist auch hier dem operativen Eingriff der Vorzug zu geben.
Eine postoperative Strahlenbehandlung (PORT) führt zwar zu einer Reduktion der Rezidive, jedoch kommt es aufgrund der höheren Toxizität zu keiner Verlängerung des Überlebens. Eine postoperative Strahlentherapie kann jedoch bei hohem Lokalrezidivrisiko (R1/R2-Situation, massiver Lymphknotenbefall oder Kapseldurchbruch) und günstiger Einschätzung der postoperativen kardiopulmonalen Funktion der Patienten erwogen werden.2
Bei dringendem Verdacht auf Befall mehrerer mediastinaler Lymphknoten ist die Prognose deutlich schlechter einzustufen als bei Befall von nur einem Level. Eine Induktion (Chemotherapie ± Radiotherapie) wird wesentlich von der funktionellen Operabilität, dem Allgemeinzustand, Komorbiditäten sowie der individuellen Präferenz der Patienten bestimmt. Nach Induktionsbehandlung ist die Beurteilung eines etwaigen Ansprechens zwingend. Bei Therapieansprechen ist eine Operation jedenfalls zu evaluieren und im Falle eines Nichtansprechens ein definitives Behandlungskonzept zu verfolgen.
Im Falle eines nicht resektablen Stadiums IIIA3m und IIIA4 ist die definitive kurative Strahlentherapie (+ platinbasierte Chemotherapie), gefolgt von einer Immuntherapie (falls keine Progredienz aufdie Radiochemotherapie auftritt), die Therapie der Wahl. Hintergrund ist die mittlerweile viel beachtete randomisierte PACIFIC-Studie.3 Subgruppenanalysen beschreiben den höchsten Profit im Stadium IIIA. Eine Strahlenbehandlung kurz vor dem Therapiestart mit dem PD-L1-Inhibitor Durvalumab kann dessen immunmodulierende Wirkung entscheidend steigern.4 Das sogenannte PACIFIC-Regime ist mittlerweile eine etablierte Standardtherapie beim fortgeschrittenen NSCLC.
Das mittlerweile vorliegende 4-Jahres-Update zeigt eine signifikante Verlängerung des Gesamt- und des progressionsfreien Überlebens, bei tolerablen Nebenwirkungen (Abb. 1).
Nach vier Jahren leben knapp 50% der Patienten in der Durvalumab(D)-Gruppe und nur 36% in der Placebogruppe. Das progressionsfreie Überleben zeigt ebenso einen signifikanten Vorteil für die Durvalumab-Gruppe im Vergleich zur Placebogruppe (35% vs. 20%) an. Bemerkenswert ist, dass auch der Start von D nach Ende der RCT von Bedeutung war (Vorteil für Start mit D weniger als 14 Tage nach Ende der RCT verglichen mit Start später als 14 Tage). Möglicherweise ist auch die temporär erhöhte PD-L1-Expression auf der Tumorzelle nach Strahlenbehandlung dafür verantwortlich. Jedenfalls hat sich dieses Therapieregime bei inoperablen Patienten als Standardtherapie etabliert und ist in den Leitlinien verankert.6,7
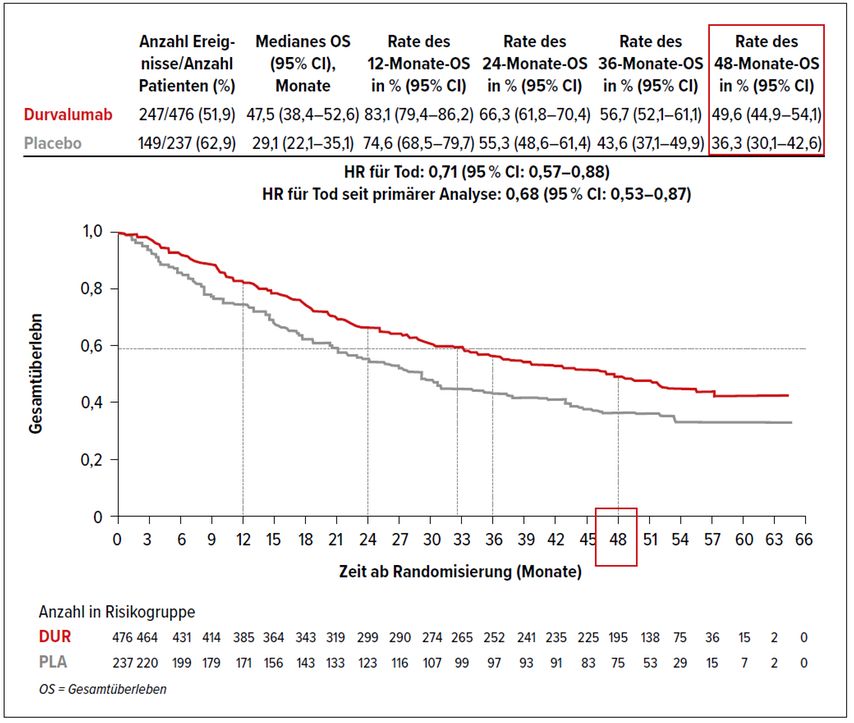
Abb. 1: Gesamtüberleben in der PACIFIC-Studie (nach Andruska et al.)5
Progressionsmuster nach PACIFIC-Regime
Strahlentherapeutisch interessant ist das Muster des Progresses im Verlauf der Beobachtung. Vor allem, weil der Einschluss in die Studie nach abgeschlossener Strahlenbehandlung erfolgte und keine Spezifizierung der Radiotherapie im Vorfeld erfolgte. Somit können auch die jeweilig beobachteten Rezidive im weiteren Verlauf nicht dezidiert als „In-field“- (innerhalb des ehemaligen Bestrahlungsfeldes) oder „Out-field-Rezidiv“ (außerhalb des ehemaligen Bestrahlungsfeldes) eingeordnet werden. Jedenfalls traten bereits, wie bei einer frühen Auswertung im Rahmen des Jahreskongresses der American Society for Radiation Oncology 2019 von Rimner A.8 präsentiert, unter D weniger Rezidive und diese später als im Placeboarm auf (45% vs. 65%). Vor allem extrathorakale Rezidive wurden seltener als einzelne Läsionen beobachtet (Tab. 1). Wobei zu bemerken ist, dass die einzelnen Subgruppen sehr klein waren.
Eine extrathorakale Beteiligung findet sich vor allem im Gehirn, aber auch Knochen-, Lymphknoten- und Lebermetastasen wurden beobachtet. Anhand des oligometastatischen Progressionsmusters kann somit die Schlussfolgerung gezogen werden, dass in der Folge lokal ablative Verfahren (Operation/Strahlentherapie) das Überleben weiter verlängern.
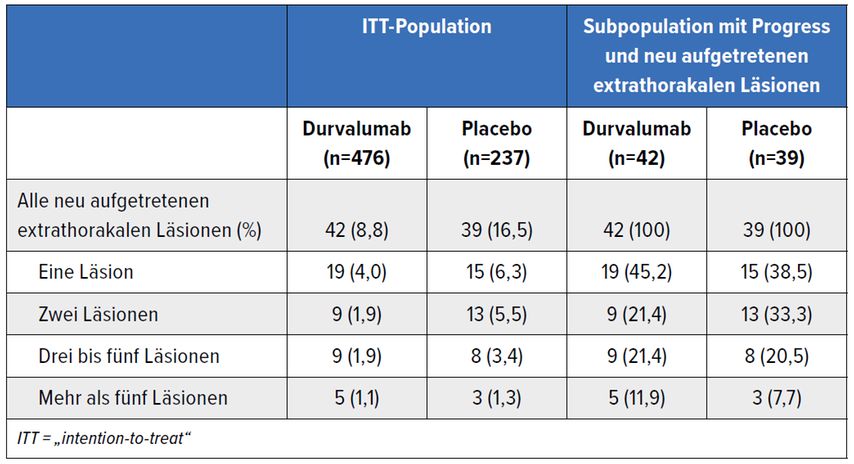
Tab. 1: Erster neu aufgetretener extrathorakaler Progress in der PACIFIC-Studie (nach Raben et al.)8
Strahlenbehandlung
Im Vergleich zur 3D-Bestrahlung verbessert die intensitätsmodulierte Bestrahlung (IMRT-VMAT) die Dosiskonformität und ermöglicht auch eine optimale Schonung von Risikostrukturen (Lunge, Rückenmark, Speiseröhre, Herz). In das Zielvolumen sind der Primärtumor und die befallenen Lymphknotenregionen zu integrieren (Abb. 1). Außerdem kann mit modernster Technik auch eine Dosiseskalation im Tumorareal erreicht werden.
Um die Toxizität der Behandlung zu minimieren, ist der nodalen Bestrahlung der involvierten Lymphknoten („involved field“) der Vorzug zu geben.9 Unsicherheiten, die durch Bewegungen (inklusive Atmung) entstehen, werden durch die Anwendung von 4D-CT (Information zur etwaigen Bewegung des Tumors in entsprechenden Atemphasen), Immobilisation von Patienten und Verwenden von geeigneten Sicherheitssäumen um das Tumorareal minimiert. Mit der bildgeführten Strahlenbehandlung (IGRT) wird das Zielvolumen optimal vor und während jeder einzelnen Bestrahlungssitzung erfasst. Mögliche Abweichungen gegenüber der Planungssituation werden berechnet und können durch ein Nachjustieren des Bestrahlungstisches unmittelbar vor der therapeutischen Bestrahlung korrigiert werden. Der technische Fortschritt in der Strahlentherapie erlaubt durch den Einsatz der Hochpräzisionstechnik die Verkleinerung der Bestrahlungsfelder, eine Dosiseskalation im Tumorzielgebiet und damit eine Reduktion von relevanten Nebenwirkungen. Mit steigender Compliance von Patientenseite verbessern sich die Chancen auf höhere Überlebensraten. Die Kombinationstherapie – Strahlentherapie mit Systemtherapie (Chemotherapie und Immuntherapie) – beeinflusst das Outcome relevant und erlaubt selbst im Falle eines eventuellen späteren Progresses Überlegungen zu einer ablativen kurativen Therapie.
Es ist wichtig, dass die Entscheidung, welche Therapieoption angewendet werden soll, im Tumorboard im Konsens getroffen wird und im Rahmen der interdisziplinären Diskussion keine Option per se ausgeschlossen wird. Im Sinne unserer Patienten ist im multimodalen Kontext sehr präzise multidisziplinär zu arbeiten – und zwar von der Diagnosestellung bis zur Therapie.
Literatur:
1 Auperin A et al.: Meta-analysis of concomitant versus sequential radiochemotherapy in locally advanced non-small-cell lung cancer. J Clin Oncol 2010; 28: 2181-90 2 Le Pechoux C: An international randomized trial, comparing post-operative conformal radiotherapy (PORT) to no PORT, in patients with completely resected non-small cell lung cancer (NSCLC) and mediastinal N2 involvement: Primary end-point analysis of LungART (IFCT-0503, UK NCRI, SAKK) NCT00410683. EMSO-Kongress 2020; Abstr. #LBA3_PR 3 Antonia SJ et al.: Overall survival with durvalumab after chemoradiotherapy in stage III NSCLC. N Engl J Med 2018; 379(24): 2342-50 4 Dovedi SJ et al.: Acquired resistance to fractionated radiotherapy can be overcome by concurrent PD-L1 blockade. Cancer Res 2014; 74: 5458-68 5 Andruska N et al.: Stereotactic radiation for lung cancer: a practical approach to challenging scenarios. J Thoracic Oncology 2021; online ahead of print. https://doi.org/10.1016/j.jtho.2021.04.002 6 National Comprehensive Cancer Network: NCCN Guidelines Non-Small Cell Lung Cancer. Version 4.2019. Online unter: https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf 7 Onkopedia-Leitlinie: NSCLC 2018 8 Raben D et al.: Patterns of disease progression with durvalumab in stage III non-small cell lung cancer (PACIFIC). ASTRO-Kongress 2019; Abstr. #LBA6 9 Rosenzweig KE et al.: Involved-field radiation therapy for inoperable non small-cell lung cancer. J Clin Oncol 2007; 25: 5557-61
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...


