Neues zu myeloproliferativen Neoplasien
Autor:
Prim. Univ.-Prof. Dr. Klaus Geissler
Vorstand der 5. Medizinischen Abteilung mit Onkologie
Krankenhaus Hietzing der Stadt Wien
Professor für Hämatoonkologie
Sigmund Freud PrivatUniversität
E-Mail: klaus.geissler@wienkav.at
Beim diesjährigen Treffen der European Hematology Association (EHA) wurden vor allem zur Myelofibrose (MF) frühe klinische Studien präsentiert, in denen neue vielversprechende Therapiekonzepte untersucht wurden. Die Beeinflussung der Hepzidinsynthese durch Momelotinib, die Apoptoseförderung durch Navitoclax sowie die BET-Hemmung durch Pelabresib werden unsere therapeutischen Möglichkeiten bei dieser Erkrankung in Zukunft deutlich erweitern. Am Beispiel der Polycythaemia vera (PV) konnte das krankheitsmodifizierende Potenzial von pegyliertem Interferon in dieser Indikation weiter erhärtet werden. Bei der chronischen myeloischen Leukämie (CML) wurde die neuartige und überlegene Wirkungsweise von Asciminib bei Patienten mit vorbehandelter CML im Rahmen einer Phase-III-Studie gezeigt.
Keypoints
-
Momelotinib ist ein neuer JAK1/2-Inhibitor, der zusätzlich auch ACVR1/ALK2 beeinflusst und so die Hepzidinsynthese in Hepatozyten inhibiert.
-
Die therapeutische Wirksamkeit einer Apoptoseförderung durch den BCL2-Inhibitor Navitoclax wurde bei Patienten mit Myelofibrose erstmals gezeigt.
-
Pelabresib hemmt das BET(„bromodomain und extraterminal domain“)-Protein und dadurch die Expression bestimmter Gene, die mit einer aberranten Megakaryopoese und einer progressiven KM-Fibrose bei MF assoziiert sind.
-
Ropeginterferon senkt bei 20,7% der Patienten mit PV nach 6 Jahren die JAK2-Allel-Burden auf <1%.
-
Der neue BCR/ABL-Inhibitor Asciminib zeigt in einer Phase-III-Studie überlegene Wirkung bei vorbehandelten CML-Patienten.
Myelofibrose
Symptomreduktion mit Momelotinib
Momelotinib ist ein neuer JAK1/2-Inhibitor, der zusätzlich auch ACVR1/ALK2 beeinflusst und so die Synthese von Hepzidin in Hepatozyten hemmt. Hepzidin gilt als Hauptmediator der Anämie der chronischen Erkrankung.
S. Verstovsek präsentierte die Ergebnisse einer Phase-III-Studie, in der Momelotinib gegenüber Danazol bei symptomatischen Patienten mit anämischer Myelofibrose (MF) untersucht wurde, die zuvor mit einem JAK-Inhibitor behandelt wurden. 94/130 Patienten im Momelotinib-Arm und 38/65 Patienten im Danazol-Arm beendeten eine 24-wöchige Behandlung in dieser randomisierten Studie. Alle Patienten waren zuvor mit Ruxolitinib behandelt worden, 5% der Patienten hatten außerdem Fedratinib erhalten.
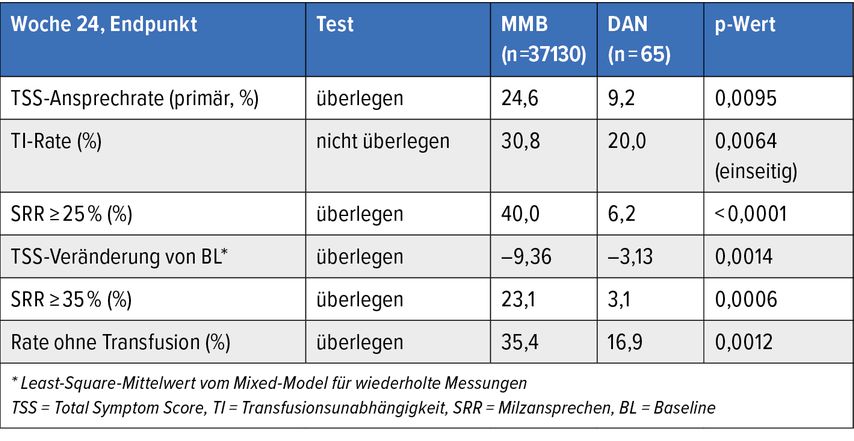
Die Endpunkte der Studie waren Symptomatik ermittelt durch den TSS(Total Symptom Score), Milzansprechen (SRR >25 und >35%) und Transfusionsunabhängigkeit (TI). Die Ergebnisse dieser Studie sind in Tabelle 1 dargestellt. Man erkennt, dass der Anteil an Patienten mit verbesserter Symptomatik (>50% Verbesserung gegenüber dem Ausgangswert) im Momelotinib-Arm signifikant höher war als im Danazol-Arm, ebenso wie der Anteil von Patienten mit mäßiger und deutlicher Verkleinerung der Milz. Bemerkenswert ist die Tatsache, dass etwa ein Drittel der Patienten im Momelotinib-Arm unter dieser Therapie keine Blutkonserven mehr benötigte, die Anzahl lag also doppelt so hoch wie im Danazol-Arm.
Tab. 1: Ergebnisse der Phase-III-Studie von S. Verstovsek, in der Momelotinib (MMB) gegenüber Danazol (DAN) bei symptomatischen Patienten mit anämischer Myelofibrose (MF) untersucht wurde, die zuvor mit einem JAK-Inhibitor behandelt wurden
Zusammenfassend kann also festgestellt werden, dass Momelotinib bei diesem vorbehandelten Patientenkollektiv sowohl die Splenomegalie als auch die Symptome verbesserte. Die Tatsache, dass durch Momelotinib auch die Anämie vermindert werden konnte, zeigt, dass diese Substanz imstande ist, bei Patienten mit MF alle drei Hauptsymptome – Splenomegalie, konstitutive Beschwerden und Anämie – günstig zu beeinflussen.
JAK2-Inhibition gut verträglich
Die hohe therapeutische Wirksamkeit einer Apoptoseförderung durch BCL2-Inhibition hat die Standardtherapie von Patienten mit chronischer lymphatischer Leukämie, aber auch jener mit akuter myeloischer Leukämie bereits grundlegend verändert.
F. Passamonti hat dieses neue Therapiekonzept jetzt im Rahmen einer offenen Phase-II-Studie bei Patienten mit MF untersucht und die präliminären Sicherheits- und Wirksamkeitsdaten der Kombination von Navitoclax und Ruxolitinib bei JAK-Inibitor-naiven Patienten präsentiert. Die mediane Dauer der Verabreichung von Navitoclax und Ruxolitinib betrug bei den 32 bisher eingeschlossenen Patienten 24 Wochen. 88% der Patienten erhielten Navitoclax in einer Dosis von 200mg und 12% in einer Dosis von 100mg. Die häufigsten Nebenwirkungen lagen im Bereich der hämatologischen Toxizität, wie Anämie, Thrombopenie und Neutropenie.
Ein Milzansprechen zeigte sich bei etwas mehr als der Hälfte der Patienten (52%), die mediane Zeit bis zum Ansprechen betrug zwölf Wochen. Insgesamt war die Kombination von Navitoclax und Ruxolitinib gut verträglich und zeigte eine deutliche Verminderung von Milzvolumen, Anämie und Knochenmarkfibrose (KM-Fibrose).
JAK2-Inhibition plus BET-Inhibition
Präliminäre Daten eines anderen Therapiekonzepts wurden von J. Mascarenhas bei Patienten mit MF präsentiert, die JAK-Inhibitor-naiv waren oder ein suboptimales Ansprechen auf Ruxolitinib zeigten. In dieser Studie wurde zusätzlich zu Ruxolitinib der BET-Inhibitor Pelabresib verabreicht. Rationale für diese Studie ist die Tatsache, dass eine progressive KM-Fibrose Ergebnis einer aberranten Megakaryopoese und Expression proinflammatorischer Zytokine ist. Diese beiden Prozesse führen über durch die Bromodomäne und extraterminale Domäne (BET) proteinmediierte Expression bestimmter Gene (NF-kB, MYC, BCL-2) zu Myeloproliferation und Zytopenie.
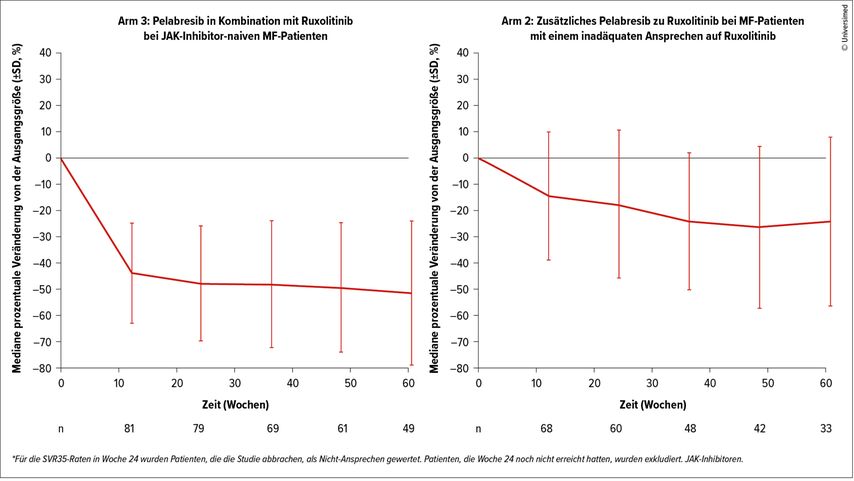
Die Daten waren Teil der laufenden offenen Phase-II-Studie MANIFEST, in der in Arm 2 bei mit Ruxolitinib behandelten MF-Patienten mit inadäquatem Ansprechen zusätzlich Pelabresib verabreicht wurde. Im Arm 3 wurde JAK2-Inhibitor-naiven Patienten Pelabresib in Kombination mit Ruxolitinib gegeben. Ein Milzansprechen nach 24 Wochen wurde bei 68% der Patienten im Arm 3 und bei 20% der Patienten im Arm 2 beobachtet (Abb. 1).
Abb. 1: Änderung der Milzgröße (SD) in den Armen 2 und 3 der MANIFEST-Studie. Primärer Endpunkt: Reduzierung der Milzgröße um ≥35% von der Ausgangsgröße (SVR35)
Eine Verbesserung der KM-Fibrose um mindestens ein Grad zeigte sich bei 31% der Patienten im Arm3 und 25% in Arm2. Die häufigsten Nebenwirkungen waren hämatologischer Natur, insgesamt war die kombinierte Behandlung Pelabresib+Ruxolitinib sowohl bei Patienten mit als auch solchen ohne Ruxolitinib-Vorbehandlung erfolgreich.
Polycythaemia vera:Erfolg für Ropeginterferonalfa-2b
Neben der Beeinflussung der unmittelbaren Symptomatik bei myeloproliferativen Neoplasien (MPN) ist es auch wichtig, die Spätkomplikationen dieser Erkrankungen im Auge zu behalten. Bisherige Erfahrungen zeigen, dass unter den bei Ph-negativen MPN eingesetzten Medikamenten Interferon (IFN) das Potenzial hat, eine krankheitsmodifizierende Wirkung zu entfalten und damit später auftretende krankheitsassoziierte Probleme zu verringern. Bei Patienten mit PV gehören zu diesen Problemen die Progression in eine Myelofibrose und eine akute Leukämie.
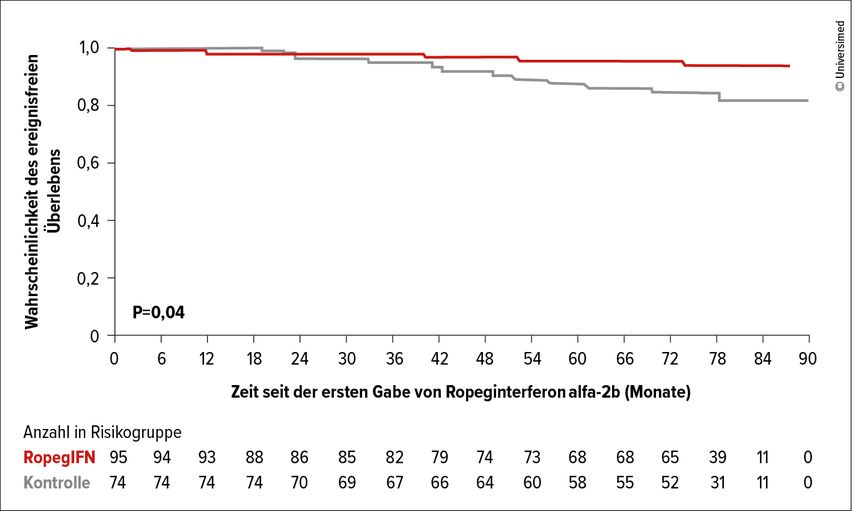
Die Langzeitwirkung von Ropeginterferon alfa-2b wurde bereits in der PROUD-PV/CONTINUATION-PV-Studie gezeigt. H. Gisslinger präsentierte im Rahmen des diesjährigen EHA(European Hematology Association)-Treffens die finalen Resultate dieser Studie. Die komplette Analyse umfasste dabei 95 Patienten im Ropeginterferon-alfa-2b-Arm und 74 Patienten im Kontrollarm.
Bei 81% der mit IFN behandelten Patienten und bei 60% der Patienten im Kontrollarm konnte auf Aderlässe verzichtet werden, um im sechsten Behandlungsjahr den Hämatokrit <45% zu halten. Ein Absinken der JAK2-Allel-Burden auf <1% und dadurch ein möglicherweise verringertes Risiko für die Progression in eine Post-PV-MF wurde nach sechs Jahren bei 20,7% der IFN-Patienten und bei 1,4% der Kontrollpatienten erreicht. Das ereignisfreie Überleben in beiden Armen ist in Abbildung 2 dargestellt.
Mit diesen Ergebnissen erfüllt Ropeginterferon die wichtisten Anforderungen, die an die Behandlung von Patienten mit PV gestellt werden. Dazu gehören verbesserte Lebensqualität, Verbesserung der Symptomatik, Verminderung der Notwendigkeit einer Aderlasstherapie, das Potenzial, die Entwicklung einer MF zu verhindern, und die Verlängerung des ereignisfreien Überlebens.
Chronische myeloische Leukämie:Asciminib besser als Bosutinib?
Asciminib ist der erste BCR/ABL-Inhibitor, der spezifisch über die ABL-Myris- toyl-Tasche wirkt und damit ein neues molekulares Konzept für eine Hemmung der BCR/ABL-Tyrosinkinase repräsentiert. Anders als bisher eingesetzte Tyrosinkinaseinhibitoren greift Asciminib nicht an der ATP-Bindungsstelle des BCR-ABL1-Fusionsproteins an. Dadurch wird die Wirkung von Asciminib auch nicht durch bekannte Mutationen der ATP-Bindungsstelle beeinflusst.
In den primären Analysen zeigte Asciminib eine bessere Wirksamkeit und bessere Verträglichkeit gegenüber Bosutinib bei Patienten mit CML in chronischer Phase, die bereits mindestens zwei TKI-Inhibitoren erhalten haben. Die Auswertung nach 24 Wochen zeigte einen„major molecular Response“ (MMR) mit 25,5% bei Asciminib gegenüber 13,2% bei Bosutinib. Die von D. Rea präsentierten Daten zeigten nun die Ergebnisse dieser Studie nach 96 Wochen.
Insgesamt wurden 157 Patienten in den Asciminib-Arm und 76 Patienten in den Bosutinib-Arm randomisiert. Die MMR-Rate bei Woche 96 betrug 37,6% im Asciminib-Arm und 15,8% im Bosutinib-Arm. Zu diesem Zeitpunkt hatten 45,1% der Patienten mit Asciminib und 19,4% jener mit Bosutinib eine BCR/ABLIS-Expression <1%, mit einer Wahrscheinlichkeit von 95%, die MMR-Rate bzw. die BCR/ABLIS-Expression für mindestens 72 Wochen aufrecht zu erhalten. Dies galt für 96,7% und 94,6% unter Asciminib und 92,2% und 95,0% unter Bosutinib. Die mediane Zeit bis zum Wirkverlust betrug 24 Monate im Asciminib-Arm und sechs Monate im Bosutinib-Arm.
Der Anteil von Nebenwirkungen, die zum Behandlungsabbruch führten, war im Asciminib-Arm geringer als im Bosutinib-Arm (7,7% vs. 26,3%). Diese Daten bestätigen die hohe Wirksamkeit und gute Verträglichkeit dieses neuen Therapiekonzeptes bei vorbehandelten CML-Patienten in chronischer Phase.
Literatur:
beim Verfasser
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...