Neues aus Forschung und Klinik zu ZNS-Metastasen
Bericht:
Dr. Ine Schmale
Für Melanompatienten mit Hirnmetastasen stehen mehrere effektive lokale und systemische Therapieoptionen zur Verfügung. Beim 31. Deutschen Krebskongress gab Prof. Dr. Friedegund Meier, Universitätsklinikum Carl Gustav Carus, Dresden, ein Update zur Systemtherapie von Hirnmetastasen.
Wie auch in der Behandlung der extrakraniellen Erkrankung stehen für Melanompatienten mit Hirnmetastasen an systemischen Strategien die BRAF/MEK-gerichteten Substanzen oder Checkpoint-Antikörper im Vordergrund. Die Therapie von ZNS-Metastasen sollte dabei immer interdisziplinär geplant und durchgeführt werden.
Systemische Therapie bei asymptomatischer Erkrankung
In der Phase-II-Studie COMBI-MB wurde mit der BRAF/MEK-Inhibition durch Dabrafenib plus Trametinib ein intrakranielles Ansprechen bei 58% und eine klinische Kontrollrate von 78% bei Patienten mit asymptomatischen Hirnmetastasen erreicht. Die intrakraniellen Remissionen dauerten allerdings nur 6,5 Monate an. Das extrakranielle Ansprechen betrug hingegen im Median 10,2 Monate.1
In der australischen Phase-II-Studie ABC erhielten Patienten die Immunkombination Ipilimumab plus Nivolumab oder eine Nivolumab-Monotherapie. Georgina Long präsentierte beim diesjährigen Jahreskongress der American Society of Clinical Oncology (ASCO) ein Update mit einer Nachbeobachtungszeit von 52,8 Monaten.2 Bei asymptomatischen Hirnmetastasen zeigte sich ein intrakranielles Ansprechen bei 51% der Patienten unter Behandlung mit Nivolumab plus Ipilimumab und bei 20% unter Nivolumab-Monotherapie. Das extrakranielle Ansprechen betrug im Vergleich 57% bzw. 29%. 5 Jahre progressionsfreies Überleben (PFS) erreichten unter Ipilimumab plus Nivolumab intrakraniell 46% und extrakraniell 50% der Patienten. Mit der Nivolumab-Monotherapie wurden 5-Jahres-PFS-Raten von 21% bzw. 15% gesehen. Nach 5 Jahren lag die Gesamtüberlebensrate (OS) bei 51% unter der Kombinationstherapie und 34% unter der Monotherapie. Wie zu erwarten, wurden unter der Kombination mit Ipilimumab allerdings auch häufiger therapieassoziierte Grad-3–4-Nebenwirkungen (54%) als unter alleiniger Nivolumab-Therapie (20%) gesehen.
Auch in der Phase-II-Studie CheckMate 204 wurden mit Nivolumab plus Ipilimumab hohe Raten des intrakraniellen Ansprechens von 54,4% (komplette Remissionen: 28,7%) erreicht.3 Das Ansprechen war bei nahezu 90% dieser Patienten lang anhaltend. Nach 6 Monaten lebten 62,6% der Patienten ohne intrakraniellen und 72,1% der Patienten ohne extrakraniellen Progress. Das Gesamtüberleben betrug nach 12 Monaten 82,4% und nach 18 Monaten 75,2%.
Systemische Therapie bei symptomatischen Hirnmetastasen
Patienten mit symptomatischen Hirnmetastasen haben trotz der neuen Therapieoptionen keine gute Prognose. In der COMBI-MB-Studie wurden mit Dabrafenib plus Trametinib hohe Ansprechraten (59%) erzielt, die Dauer des Ansprechens betrug aber auch bei diesen Patienten nur median 4,5 Monate (95% CI: 2,8–5,9).1 Mit der Kombination Ipilimumab plus Nivolumab wurden in der ABC-Studie (6%) und in der CheckMate 204-Studie nur niedrige Raten des intrakraniellen Ansprechens erreicht (22,2%).2,3 Diese waren aber in 75% der Fälle lang anhaltend.3 Nach 6 Monaten betrug die Rate des intrakraniellen PFS 18,9% und die OS-Rate 65,8%.
Kombinierte Strahlen- und systemische Therapie
Die Behandlung von Melanom-Hirnmetastasen sollte grundsätzlich in interdisziplinärer Zusammenarbeit mit Neuroradiologen, Neurochirurgen, Radioonkologen, Neuroonkologen und Onkologen erfolgen. In einem europäischen Konsensuspapier wird die klare Empfehlung gegeben, die Therapie von ZNS-Metastasen in interdisziplinären Tumorkonferenzen zu planen und durchzuführen.4 Relevante Kriterien für die Therapieentscheidung sind der Allgemeinzustand des Patienten, die neurologische Symptomatik, das Ausmaß der Hirnmetastasierung, das Ausmaß der extrazerebralen Metastasierung, LDH und S100, die Dynamik der Tumorprogression, die neuro- und/oder radiochirurgische Therapierbarkeit, der BRAF-Mutationsstatus und die Verfügbarkeit von Studien. Besonders vielversprechend erscheint die Systemtherapie plus eine stereotaktische Strahlentherapie (SRS). Es ist bekannt, dass die Strahlentherapie DNA-Schäden, Autophagie und Nekrose induziert. Über verschiedene Signalwege wird die Antigenpräsentation auf dendritischen Zellen gefördert, was zu einer Aktivierung von zytotoxischen T-Zellen führt. Dies bildet die Rationale für die Kombination von SRS und systemischer Therapie.
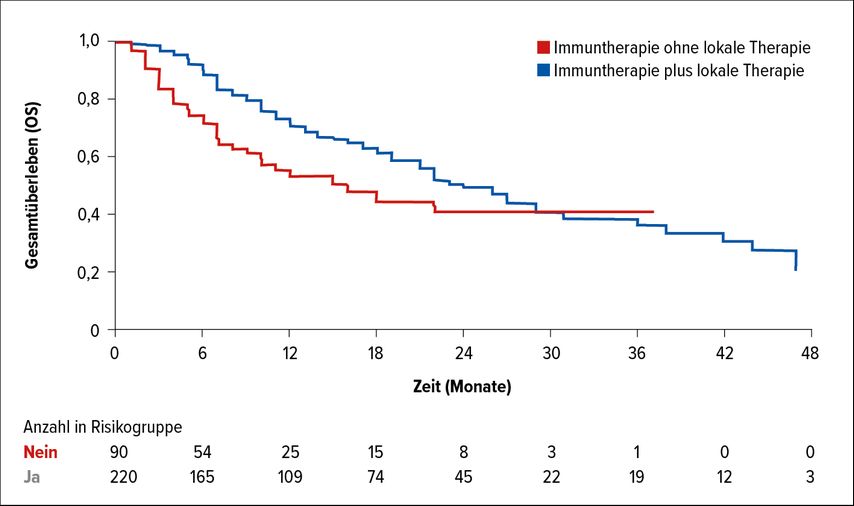
In retrospektiven Analysen wurde gezeigt, dass die Kombination von SRS mit einer systemischen Therapie zu einer Verlängerung des OS ohne erhöhte Toxizität führt.5–8 Besonders vielversprechend ist die Kombination von Nivolumab und Ipilimumab mit lokaler Strahlentherapie. In einer Studie mit 380 Patienten mit asymptomatischen und symptomatischen Hirnmetastasen wurden Hinweise auf eine Verlängerung des OS durch die Bestrahlung zusätzlich zur doppelten Immunblockade beobachtet (p=0,009) (Abb. 1).9 Im Median betrug das OS 24 (95% CI: 19,6–28,4) versus 16 Monate (95% CI: 7,6–24,4). Dieser Zusammenhang wurde in einem systematischen Review mit den Daten von 6384 Patienten bestätigt.10 Mit der kombinierten Therapie wurden weder Hauttoxizität noch ein deutlich erhöhte intrakranielle Blutungsrate noch Strahlennekrosen von klinischer Relevanz beobachtet. Die SRS in Kombination mit einer systemischen Therapie erscheine sicher, weswegen die Behandlung fortgesetzt werden könne, wenn eine SRS der Hirnmetastasen erwogen werde, bemerkte Meier. Die Strategie der kombinierten systemischen und lokalen Therapie wird in laufenden Studien prospektiv untersucht, beispielsweise in der ABC-X-Studie, in der asymptomatische Patienten mit Nivolumab, Ipilimumab und SRS oder einer alleinigen Immuntherapie behandelt werden.11
Abb. 1: Gesamtüberleben (OS) unter Immuntherapie mit oder ohne lokale Therapie (modifiziert nach Amaral T et al.)9
Gezielte plus immun-onkologische Therapie
Die Kombination von BRAF/MEK-Inhibitoren mit Immuncheckpoint-Blockade könnte das rasche Ansprechen und die hohen Ansprechraten von asymptomatischen und symptomatischen Hirnmetastasen unter der BRAF/MEK-gerichteten Therapie mit dem anhaltenden Ansprechen der Immuntherapie vereinen. Von einer Tripel-Kombination würde ein rasches, zuverlässiges und anhaltendes Ansprechen erwartet. In der Phase-II-Studie TRICOTEL wird diese Strategie mit Vemurafenib, Cobimetinib und Atezolizumab unter Einschluss von 120 Patienten untersucht.12 Die Rekrutierung der Studie wurde mittlerweile abgeschlossen und erste Ergebnisse werden demnächst erwartet.
Fazit für den klinischen Alltag
Für Patienten mit Hirnmetastasen erzielt die Anti-PD-1-Monotherapie eine geringere Wirksamkeit als die doppelte Immunblockade mit Nivolumab plus Ipilimumab und wird daher nicht angeraten. Die kombinierte Anti-CTLA4- und Anti-PD-1-Therapie mit Nivolumab plus Ipilimumab zeigt eine hohe Wirksamkeit bei asymptomatischen Hirnmetastasen und wird für die Erstlinientherapie empfohlen. Bei symptomatischer Hirnmetastasierung und/oder unter Kortikosteroidtherapie ist die Wirksamkeit von Nivolumab plus Ipilimumab niedriger. Für diese nicht kleine Patientengruppe bestehe definitiv Forschungsbedarf, konstatierte Meier.
Die Therapie mit BRAF/MEK-Inhibitoren induziert hohe intrakranielle Krankheitskontrollraten sowohl bei asymptomatischen als auch symptomatischen BRAFV600-mutierten Melanommetastasen. Die Ansprechdauer ist intrakraniell kürzer als extrakraniell bzw. bei Patienten mit Hirnmetastasen kürzer als bei Patienten ohne Hirnmetastasen. Darum sei bei asymptomatischen Hirnmetastasen in der Regel Nivolumab plus Ipilimumab zu bevorzugen.
Innerhalb der Kombinationsstrategien zeigen retrospektive Analysen einen Überlebensvorteil durch die stereotaktische Strahlentherapie mit BRAF/MEK- oder Immuncheckpoint-Inhibitoren. Das beste Ergebnis wurde mit SRS in Kombination mit Nivolumab plus Ipilimumab erzielt. Eine vielversprechende Strategie ist auch die Kombination von BRAF/MEK- und Immuncheckpoint-Inhibitoren. Für beide Kombinationsstrategien laufen prospektive Studien.
Quelle:
Vortrag „Systemtherapie von Hirnmetastasen – Studien und Real-World-Daten“, Prof. Dr. Friedegund Meier beim 31. Deutschen Hautkrebskongress, 9. Sept. 2021
Literatur:
1 Davies MA et al.: Dabrafenib plus trametinib in patients with BRAFV600-mutant melanoma brain metastases (COMBI-MB): A multicentre, multicohort, open-label, phase 2 trial. Lancet Oncol 2017; 18: 863-73 2 Long GV et al.: Five-year overall survival from the anti-PD1 brain collaboration (ABC Study): Randomized phase 2 study of nivolumab or nivolumab + ipilimumab in patients with melanoma brain metastases. ASCO 2021, Abstr. #9508 3 Tawbi HA et al.: Safety and efficacy of the combination of nivolumab plus ipilimumab in patients with melanoma and asysmptomatic or symptomatic brain metastases (CheckMate 204). Neuro Oncol 2021; noab094 (online ahead of print) 4 Gutzmer R et al.: Melanoma brain metastases – Interdisciplinary management recommendations 2020. Cancer Treat Rev 2020; 89: 102083 5 Lehrer EJ et al.: Integration of immuno-oncology with stereotactic radiosurgery in the management of brain metastases. JNeurooncol 2021; 151: 75-84 6 Gatterbauer B et al.: Toxicity and efficacy of Gamma Knife radiosurgery for brain metastases in melanoma patients treated with immunotherapy or targeted therapy – a retrospective cohort study. Cancer Med 2020; 9: 4026-36 7 Martins F et al.: The combination of stereotactic radiosurgery with immune checkpoint inhibition or targeted therapy in melanoma patients with brain metastases: A restrospective study. J Neurooncol 2020; 146: 181-93 8 Carron R et al.: Stereotactic radiosurgery combined with anti-PD1 for the management of melanoma brain metastases: A retrospective study of safety and efficacy. Eur J Cancer 2020; 135: 52-61 9 Amaral T et al.: Combined immunotherapy with nivolumab and ipilimumab with or without local therapy in patients with melanoma brain metastasis: A DeCOG study in 380 patients. J Immunother Cancer 2020; 8: e000333 10 Borius PY et al.: Safety of radiosurgery concurrent with systemic therapy (chemotherapy, targeted therapy, and/or immunotherapy) in brain metastases: A systemic review. Cancer Metastasis Rev 2021; 40: 341-54 11 Online unter: www.clinicaltrials.gov/ct2/show/NCT03340129 12 Online unter: www.clinicaltrials.gov/ct2/show/NCT03625141
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...