Neue Standards in der Behandlung urologischer Entitäten
Bericht:
Dr. Ine Schmale
Zu den großen Entitäten der urologischen Tumoren, Prostatakarzinom, Nierenzellkarzinom und Urothelkarzinom, gab es beim diesjährigen Genitourinary Cancers Symposium der American Society of Clinical Oncology (ASCO GU) neue Fortschritte zu vermelden. Insbesondere die zielgerichteten Therapien und Immuntherapien nahmen in vergleichenden Studien den Stellenwert neuer Standardtherapien ein. Im Folgenden einige der wichtigen Studienergebnisse.
Cabozantinib beim papillären Nierenzellkarzinom
Das papilläre Nierenzellkarzinom (pRCC) ist eine seltene Erkrankung, die etwa 15% der RCC-Fälle ausmacht. Sunitinib wurde bisher als Standard in der metastasierten Situation eingesetzt. Da das MET-Protoonkogen ein potenzieller Treiber der pRCC-Erkrankung ist, könnten MET-Inhibitoren die Prognose der Patienten verbessern, so die These der Phase-II-Studie SWOG 1500.1
Patienten mit metastasiertem pRCC und maximal einer vorangegangenen Therapie (ausgenommen waren Patienten mit vorangegangener Sunitinib-Therapie) erhielten randomisiert Sunitinib, Cabozantinib, Crizotinib oder Savolitinib. Primärer Endpunkt war das progressionsfreie Überleben (PFS).
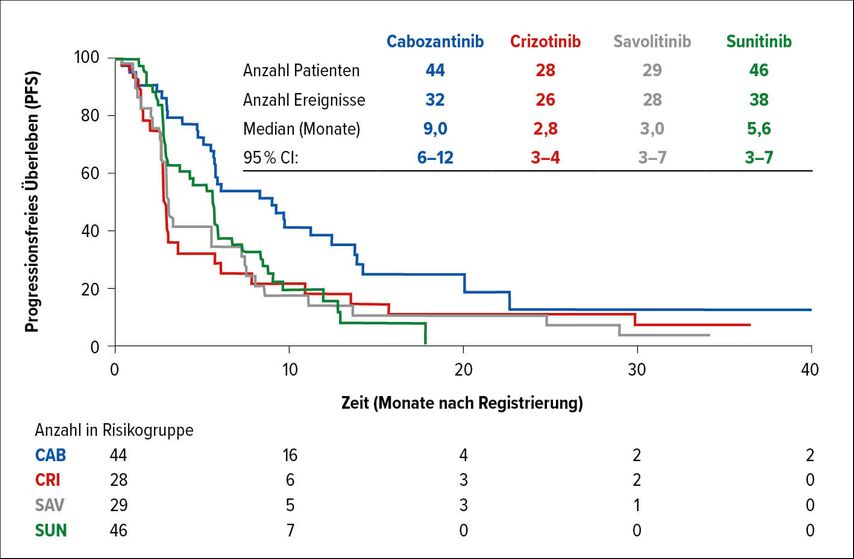
Die Rekrutierung in die Studie begann im April 2016. Die Studienarme mit Crizotinib und Savolitinib wurden mit 28 und 29 Patienten im Dezember 2018 aufgrund fehlenden Ansprechens geschlossen. Bis Dezember 2019 wurden 46 Patienten in den Sunitinib- und 44 Patienten in den Cabozantinib-Arm rekrutiert. Progressionsfrei lebten Patienten im Cabozantinib-Arm median 9,0 Monate vs. median 5,6 Monate unter Sunitinib (HR: 0,60; 95% CI: 0,37–0,97; p=0,019) (Abb. 1). Ein bestätigtes Ansprechen wurde bei 23% der Patienten unter Cabozantinib und 4% der mit Sunitinib behandelten Patienten gesehen (p=0,010). Cabozantinib sollte daher als neue Standard- und Referenztherapie bei Patienten mit papillärem Nierenzellkarzinom gelten, so das Fazit der Autoren.
Abb. 1: Progressionsfreies Überleben von Patienten mit papillärem RCC unter verschiedenen TKI (nach Pal et al.)1
Erstlinientherapie mit Lenvatinib plus Pembrolizumab beim RCC
In der dreiarmigen, randomisierten, offenen Phase-III-Studie CLEAR wurde die Kombination von Lenvatinib (20mg, qd) plus Pembrolizumab (200mg, q3w) oder Lenvatinib (18mg, qd) plus Everolimus (5mg, qd) vs. die Sunitinib-Monotherapie (50mg, d1-28, q6w) in der Erstlinie beim fortgeschrittenen Nierenzellkarzinom (aRCC) untersucht.2 Primärer Studienendpunkt war das progressionsfreie Überleben (PFS). 1069 nicht vorbehandelte Patienten mit klarzelligem aRCC und einem Karnofsky Performance Status ≥70 erhielten 1:1:1-randomisiert die Studienmedikation. Basierend auf den Ergebnissen zum Datenschnitt am 28. August 2020 wurden die finalen Ergebnisse für das PFS und eine Interimsanalyse bezüglich des Gesamtüberlebens (OS) präsentiert.
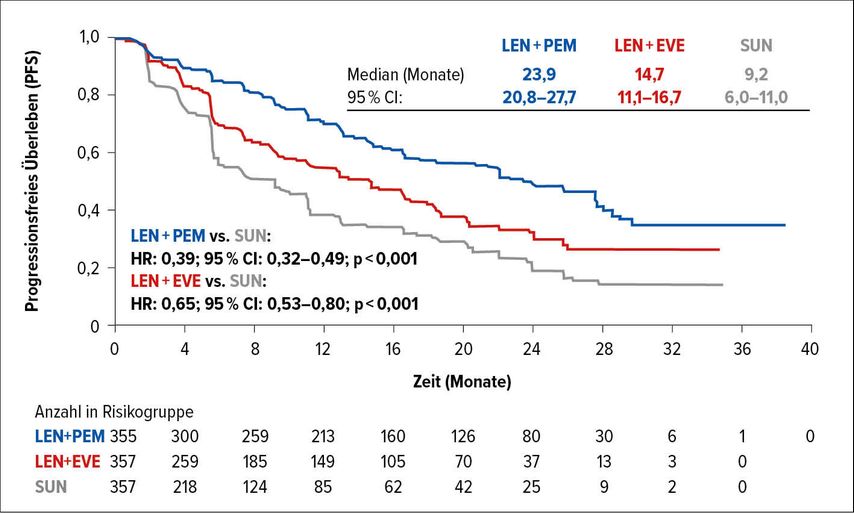
Mit einer Hazard-Ratio von 0,39 (95% CI: 0,32–0,49) für die Therapie mit Lenvatinib plus Pembrolizumab und 0,65 (95% CI: 0,53–0,80) für die Therapie mit Lenvatinib plus Everolimus wurde für beide Lenvatinib-Kombinationen ein signifikanter Vorteil gegenüber Sunitinib gezeigt (p jeweils <0,001) (Abb. 2). Auch für alle relevanten Subgruppen (Alter, Geschlecht, Region, PD-L1-Expression, Risikogruppe gemäß IMDC [International Metastatic Renal-Cell Carcinoma Database Consortium], Nephrektomie, sarkomatoide Komponenten) wurde das Risiko für einen Krankheitsprogress durch die Pembrolizumab-haltige Kombination um 57–72% (HR:0,28–0,43) und durch die Everolimus-haltige Kombination um 24–45% (HR:0,55–0,76) reduziert. Bezüglich des OS konnte nur für die Lenvatinib-Kombination mit Pembrolizumab ein signifikanter Vorteil gegenüber Sunitinib erreicht werden (HR:0,66; 95% CI: 0,49–0,88; p=0,005). Dieser Vorteil zeigte sich insbesondere für Patienten mit ungünstigem IMDC-Risiko (HR:0,30; 95% CI: 0,14–0,64).
Abb. 2: Progressionsfreies Überleben im Vergleich von Lenvatinib plus Pembrolizumab (LEN+PEM), Lenvatinib plus Everolimus (LEN+EVE) und Sunitinib-Monotherapie (SUN) (nach Motzer et al.)2
Ein Ansprechen wiesen 71,0% der Patienten unter der Pembrolizumab-Kombination vs. 53,5% unter der Everolimus-Kombination vs. 36,1% unter Sunitinib auf. Eine komplette Remission erreichten 16,1% vs. 9,8% vs. 4,2% der Patienten. Die Dauer des Ansprechens betrug im Median 25,8 Monate im Lenvatinib-Pembrolizumab-Arm, 16,6 Monate im Lenvatinib-Everolimus-Arm und 14,6 Monate im Kontrollarm. Mit einer medianen Therapiedauer von 17,0 vs. 11,0 vs. 7,8 Monate wurden häufiger Nebenwirkungen Grad ≥3 in den Kombinationsarmen beobachtet (71,6% vs. 73,0% vs. 58,8%). Zum Therapieabbruch von Lenvatinib kam es bei 18,5% bzw. 16,1% der Patienten, Pembrolizumab brachen 25,0% und Everolimus 19,2% der Patienten ab. Die komplette Studienmedikation brachen 9,7%, 13,5% und 10,0% der Patienten in den drei Studienarmen ab. Die Autoren schlussfolgerten, dass Lenvatinib plus Pembrolizumab ein möglicher neuer Standard in der Erstlinientherapie des fortgeschrittenen klarzelligen RCC sein kann.
Tivozanib nach Axitinib in späten RCC-Therapielinien
Tivozanib ist ein hochselektiver VEGFR- („vascular endothelial growth factor receptor“)-Tyrosinkinase-Inhibitor (TKI), der in der randomisierten, offenen Phase-III-Studie TIVO-3 bei 350 Patienten mit ≥2 Vortherapien gegen Sorafenib geprüft wurde. Der primäre Endpunkt, eine signifikante Verlängerung des PFS, wurde erreicht: Die Patienten lebten median 5,6 vs. 3,9 Monate ohne Krankheitsprogress (HR:0,73; 95% CI: 0,56–0,94; p=0,0165). Die PFS-Rate betrug nach einem Jahr 28% vs. 11% und nach zwei Jahren 18% vs. 5%.
Beim ASCO GU wurde anhand der Ergebnisse für insgesamt 159 Patienten mit nur zwei Vortherapien gezeigt, dass Tivozanib insbesondere in früheren Therapielinien von Vorteil ist.3 Das mediane PFS betrug für diese Patienten 5,5 vs. 3,7 Monate (HR:0,57; 95% CI 0,39–0,83; p=0,003). Ein Ansprechen zeigten 15,2% vs. 7,5% der Patienten. Ebenfalls ausgewertet wurden die Daten von 172 Patienten in Bezug auf eine vorangegangene Therapie mit dem TKI Axitinib, der vermehrt als Teil der Erstlinientherapie eingesetzt wird. Bezüglich des PFS wurde unabhängig von einer vorangegangenen Axitinib-Therapie für Patienten in der dritten oder vierten Therapielinie ein Vorteil für Tivozanib gegenüber Sorafenib bestätigt (medianes PFS: 5,5 vs. 3,7 Monate; HR:0,68). Die Verträglichkeit der Tivozanib-Therapie wurde durch die vorangegangene Axitinib-Therapie nicht beeinflusst.
Docetaxel plus Nivolumab in der Behandlung des mCRPC
Für die Behandlung des metastasierten kastrationsresistenten Prostatakarzinoms (mCRPC) wurden beim ASCO GU die Ergebnisse der finalen Analyse für den Arm B der CheckMate-9KD-Studie präsentiert.4 Nicht mit einer Chemotherapie vorbehandelte mCRPC-Patienten erhielten in der mehrarmigen, offenen Phase-II-Studie u.a. Nivolumab in Kombination mit Rucaparib, Docetaxel (Arm B) oder Enzalutamid. Insgesamt wurden im Arm B der CheckMate- 9KD-Studie 84 Patienten mit 10 Zyklen Nivolumab (360mg, q3w) plus Docetaxel (75mg/m2, q3w) und Prednison (5mg, bid), gefolgt von einer Nivolumab-Monotherapie (480mg, q4w) bis maximal 2 Jahre, behandelt.
Mit einer medianen Nachbeobachtungszeit von 15,2 Monaten wurde ein objektives Ansprechen bei 40% der Patienten gesehen sowie eine bestätigte PSA-Ansprechrate von 46,9%. Die mediane Zeit bis zu einem objektiven Ansprechen betrug 2,0 Monate und die mediane Dauer des Ansprechens 7,0 Monate. Bei Patienten mit PSA-Ansprechen betrug die mediane Zeit bis zum PSA-Progress 8,7 Monate. Ein Antitumoreffekt wurde bei Patienten, die bereits eine vorangegangene AR-gerichtete Therapie (NAT) mit Abirateron, Enzalutamid oder Apalutamid erhalten hatten, sowie bei NAT-unbehandelten Patienten beobachtet. Das mediane bildmorphologische PFS (rPFS) betrug 9,0 Monate für alle, 12,0 Monate für NAT-unbehandelte und 8,5 Monate für NAT-vorbehandelte Patienten mit 12-Monats-rPFS-Raten von 36%, 51% und 26%. Die OS-Raten betrugen in den Patientenkohorten nach 12 Monaten 69–70%. Der Median bezüglich des OS war für NAT-unbehandelte Patienten noch nicht erreicht und betrug 16,2 Monate für NAT-vorbehandelte Patienten sowie 18,2 Monate in der ITT-Population von Arm B. Therapieassoziierte Nebenwirkungen führten bei 29,8% der Patienten zum Abbruch einer oder beider Studienmedikationen.
Prostatakarzinom nach Docetaxel-Versagen mit 177Lu-PSMA-617 behandeln
Die PSMA(prostataspezifisches Membranantigen)-gerichtete Therapie mit radioaktivem Nuklid ist gemäß nicht randomisierten Studien eine mögliche Option beim mCRPC. In einer beim ASCO GU präsentierten randomisierten Studie mit 200 Studienteilnehmern wurde 177Lu-PSMA-617 mit Cabazitaxel verglichen.5
Ein PSA-Ansprechen ≥50%, der primäre Studienendpunkt, wurde bei 66% der Patienten unter 177Lu-PSMA-617 vs. 37% Patienten unter Cabazitaxel beobachtet. Die mediane Nachbeobachtungszeit gemäß der beim ASCO GU präsentierten Auswertung betrug 18,4 Monate. Das mediane PFS war in beiden Therapiearmen gleich (5,1 Monate), nach 12 Monaten waren aber 19% im 177Lu-PSMA-617- vs. 3% der Patienten im Cabazitaxel-Arm ohne Progress (HR:0,63; 95% CI: 0,46–0,86; p=0,0028). Ein objektives Ansprechen nach RECIST 1.1 (Response Evaluation Criteria In Solid Tumors) zeigten 49% vs. 24% der Patienten.
Es wurden unter 177Lu-PSMA-617 häufiger Nebenwirkungen von Grad 1–2 (54% vs. 40%), aber weniger häufig Nebenwirkungen von Grad 3–4 (33% vs. 54%) beobachtet. In einer Erhebung der Lebensqualität mittels des European Organization for Research and Treatment of Cancer Core Quality of Life Questionnaire (EORTC QLQ-C30) wurden nahezu alle Bereiche von den Patienten numerisch oder signifikant zugunsten der Therapie mit 177Lu-PSMA-617 beurteilt. Nach 6 Monaten gaben 29% vs. 13% und nach 12 Monaten 12% vs. 1% der Patienten an, keine Verschlechterung der Lebensqualität zu bemerken. Diese Ergebnisse implizieren, dass 177Lu-PSMA-617 eine neue effektive Wirkstoffklasse für die Behandlung von Patienten mit mCRPC repräsentiert, so das Fazit der Autoren.
Adjuvante Nivolumab-Therapie beim Urothelkarzinom
Die radikale Resektion ist der Therapiestandard für Patienten mit muskelinvasivem Urothelkarzinom (MIUC). Eine adjuvante Therapie wurde bisher nicht regelhaft empfohlen. In der randomisierten, doppelblinden Phase-III-Studie CheckMate 274 erhielten nun insgesamt 699 Hochrisikopatienten nach radikaler Resektion eine adjuvante Therapie mit Nivolumab oder Placebo. Primärer Endpunkt war das krankheitsfreie Überleben (DFS). Beim ASCO GU wurden die ersten Ergebnisse der Studie veröffentlicht.6
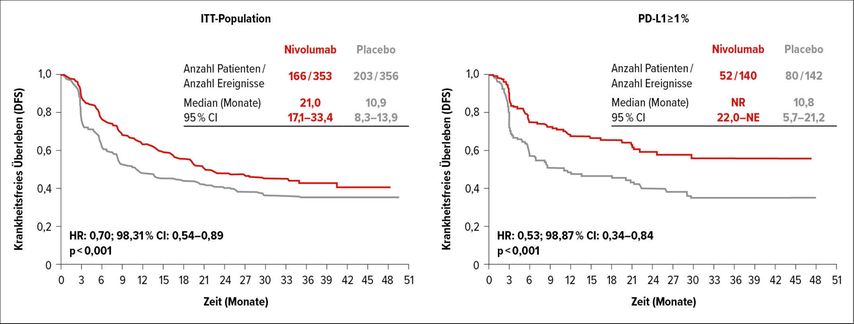
Das DFS der ITT-Population lag im Median bei 21,0 vs. 10,9 Monate, mit einer Risikoreduktion für einen Krankheitsrückfall um 30% (HR:0,70; 98,31% CI: 0,54–0,89; p<0,001). Bei einer PD-L1-Expression ≥1% war für Patienten im Nivolumab-Arm der Median noch nicht erreicht, während das mediane DFS im Placeboarm bei 10,8 Monaten lag. In dieser Subgruppe wurde das Risiko für einen Rückfall durch Nivolumab um 47% reduziert (HR:0,53; 98, 87% CI: 0,34–0,84; p<0,001) (Abb. 3).
Abb. 3: Krankheitsfreies Überleben von Patienten mit Urothelkarzinom unter adjuvanter Gabe von Nivolumab vs. Placebo in der ITT-Population und bei Patienten mit PD-L1-Expression ≥1% (nach Bajorin et al.)6
Therapieassoziierte Nebenwirkungen Grad ≥3 wurden für 17,0% der Patienten unter Nivolumab vs. 7,2% unter Placebo berichtet. Zu einem Abbruch der Therapie führten 12,8% vs. 2,0% der Nebenwirkungen (alle Grade). Die Lebensqualität laut EORTC QLQ-C30-Erhebung war in beiden Studienarmen vergleichbar.
Diese Ergebnisse stützen die Nivolumab-Monotherapie als neuen Standard für die adjuvante Therapie von Patienten mit Hochrisiko-MIUC nach radikaler Resektion, unabhängig vom PD-L1-Status und vorangegangener neoadjuvanter Chemotherapie.
Enfortumab Vedotin effektiv beim vorbehandelten Urothelkarzinom
Ein weiterer Fortschritt in der Behandlung des lokal fortgeschrittenen und metastasierten Urothelkarzinoms wurde mit dem Antikörper-Wirkstoff-Konjugat Enfortumab Vedotin in der Phase-III-Studie EV-301 erzielt.7 Enfortumab Vedotin ist eine gegen Nectin-4, welches beim Urothelkarzinom überexprimiert wird, gerichtete Therapie. Die EV-301-Studie wurde konzipiert, um eine Überlegenheit von Enfortumab Vedotin gegenüber einer Chemotherapie bei Patienten zu zeigen, die bereits mit einer Platin-basierten Chemotherapie und einem PD-(L)1-Checkpoint-Inhibitor behandelt wurden. In der Studie erhielten insgesamt 608 Patienten Enfortumab Vedotin oder eine vor der Randomisierung gewählte Chemotherapie mit Docetaxel, Paclitaxel oder Vinflunin. Als primärer Studienendpunkt wurde das OS gewählt.
Die Patienten erhielten die Studienmedikation über eine mediane Dauer von 5,0 vs. 3,5 Monate. Mit einer medianen Nachbeobachtungszeit von 11,1 Monaten konnte ein Vorteil bezüglich des OS für Enfortumab Vedotin bestätigt werden (HR:0,70; 95% CI: 0,56–0,89; p=0,00142). Im Median überlebten die Patienten 12,88 vs. 8,97 Monate. Das PFS betrug median 5,55 vs. 3,71 Monate mit einer Reduktion des Risikos für einen Progress oder Tod um 38% (HR:0,62; 95% CI: 0,51–0,75; p<0,0001). Es sprachen 40,6% vs. 17,95% der Patienten auf die Studienmedikation an, mit Komplettremissionen bei 4,9% der Patienten im Enfortumab- Vedotin-Arm vs. 2,7% im Chemotherapie-Arm. Die Krankheitskontrollrate betrug 71,9% vs. 53,4%. Die Therapie mit Enfortumab Vedotin wurde gut toleriert und stellt somit eine vielversprechende Option für vorbehandelte Patienten mit fortgeschrittenem Urothelkarzinom dar.
Quelle:
Genitourinary Cancers Symposium (ASCO GU), 11.–13. Februar 2021, virtuell
Literatur:
1 Pal SK et al.: Sunitinib vs. cabozantinib, crizotinib or savolitinib in metastatic papillary renal cell carcinoma (pRCC): Results from the randomized phase II SWOG 1500 study. ASCO GU 2021; Abstr. #270 2 Motzer R et al.: Phase 3 trial of lenvatinib plus pembrolizumab or everolimus vs. sunitinib monotherapy as a first-line treatment for patients with advanced renal cell carcinoma (CLEAR study). ASCO GU 2021; Abstr. #269 3 Rini BI et al.: Tivozanib in patients with advanced renal cell carcinoma (aRCC) who have progressed after prior treatment with axitinib: Results from TIVO-3. ASCO GU 2021; Abstr. #278 4 Fizazi K et al.: CheckMate 9KD arm B final analysis: Efficacy and safety of nivolumab plus docetaxel for chemotherapy-naive metastatic castration-resistant prostate cancer. ASCO GU 2021; Abstr. #12 5 Hofman M et al.: 177Lu-PSMA-617 (LuPSMA) vs. cabazitaxel in metastatic castration resistant prostate cancer progressing after docetaxel: Updated results including progression free survival and patient-reported outcomes. ASCO GU 2021; Abstr. #6 6 Bajorin DF et al.: First results from the phase 3 CheckMate 274 trial of adjuvant nivolumab vs. placebo in patients who underwent radical surgery for high-risk muscle-invasive urothelial carcinoma. ASCO GU 2021; Abstr. #391 7 Powles T et al.: Primary results of EV-301: a phase 3 trial of enfortumab vedotin vs chemotherapy in patients with previously treated locally advanced or metastatic urothelial carcinoma. ASCO GU 2021; Abstr. #393
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...