.jpg)
Multiples Myelom: Update vom ASCO- und EHA-Meeting
Autor:
Univ.-Prof. Dr. Heinz Ludwig
Wilhelminen-Krebsforschungsinstitut
c/o I. Medizinische Abteilung
Zentrum für Onkologie und Hämatologie mit
Ambulanz und Palliativstation
Wilhelminenspital, Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Erwartungsgemäß wurden im Rahmen der beiden im Juni dieses Jahres virtuell abgehaltenen Kongresse klinisch relevante Ergebnisse beim multiplen Myelom präsentiert, wobei hier nur einige subjektiv selektionierte Highlights vorgestellt werden.
Diffusionsgewichtete Ganzkörper-MRT ist die bildgebende Untersuchung der Wahl
Richtlinien bezüglich bildgebender Untersuchungen beim multiplen Myelom empfehlen, je nach Verfügbarkeit in der individuellen Einrichtung, die Durchführung einer niedrig dosierten CT, PET/CT oder Ganzkörper-MRT. Alle Technologien haben ihre Stärken und Schwächen: Eine niedrig dosierte CT kann Knochenläsionen, Wirbelkörpereinbrüche und extramedulläre Läsionen gut abbilden, versagt aber oft bei der Entdeckung von diffusen Infiltrationen. Der PET-Teil einer PET/CT liefert wichtige Informationen über die Aufnahmefähigkeit des Tracers in den Myelomläsionen, welche mit der Zellproliferation korreliert. Auch im PET/CT werden diffuse Myelominfiltrationen nicht abgebildet; außerdem findet sich bei etwa 10% der Bevölkerung eine verringerte Hexokinase-Aktivität als Ursache für falsch negative Befunde. Mit der diffusionsgewichteten MR-Bildgebung lässt sich diagnostische Gewebeinformation erhalten, die über die Darstellung der groben Morphologie hinausgeht und diffuse Infiltrationen genauer erfasst. Martin Kaiser hat nun in einer prospektiven Vergleichsstudie zwischen diffusionsgewichteten Ganzkörper-MRT und PET/CT eine signifikante Überlegenheit der MRT in allen untersuchten Parametern (diffuse, fokale und extramedulläre Läsionen) beobachtet, wobei der Unterschied beim Nachweis diffuser Infiltrationen besonders eklatant war (81,7% vs. 16,7%). Alle eingeschlossenen Patienten mit Hochrisiko-Zytogenetik zeigten im MRT diffuse Infiltrationen. Ein bedeutender Nachteil des Ganzkörper-MRTs ist die längere Untersuchungsdauer.1
Massenspektrometrie zur Detektion und Quantifizierung von monoklonalen Proteinen: der Weg in die Zukunft
Die Massenspektrometrie (MS) ist auf dem besten Weg, zur bevorzugten Methode zum Nachweis von monoklonalen Proteinen (MP) aufgrund ihrer weitaus höheren Sensitivität im Vergleich zu den bisher genutzten Techniken zu werden. Noemi Puig hat im Rahmen der PETHEMA/GEM2012MENOS65-Studie die Sensitivität der MS mit der Serumprotein-Elektropherese und Immunfixation verglichen.2 Dabei wurden zu drei verschiedenen Zeitpunkten (nach Induktion [1], nach ASCT [2] und nach Konsolidierung [3]) MP bestimmt und die Ergebnisse miteinander verglichen. Mit MS wurden zu den angegebenen Zeitpunkten bei 63%, 46% und 36% der Proben monoklonale Proteine detektiert, während dies mit den konventionellen Methoden nur bei 52%, 36% und 24% der Fall war. Außerdem wurde mit MS bei 15% der Patienten, die mit konventionellen Techniken als komplette Responder (CR) eingestuft wurden, ein M-Protein nachgewiesen. In weiterer Folge wurden die mit beiden Methoden erhobenen Resultate mit dem progressionsfreien Überleben (PFS) korreliert. Patienten, die nach der Induktion MS-negativ waren, zeigten im Vergleich zu den mit konventionellen Methoden negativen Patienten ein signifikant längeres PFS (2-Jahres-PFS: 95% vs. 70%, p=0,0083). Aufgrund der hohen Sensitivität ist die MS auch bereits zur Verbesserung der Bestimmung einer minimalen Resterkrankung (MRD) herangezogen worden, wobei bei einigen im „next-generation flow“ (NGF) MRD-negativen Patienten mittels MS noch MP nachgewiesen werden konnten. Sollten diese Beobachtungen in größeren Studien bestätigt werden, so dürfte die MS zusätzlich zu den derzeit gängigen Nachweismethoden (NGF, „next-generation sequencing“ [NGS], PET/CT) zur MRD-Bestimmung herangezogen werden.
Fortschritte in der Erstlinienbehandlung
Jüngere, für eine Transplantation geeignete Patienten
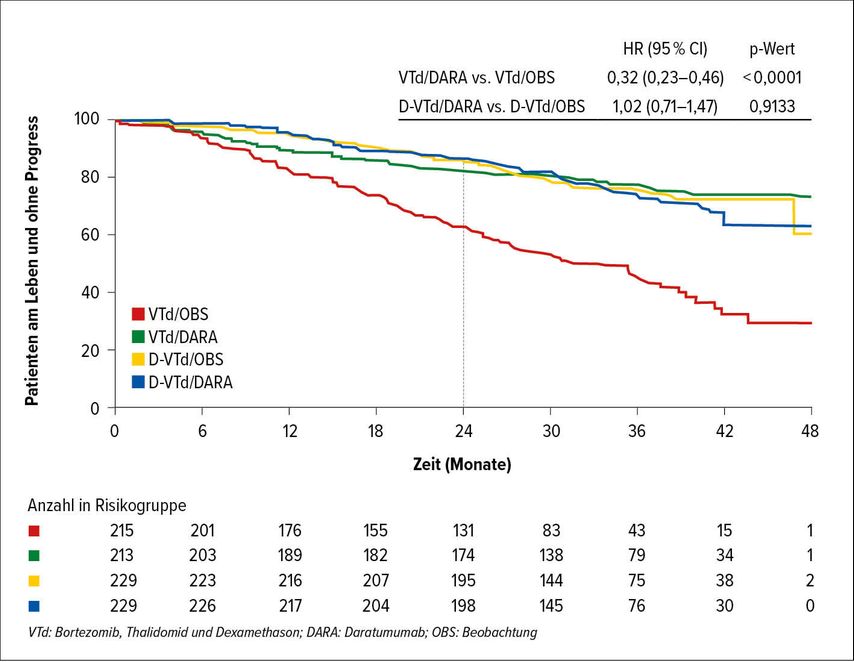
In der von Philipp Moreau vorgestellten CASSIOPEIA-Studie3 wurden Patienten mit neu diagnostiziertem multiplem Myelom (NDMM) in eine Gruppe mit Daratumumab plus Induktionstherapie mit Bortezomib, Thalidomid und Dexamethason (VTd, 6 Zyklen) gefolgt von autologer Stammzelltransplantation (ASCT) und 4 Zyklen VTd-Konsolidierungstherapie (mit bzw. ohne Daratumumab) randomisiert. Nach Beendigung der Konsolidierung wurden 886 Patienten mit Ansprechen auf die Initialtherapie einer zweiten Randomisierung entweder zu einer Erhaltungsbehandlung mit Daratumumab (für 2 Jahre) und Lenalidomid oder in eine Gruppe mit alleiniger Lenalidomid-Erhaltungstherapie unterzogen. Bei dem jetzigen Update nach einem medianen Follow-up von 44,5 Monaten wurde der bereits früher festgestellte Vorteil von Daratumumab/VTd gegenüber VTd für praktisch alle klinisch relevanten Parameter wie Ansprechrate, Rate an MRD-Negativität und PFS bestätigt (HR: 0,58, p<0,0001). In der nun vorgestellten Analyse der Ergebnisse der Erhaltungstherapie wurde nach einer medianen Nachbeobachtung von 35,4 Monaten ein signifikant längeres PFS unter Daratumumab-Lenalidomid- gegenüber einer alleinigen Lenalidomid-Erhaltungstherapie berichtet (HR: 0,53, p<0,0001). Allerdings wurde dieser Effekt nur bei Patienten beobachtet, die während der Induktions- und Konsolidierungstherapie kein Daratumumab erhalten haben. Bemerkenswert ist auch die gute Verträglichkeit von Daratumumab in der Erhaltungstherapie: Nur 3% brachen die Daratumumab-Therapie wegen Nebenwirkungen ab. Derzeit sind noch zu wenige Todesfälle aufgetreten, um die Auswirkung auf das Gesamtüberleben (OS) beurteilen zu können. In der Daratumumab-Gruppe sind bisher 41 und in der Vergleichsgruppe 73 Patienten gestorben (Abb. 1). Diese Ergebnisse unterstützen nach Meinung der Autoren den frühen Einsatz von Daratumumab im Rahmen der Induktions-/Konsolidierungsbehandlung.
Abb. 1: PFS nach Therapiearmen der Erhaltungstherapie in der CASSIOPEIA-Studie (modifiziert nach Moreau P et al.)3
Ältere, für eine Transplantation nicht geeignete Patienten
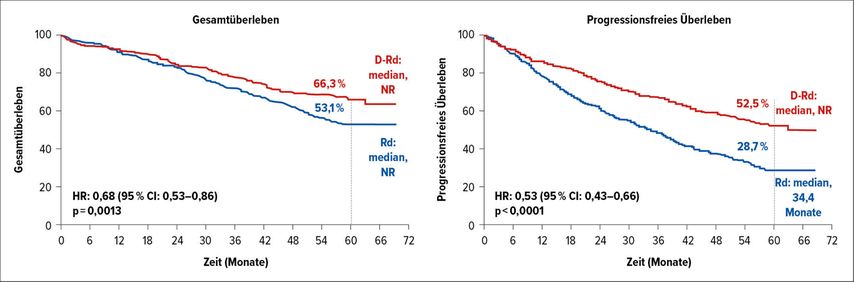
In der MAIA-Studie4 wurden 737 nicht für eine Transplantation geeignete Patienten (medianes Alter 73 [45–90] Jahre) in eine Gruppe mit Daratumumab/Lenalidomid/Dexamethason oder Rd alleine randomisiert. Die Behandlung wurde in 4-wöchigen Zyklen bis zur Progression bzw. Unverträglichkeit fortgesetzt. Frühere Auswertungen haben signifikante Vorteile für die Kombination Daratumumab plus Rd (D-Rd) in praktisch allen relevanten Parametern außer dem Gesamtüberleben gezeigt. Nun wurde nach fast 5 Jahren (56,2 Monate) Nachbeobachtungszeit von Thierry Facon ein signifikanter und klinisch relevanter Überlebensvorteil von D-Rd im Vergleich zu Rd gezeigt. Durch die zusätzliche Gabe von Daratumumab wurde das Sterberisiko signifikant um 32% reduziert (HR: 0,68; p=0,0013), was einer 5-Jahres-Gesamtüberlebensrate (geschätzt) von 66,3% in der D-Rd-Gruppe im Vergleich zu 53,1% in der Rd-Gruppe entspricht (Abb.2B). Auch das Risiko für Progression und Tod war mit 47% signifikant geringer als im Vergleichsarm (HR: 0,53; p<0,0001). Das 5-Jahres-PFS lag bei 52,5% bzw. 28,7% (Abb. 2B). Diese günstigen Resultate wurden trotz des Faktums, dass 46% der Patienten im Rd-Arm eine Folgetherapie mit Daratumumab erhalten hatten, erzielt.
Abb. 2: Gesamtüberleben (A) und progressionsfreies Überleben (B) in der MAIA-Studie (modifiziert nach Facon T et al.)4
Dies ist nun nach der ALCYONE-Studie5 (Daratumumab plus Bortezomib, Melphalan und Prednison [D-VMP] vs. VMP) die zweite große Studie bei älteren Patienten, die einen Überlebensvorteil durch die Kombination von Daratumumab mit einer Standardtherapie nachweist. Somit konnte durch die Kombination mit Daratumumab das wichtigste Ziel in der Myelombehandlung, nämlich die Verlängerung der Überlebenszeit, erreicht werden. Diese Ergebnisse sollten in absehbarer Zeit durch weitere Studien bei jüngeren, für die Transplantation geeigneten Patienten ergänzt werden, wobei auch bei diesen Patienten der Nachweis einer Lebensverlängerung erhofft wird.
Fortschritte in der Behandlung von Patienten mit rezidivierter/refraktärer Erkrankung
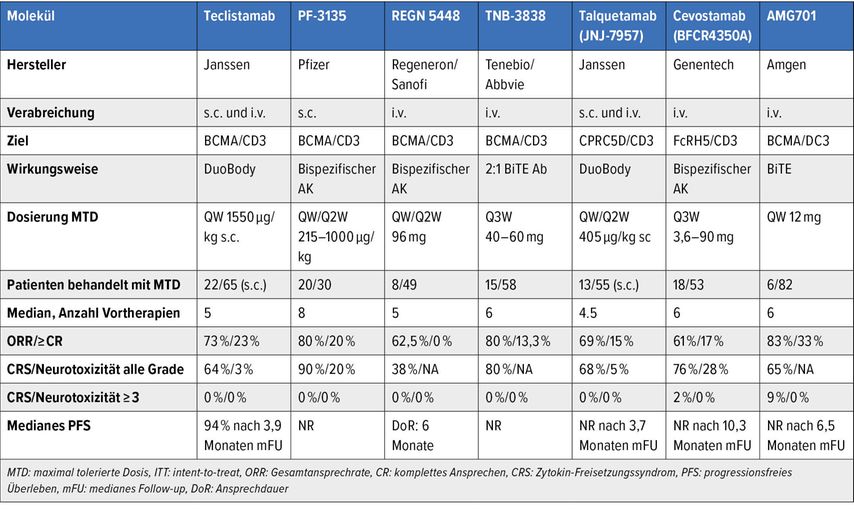
Die größten Fortschritte betreffen Neuentwicklungen auf dem Gebiet der Antikörpertherapien, insbesondere der Entwicklung von bispezifischen Antikörpern (BiTE) und DuoBodies, sowie in der Weiterentwicklung der CAR-T-Zell-Technologie. In Tabelle 1 sind die aktuellen Therapieergebnisse, die mit unterschiedlichen Antikörperpräparaten erreicht wurden, dargestellt, wobei der große Vorteil in der relativ hohen Wirksamkeit, einfachen Applikation und akzeptablen Toleranz besteht. Mit allen angeführten Substanzen werden Ansprechraten zwischen 60% und 83% erreicht. Über die Langzeitwirkung und das progressionsfreie Überleben können derzeit noch keine Aussagen getroffen werden, da die Nachbeobachtungszeit noch zu kurz ist. Aufgrund der beachtlichen Wirksamkeit der BiTEs ist mit deren Erprobung in Kombination mit etablierten Therapieregimen in frühen Behandlungsphasen zu rechnen.
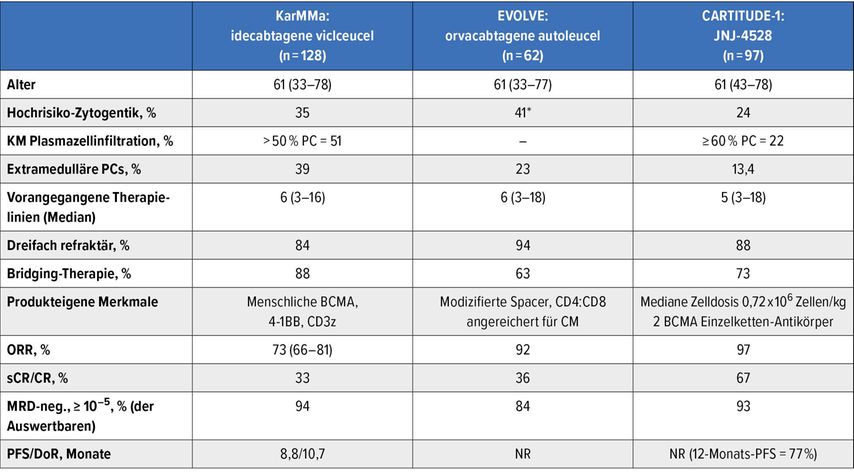
Mittlerweile wurden die CAR-T-Zell-Technologie von Janssen aufgrund der Ergebnisse der CARTITUDE-Studie6 (Tab. 2) von der EMA zugelassen. In dieser Studie wurde eine beeindruckende Remissionsrate von 97% mit einem hohen Anteil von Patienten mit MRD-Negativität erzielt. Zudem liegt das progressionsfreie Überleben nach 12 Monaten bei erstaunlichen 77%, während mit dem CAR-T-Zell-Produkt von Celgene-BMS ähnliche (KarMMa-Studie), möglicherweise etwas weniger eindrucksvolle Ergebnisse (Tab. 2) erreicht wurden.7
Derzeit sind umfangreiche Bemühungen im Gange, um die CAR-T-Zell-Therapie noch wirkungsvoller und besser verträglich zu machen. Bispezifische CAR-T-Zellen könnten das Risiko für Antigen-Escape reduzieren. Humane CAR-Konstrukte könnten die Persistenz der CAR-T-Zellen verbessern, und mittels genetischer Manipulation von allogenen CAR-T-Zellen könnte deren T-Zell-Rezeptor und MHC-Komplex inaktiviert und damit „tolerant“ für den Empfänger gemacht werden. Mittlerweile sind Studien in Planung, die CAR-T-Zellen mit einer autologen Stammzelltransplantation in der Erstlinientherapie vergleichen.
Lösen neue Substanzen und Kombinationen bald die Monotherapie mit Lenalidomid als Standard in der Erhaltungstherapie ab?
Lenalidomid-Erhaltungstherapie nach autologer Stammzelltransplantation ist zwar immer noch der Goldstandard, aber klinische Studien mit Proteasominhibitoren und Anti-CD38-Antikörpern, entweder als Monotherapie oder in Kombination mit Lenalidomid, fordern die bisherige Alleinstellung von Lenalidomid heraus. So konnte in der FORTE-Studie mit der Kombination von Carfilzomib mit Lenalidomid im Vergleich zur alleinigen Lenalidomid-Therapie das PFS in allen zytogenetischen Risikogruppen, außer bei Patienten mit ampl1q verlängert werden.8 Somit kann Carfilzomib als wertvoller Kombinationspartner für Lenalidomid angesehen werden, allerdings wird durch die Erfordernis der intravenösen Verabreichung eine Langzeitbehandlung mit Carfilzomib eingeschränkt. Rezente Ergebnisse der CASSIOPEIA-Studie deuten auf eine signifikante Aktivität von Daratumumab in der Erhaltungstherapie bei Patienten ohne Daratumumab-Exposition in der Induktionstherapie hin; ein Ergebnis, welches gegen eine kontinuierliche Behandlung sprechen könnte. Allerdings kann dies derzeit noch nicht definitiv beurteilt werden, da das PFS2 bei jenen Patienten, die sowohl in der Induktions- als auch in der Erhaltungstherapie Daratumumab erhalten haben, tendenziell länger ist. In der GRIFFIN-Studie9 zeigten Patienten, die in den Daratumumab-Lenalidomid-Arm randomisiert wurden, verglichen mit dem Lenalidomid-Arm signifikant höhere Raten an stringentem komplettem Ansprechen (sCR) und MRD-Negativität. Außerdem werden derzeit neue Substanzen wie CELMoDS (Cereblon-E3-Ligase- Modulatoren) und BiTEs in der Erhaltungstherapie evaluiert.
Literatur:
1 Kaiser MF et al.: Prospective comparison of whole body MRI and FDG PET/CT for detection of multiple myeloma and correlation with markers of disease burden: Results of the iTIMM trial. J Clin Oncol 2021; 39(15 Suppl): 8012 2 Puig N et al.: Analysis of minimal residual disease in bone marrow by NGF and in peripheral blood by mass spectrometry in newly diagnosed multiple myeloma patients enrolled in the GEM2012MENOS65 clinical trial. JClin Oncol 2021; 39(15 Suppl): 8010 3 Moreau P et al.: Daratumumab maintenance vs observation in patients with newly diagnosed multiple myeloma treated with bortezomib, thalidomide, and dexamethasone ± daratumumab and ASCT: CASSIOPEIA part 2 results. EHA 2021, Abstr. #S180 4 Facon T et al.: Overall survival results with daratumumab, lenalidomide, and dexamethasone versus lenalidomide and dexamethasone in transplant-ineligible newly diagnosed multiple myeloma: phase 3 MAIA study. EHA 2021, Abstr. #LB1901 5 Mateos MV et al.: Overall survival with daratumumab, bortezomib, melphalan, and prednisone in newly diagnosed multiple myeloma (ALCYONE): a randomised, open-label, phase 3 trial. Lancet 2020; 395(10218): 132-41 6 Usmani SZ et al.: Ciltacabtagene autoleucel, a B-cell maturation antigen (BCMA)-directed chimeric antigen receptor T-cell (CAR-T) therapy, in relapsed/refractory multiple myeloma (R/R MM): Updated results from CARTITUDE-1. J Clin Oncol 2021; 39(15 Suppl): 8005 7 Oriol A et al.: Idecabtagene vicleucel (ide-cel, bb2121), a BCMA-directed CAR T cell therapy, in patients with relapsed and refractory multiple myeloma: Updated KarMMa results. EHA 2021, Abstr. #EP1009 8 Gay F et al.: Carfilzomib-based induction/consolidation with or without autologous transplant (ASCT) followed by lenalidomide (R) or carfilzomib-lenalidomide (KR) maintenance: efficacy in high-risk patients. J Clin Oncol 2021; 39(15 Suppl): 8002 9 Voorhees PM et al.: Daratumumab, lenalidomide, bortezomib, and dexamethasone for transplant-eligible newly diagnosed multiple myeloma: the GRIFFIN trial. Blood 2020; 136(8): 936-45
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...