Metastasiertes Mammakarzinom: Fokus zerebrale Metastasierung
Autorin:
OÄ Dr. Ursula Pluschnig
Abteilung Hämato-Onkologie
Klinikum Klagenfurt
E-Mail: Ursula.Pluschnig@kabeg.at
Neben dem Lungenkarzinom stellt das Mammakarzinom die häufigste Ursache für zerebrale Metastasen dar. Rund 15–20% der Patient*innen mit metastasiertem Brustkrebs (mBC) entwickeln trotz systemischer Therapie Hirnmetastasen. Die höchste Inzidenzrate zeigt sich bei HER2-positiven und tripelnegativen Tumoren.
Keypoints
-
15–20% der Patient*innen mit metastasiertem Brustkrebs entwickeln trotz systemischer Therapie Hirnmetastasen. Diese sind mit schlechter Prognose und Verminderung der Lebensqualität verbunden und stehen in Zusammenhang mit dem Subtyp des Karzinoms.
-
Die Prognose bei zerebralen Metastasen kann durch ein interdisziplinäres Behandlungskonzept von Neurochirurgie, Strahlentherapie und Onkologie deutlich verbessert werden.
-
Bisherige therapeutische Möglichkeiten wie HER2-gerichtete Substanzen und Kombinationstherapien mit Antikörpern sowie neue systemische Therapieansätze mit Tyrosinkinaseinhibitoren der neuen Generation und Konjugate (ADC) zeigen bei Patient*innen mit HER2-positivem Brustkrebs und Hirnmetastasen vielversprechende Ergebnisse, klinische Relevanz und praxisrelevante Veränderungen.
In den letzten Jahren konnte eine steigende Inzidenz von Hirnmetastasen beobachtet werden, möglich durch therapiebedingte verbesserte Kontrolle der extrakraniellen Metastasierung und/oder infolge der Verbesserungen in der Bildgebung mittels Magnetresonanz (MRT) als aktuelle Standardmethode. Als Risikofaktoren für das Auftreten von Hirnmetastasen gelten ein junges Ersterkrankungsalter, HER2-positive oder tripelnegative Tumoren, ein hohes Grading, ein hoher Ki-67-Wert und/oder ein positiver Nodalstatus. Die Lokalisation ist bei 75% in den Großhirnhälften, bei 21% im Kleinhirn und bei 3% im Hirnstamm.1
Hirnmetastasen verschlechtern für die betroffenen Patient*innen nicht nur die Prognose, sondern können durch die damit verbundenen Symptome wie Kopfschmerzen, Krampfanfälle, Schwindel, Übelkeit, Erbrechen oder neurologische Ausfallserscheinungen (wie Lähmungen und Wortfindungsstörungen) auch zu einer erheblichen Beeinträchtigung der Lebensqualität führen. Ein Anstieg des Hirndrucks kann Apathie, Müdigkeit und Bewusstseinstrübungen hervorrufen. Zur Symptomlinderung werden Antikonvulsiva (nur bei Anfallssymptomatik) und Glukokortikoide eingesetzt.
Bei 5–8% aller Mammakarzinome entwickelt sich eine leptomeningeale Metastasierung (LMC), bei der sich Tumorzellen im Subarachnoidalraum ausbreiten. Bisher betrug die Prognose mit LMC ein bis vier Monate, klinisch reichen die Symptome von Kopf-, Nacken- und Rückenschmerzen und Übelkeit bis zu Visus-Einschränkungen, Sensibilitätsstörungen, Muskelschwäche oder Blasen- und Mastdarmstörungen. Leptomeningeose wird nur zu 60% durch den Nachweis maligner Tumorzellen im Liquor diagnostiziert.2
Therapiestrategien- und optionen
Ein wesentlicher Faktor bei Behandlungsansätzen von zerebralen Metastasen ist die Blut-Hirn-Schranke (BHS).
Dabei handelt es sich um eine hoch selektive physiologische Barriere zwischen Blutsystem und dem zentralen Nervensystem, die eine Diffusionsbarriere für viele Medikamente darstellt und dadurch die systemische Therapie von Hirnmetastasen erschwert. Wurde früher der Fokus in der Behandlung auf sogenannte „small molecules“ wie Tyrosinkinaseinhibitoren (TKI) gelegt, zeigen neuere Forschungsergebnisse, dass die BHS als physiologische Barriere ab einer Hirnmetastasen-Größe von 1–2 Millimetern nicht mehr intakt ist. Dadurch können größere Moleküle wie Antikörper in das ZNS penetrieren.3,4
Als Therapieansätze stehen chirurgische und/oder gezielte Lokaltherapien und systemische Therapien zur Verfügung. Klinisch können Hirnmetastasen als stabil (stabil nach vorhergegangener Behandlung) oder aktiv (lokal vorbehandelt und progredient oder neu aufgetreten ohne akute lokale Behandlungsindikation) angesehen werden.
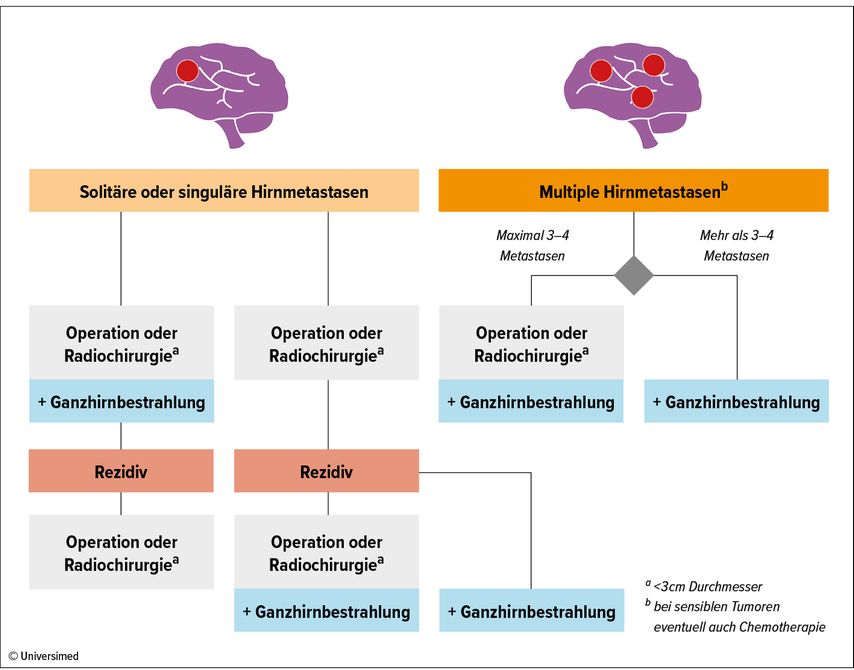
Ein wichtiger Faktor für lokale Therapieansätze (neurochirurgisch, stereotaktische Bestrahlung oder Ganzhirnbestrahlung) ist die Anzahl der Hirnmetastasen. Man unterscheidet singuläre Metastasen, Oligometastasen (bis zu vier) oder multiple Metastasen. Entscheidungskriterien zur Operation sind der Allgemeinzustand der Patient*innen, die Prognose und die operative Zugänglichkeit der Hirnmetastase. Nach vollständiger Resektion erfolgt eine Bestrahlung des Tumorbetts.
Bei reduziertem Karnofsky-Performance-Status der Patient*innen und einem Metastasendurchmesser bis drei Zentimetern kann eine stereotaktische Radiochirurgie (SRS, „stereotactic radiosurgery“) oder fraktionierte stereotaktische Radiotherapie (FSRT, „fractionated stereotactic radiotherapy“) in Betracht gezogen werden. Die Indikation zur Ganzhirnbestrahlung (üblich sind 20–30Gy) wird aufgrund größerer neurokognitiver Nachwirkungen heute enger gestellt.
Bei LMC besteht als Therapieoption eine intrathekale oder intraventrikuläre Therapie mit Methotrexat (MTX) 15mg 2–3x/Woche oder rein symptomatisch mit Steroiden.5–7
Systemische Therapie
Hirnmetastasen stellen oft den limitierenden Faktor der Erkrankung dar, da das Überleben nach Auftreten einer Hirnmetastasierung meist nur wenige Monate beträgt. Patient*innen mit einem HER2-positiven Tumor müssen im Vergleich zu HER2-negativen Patient*innen mit einem aggressiveren Krankheitsverlauf und einem schnelleren Wiederauftreten des Tumors rechnen. Eine zielgerichtete Therapie ist für sie besonders wichtig. Herceptin, der erste gegen HER2 gerichtete Antikörper, leitete bereits vor Jahren eine neue Ära in der Behandlung des HER2-positiven Mammakarzinoms ein.
Abb. 1: Algorithmus zur Behandlung von Hirnmetastasen nach den Leitlinien der Neuroonkologischen Arbeitsgemeinschaft (NOA). Modifiziert nach Leitlinien der DGN: Solide Hirnmetastasen
HER2 („human epidermal growth factor receptor 2“) hat einen direkten Einfluss auf den Verlauf der Erkrankung: In den 1980er-Jahren konnten Rosner D et al. nachweisen, dass konventionelle Chemotherapie bei neu diagnostizierten Hirnmetastasen zu einer Ansprechrate von rund 50% führen kann.8 Lin NU et al. zeigten eine klinisch relevante Aktivität der Kombination von Capecitabin und dem HER2-/epidermalen-Wachstumsfaktorrezeptor-(EGFR)-Tyrosinkinaseinhibitor (TKI) Lapatinib bei Patient*innen mit progredienten Hirnmetastasen nach Lokaltherapie mit einer Ansprechrate im ZNS von 20%.9 Die Zugabe des zielgerichteten HER2-Wirkstoffs Pertuzumab zu Trastuzumab und einer Taxan-basierten Chemotherapie hat in der CLEOPATRA-Studie einen Überlebensvorteil gezeigt und gilt mittlerweile als Standard in der Erstlinientherapie.10
Aufgrund der Daten der EMILIA- und TH3RESA-Studien war bis dato das Antikörper-Wirkstoff-Konjugat Trastuzumab- Emtansin (T-DM1) der Goldstandard in der Zweitlinientherapie.11,12 Fabi A et al. präsentierten 2017 eine multizentrische Studie mit 303 Patient*innen aus 24 Zentren in Italien. In der Studie wurden mit T-DM1 in der Gruppe mit Hirnmetastasen (n=87) ähnlich gute Ansprechraten erreicht wie in der Gruppe ohne Hirnmetastasen (n=216). Die Gesamtansprechrate betrug 35,1% versus 38,3%.13
Neratinib
Neratinib, ein Tyrosinkinasehemmer der zweiten Generation, bindet potent irreversibel EGFR, HER2 und HER4. Die Ergebnisse der NALA-Studie zeigten nach mindestens zwei anti-HER2-basierten Therapien ein verbessertes progressionsfreies Überleben (PFS; HR: 0,76) durch die Kombination Neratinib + Capecitabin vs. Lapatinib + Capecitabin bei Patient*innen mit Hirnmetastasen bei HER2-positiven mBC.14 Neratinib ist derzeit in Europa nur in der erweiterten Adjuvanztherapie bei frühem Brustkrebs zugelassen.
Trastuzumab-Deruxtecan (T-DXd) ist ein gegen das HER2-Protein gerichtetes Antikörper-Wirkstoff-Konjugat (ADC) der neuesten Generation. Die Studie DESTINY-Breast03 ist eine Head-to-Head-Studie der Phase III, in der T-DXd bei 524 vorbehandelten biologischen Frauen mit metastasiertem HER2-positivem Brustkrebs mit dem langjährigen Standard Trastuzumab-Emtansin (T-DM1) verglichen wird. Etwa 15% der Patient*innen hatten ZNS-Metastasen.
Das mediane progressionsfreie Überleben (PFS) lag nach 12 Monaten mit T-DXd bei 75,8% versus 34,1% im T-DM1-Arm. Die objektive Ansprechrate (ORR) betrug unter Trastuzumab-Deruxtecan 79,7% gegenüber T-DM1 mit 34,2%. Der PFS-Nutzen erstreckte sich über alle Subgruppen, einschließlich der Frauen mit ZNS-Metastasen.15,16 Als Nebenwirkung wurde bei 12% eine interstitielle Pneumonitis beobachtet. T-DXd hat sich somit als neuer Standard in der Zweitlinientherapie etabliert.
Tucatinib
Tucatinib, ein Tyrosinkinasehemmer der dritten Generation, bewirkt eine irreversible Hemmung der Tyrosinkinasedomäne von HER2. In der doppelblinden HER2CLIMB-Studie führte die zusätzliche Gabe von Tucatinib zu Trastuzumab und Capecitabin, nach Vortherapie mit Trastuzumab und T-DM1, zu einer signifikanten Verlängerung des progressionsfreien und des Gesamtüberlebens.
48% der Frauen hatten aktive oder stabile Hirnmetastasen. In dieser Kohorte zeigte sich eine Verlängerung des medianen PFS durch die zusätzliche Gabe von Tucatinib von 4,2 auf 9,9 Monate (HR: 0,32). Das Risiko für Progression oder Tod wurde halbiert (HR: 0,48). Im Tucatinib-Arm waren nach einem Jahr noch 25% der Patient*innen mit Hirnmetastasen ohne Progress. Auf Basis dieser Daten wurde Tucatinib als neue Standardtherapie in der Drittlinie definiert.17–19
ADC
Mittlerweile gibt es Hinweise auf eine intrakranielle Aktivität von ADC aus der einarmigen Phase-II-Studie TUXEDO-1 mit 15 Patient*innen mit aktiven Hirnmetastasen (neu diagnostizierte oder progrediente nach vorheriger Lokaltherapie). Nach einem medianen Follow-up von 12 Monaten schrumpften bei 73,3% der Patient*innen die Metastasen durch T-DXd, bei zwei von 15 Patient*innen (13,3%) waren sie sogar durch bildgebende Verfahren nicht mehr nachweisbar.20 In späteren Therapielinien ist Lapatinib in Kombination mit Capecitabin oder Trastuzumab eine evidenzbasierte Therapie.
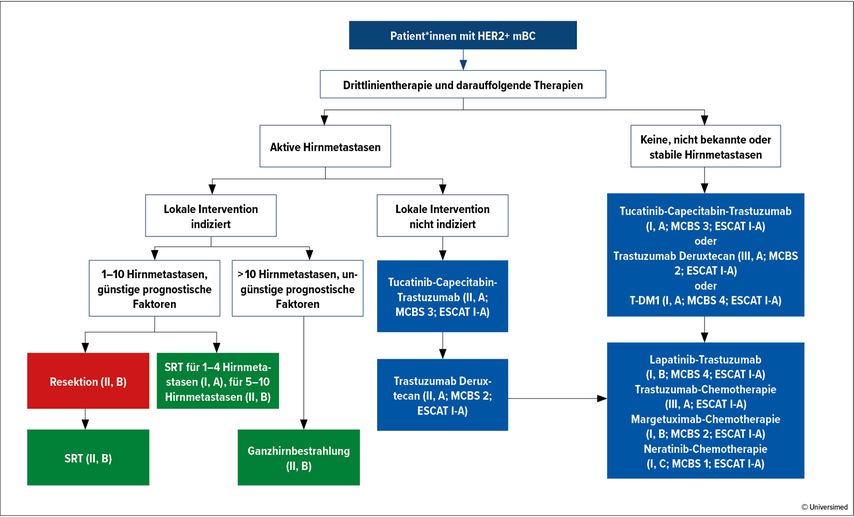
Abb. 2: Drittlinientherapie und darauffolgende Therapien des HER2-positiven mBC. Modifiziert nach ESMO Clinical Practice Guidelines19
Fazit
Trotz der Aggressivität HER2-positiver Mammakarzinome ist die Prognose der Patient*innen aufgrund der Anzahl HER2-gerichteter Substanzen und Kombinationstherapien mit Antikörpernund Rezeptor-Tyrosinkinaseinhibitoren mittlerweile stark verbessert. Bei Hirnmetastasen bestehen noch immer ungelöste Fragen, zum Beispiel zu Resistenzmechanismen und Therapiesequenzen in späteren Behandlungslinien.
Literatur:
1 Le Rhun E et al.: EANO-ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up of patients with brain metastasis from solid tumours. Ann Oncol 2021; 32(11): 1332-47 2 Le Rhun E et al.: EANO-ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up of patients with leptomeningeal metastasis from solid tumours. Ann Oncol 2017; 28(Suppl_4): iv84-99 3 Fokas E et al.: Biology of brain metastases and novel targeted therapies: time to translate the research. Biochim Biophys Acta 2013; 1835(1): 61-75 4 Kurihara H et al.: 64Cu-DOTA-trastuzumab PET imaging and HER2 specificity of brain metastases in HER2-positive breast cancer patients. Eur J Nucl Med Mol Imaging Res 2015; 5: 8 5 Astner S et al.: Strahlentherapie intrazerebraler Metastasen. Onkologe 2008; 14: 246-54 6 Soffietti R et al.: Diagnosis and treatment of brain metastases from solid tumors from the European Association of Neuro-Oncology (EANO). Neuro Oncol 2017; 19(2): 162-74 7 AGO Guidelines: ZNS-Metastasen beim Mammakarzinom. Online unter https://www.ago-online.de/fileadmin/ago-online/downloads/_leitlinien/kommission_mamma/2022/Einzeldateien/AGO_2022D_22_ZNS-Metastases.pdf . Abgerufen am 6.12.2022 8 Rosner D et al.: Chemotherapy induces regression of brain metastases in breast carcinoma. Cancer 1986; 58: 832-9 9 Lin NU et al.: Multicenter phase II study of lapatinib in patients with brain metastases from HER2-positive breast cancer. Clin Cancer Res 2009; 15(4): 1452-9 10 Baselga J et al.: Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer. N Engl J Med 2012; 366(2): 109-19 11 Verma S et al.: Trastuzumab emtansine forHER2-positive advanced breast cancer. N Engl J Med 2012; 367(19): 1783-91 12 Krop IE et al.: Trastuzumab emtansine versus treatment of physician’s choice for pretreated HER2-positive advanced breast cancer (TH3RESA): a randomised, open-label, phase 3 trial. Lancet Oncol 2014; 15(7): 689-99 13 Fabi A et al.: Ado-trastuzumab emtansine (TDM-1) treatment and brain metastases in HER2 positive metastatic breast cancer patients: final analysis of an Italian multicenter study. SABCS 2017; Abstr. #P1-07-02 14 Saura C et al.: Neratinib plus capecitabine versus lapatinib plus capecitabine in HER2-positive metastatic breast cancer previously treated with ≥2 HER2-directed regimens: phase III NALA trial. J Clin Oncol 2020; 38(27): 3138-49 15 Cortés J et al.: LBA1—trastuzumab deruxtecan (T-DXd) vs trastuzumab emtansine (T-DM1) in patients (Pts) with HER2+ metastatic breast cancer (mBC): results of the randomized phase III DESTINY-Breast03 study. Ann Oncol 2021; 32: S1283-346 16 Cortés J et al.: Trastuzumab deruxtecan versus trastuzumab emtansine for breast cancer. N Engl J Med 2022; 386(12): 1143-54 17 Murthy RK et al.: Tucatinib, trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. N Engl J Med 2020; 382: 597-609 18 Lin NU et al.: Intracranial efficacy and survival with tucatinib plus trastuzumab and capecitabine for previously treated HER2-positive breast cancer with brain metastases in the HER2CLIMB trial. J Clin Oncol 2020; 382(7): 597-609 19 Gennari A et al.: ESMO Clinical Practice Guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer. Ann Oncol 2021; 32(12): 1475-95 20 Bartsch R et al.: Trastuzumab deruxtecan in HER2-positive breast cancer with brain metastases: a single-arm, phase 2 trial. Nat Med 2022; 28(9): 1840-7
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...