Lungenkarzinom: Mit stetem Schritt voran
Bericht:
Ingeborg Morawetz, MA
Laut OA Dr. Maximilian J. Hochmair war das Jahrestreffen 2022 der American Society ofClinical Oncology (ASCO) von vielen interessanten Studien und neuen Erkenntnissen geprägt, konnte aber mit keinen bahnbrechenden Ergebnissen aufwarten. In einem Vortrag fasste er die wichtigsten ASCO-Präsentationen zum nichtkleinzelligen Lungenkarzinom im Frühstadium, zu zielgerichteter Therapie, Immun- und Chemoimmuntherapie in Stadium IV und zum kleinzelligen Lungenkarzinom zusammen.
Lungenkrebs im Frühstadium
NADIM-II-Studie:Präoperative IO-Therapie
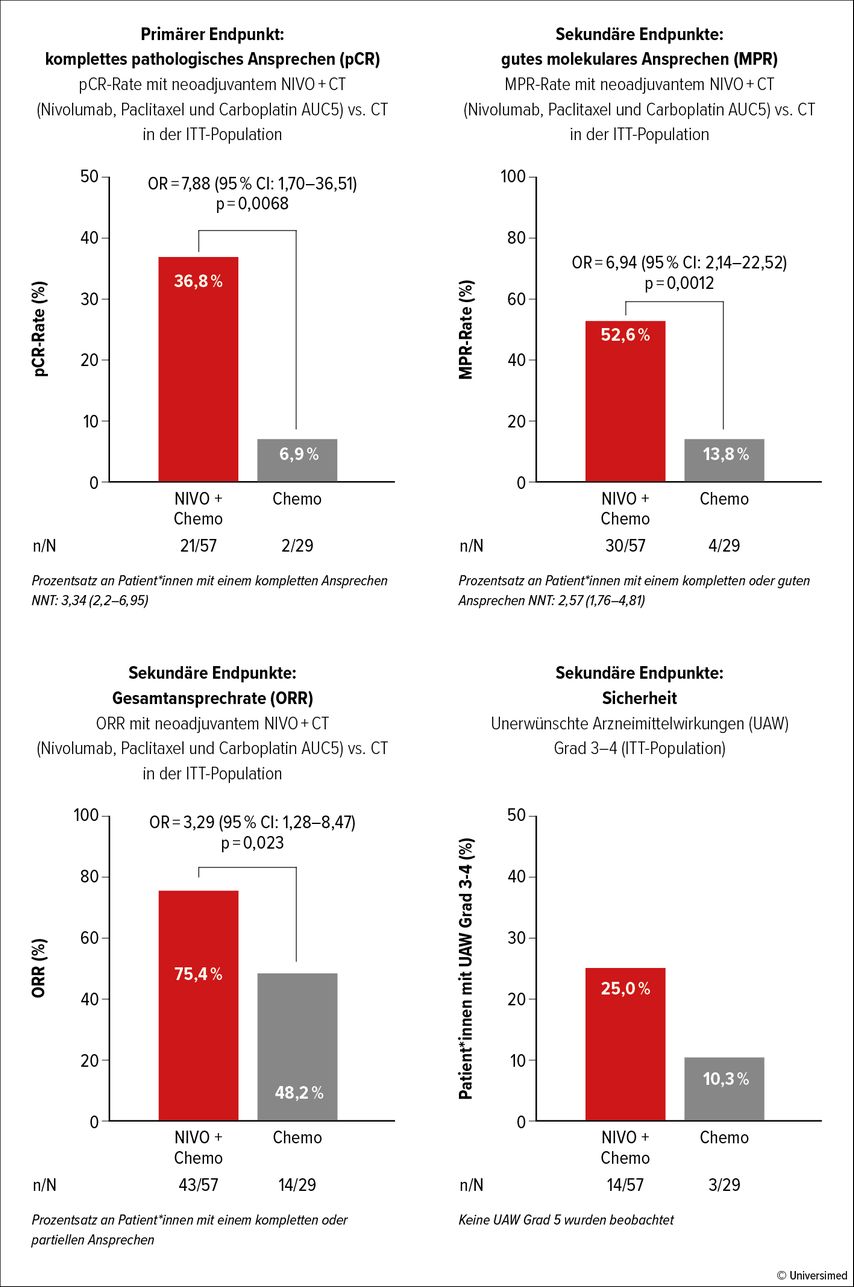
Bei der Phase-II-Studie NADIM II ist die klinisch relevanteste Überlegung, Immunchemotherapie (IO-CT) präoperativ bei Patient*innen einzusetzen, die grundsätzlich als operabel gelten. Die IO-CT der Wahl besteht aus Nivolumab, Paclitaxel und Carboplatin AUC5. Sie wird bei nichtkleinzelligem Lungenkarzinom (NSCLC) im StadiumIIIa–b gegen eine reine Chemotherapie (CT)getestet.1
Primärer Endpunkt ist das komplette pathologische Ansprechen (pCR). Die 86 Patient*innen wurden 2:1 auf zwei Arme randomisiert. Im experimentellen Arm mit IO-CT kam es bei Patient*innen häufiger zu einer Operation als im Kontrollarm. Auch die pCR zeigt einen Vorteil (OR=7,88 [95% CI: 1,70–36,5, p=0,0068]), der von einem verlängerten Gesamtüberleben (OS) begleitet wird. Auch bei den sekundären Endpunkten gutes pathologisches Ansprechen (MPR, OR [Odds Ratio]=6,94 [95% CI: 2,14–22,52, p=0,0012]) und Gesamtansprechrate (ORR, OR=3,29 [95% CI: 1,28–8,47, p=0,023]) wurden Vorteile offenbar. PD-L1 kann als prädiktiver Marker gewertet werden, da mit steigendem PD-L1-Wert ein besseres Ansprechen einhergeht (Abb. 1).
Ein vermehrtes Auftreten unerwünschter Arzneimittelwirkungen (UAW) vom Grad3–4 im Vergleich zum Chemotherapie-Arm ist zwar ungünstig, kann aber durch langjährige Erfahrung mit UAW bei IO-CT klinisch gut gehandhabt werden. Am häufigsten trat eine febrile Neutropenie auf (7,1%), gefolgt von Fatigue und Diarrhö (3,5%). UAW Grad5 wurden nicht beobachtet. Auf Basis dieser Ergebnisse wird eine baldige Zulassung von Nivolumab und Chemotherapie als präoperative IO-Therapie erwartet. Andere Studien zu dieser Kombination bestätigen die Eignung.
neoSCORE-Studie:Drei statt zwei
In der neoSCORE-Studie werden neoadjuvant zwei Zyklen des Immuncheckpoint-Inhibitors Sintilimab mit Chemotherapie gegen drei Zyklen der gleichen Kombination getestet.2 Inkludiert wurden Patient*innen mit resezierbarem NSCLC. Es handelt sich um eine randomisierte, monozentrische, zweiarmige Phase-II-Studie.
Der primäre Endpunkt ist die MPR-Rate, sekundäre Endpunkte sind pCR, ORR, krankheitsfreies Überleben (DFS), OS und Sicherheit. Die MPR-Rate ist bei Patient*innen mit drei Zyklen fast doppelt so hoch wie bei jenen mit zwei (41,4% vs. 26,9%, p=0,260). Bei der pCR zeigte sich bei drei Zyklen eine Verbesserung gegenüber zwei Zyklen, die jedoch nicht statistisch signifikant war. Die Differenz lag bei 5,9%. Patient*innen mit Plattenepithelzellkarzinomen schnitten in allen Endpunkten besser ab als jene mit anderen histologischen Typen.
Der PD-L1-Wert hat eine moderate prädiktive Aussagekraft für MPR. Die Verträglichkeit der drei Zyklen ist klinisch gut. Obwohl weitere Studien nötig sein werden, um mehr statistisch signifikante Werte zu erhalten, ist die Grundaussage der neoSCORE-Studie wichtig: Mehr IO-CT-Zyklen können ohne größere Nachteile für die Patient*innen zu einem besseren Ansprechen führen.
Intraoperative Qualität beeinflusst OS
In dieser retrospektiven Kohortenstudie eines US-amerikanischen Assistenzarztes konnte demonstriert werden, wie wichtig es ist, Patient*innen zur Operation an neurochirurgische Zentren zu überweisen.3 Mithilfe des eigens für diesen Zweck entwickelten VALCAN-O(„Veteran Lung Cancer Operative quality“)-Scores wurden über zehn Jahre hinweg Daten von 9628 Patient*innen mit NSCLC in Stadium I gesammelt.
Der Score beinhaltet fünf Kriterien, für die Punkte vergeben werden: den Zeitpunkt der Operation (innerhalb von zwölf Wochen nach Diagnose), minimal invasive Chirurgie, anatomische Resektion in Form einer Lobektomie, adäquate Lymphknotenbiopsien (≥10 Knoten) und negative Resektionsränder. 0 Punkte bedeutet, dass keines der Kriterien erfüllt ist, 100 Punkte, dass alle erfüllt sind. Das mediane Follow-up lag bei 6,2 (2,5–11,4) Jahren.
Die Analyse fand anhand dieser intraoperativen Qualitätsmerkmale in Bezug auf das OS statt. Der VALCAN-O-Score wurde wiederum ins Verhältnis zum DFS gesetzt. Es zeigte sich, dass ein höherer Score auch mit längerem OS und DFS einhergeht. Dementsprechend ist es sinnvoll, Patient*innen an spezialisierte Zentren zu überweisen, wenn diese bestimmte intraoperative Qualitätsmerkmale einhalten und beachten.
Zielgerichtete Therapien
KRYSTAL-1: Adagrasib beiKRAS-G12C-Mutation
Die KRYSTAL-1-Studie ist eine Phase-II-Multikohorten-Studie mit den Untersuchungszielen ORR, Dauer bis zum Ansprechen (DOR), progressionsfreies Überleben (PFS), OS, Sicherheit sowie pharmakokinetische Eigenschaften und einer explorativen korrelativen Analyse.4 ORR war der primäre Endpunkt. 116 Patient*innen mit fortgeschrittenem/metastasiertem NSCLC mit einer KRAS-G12C-Mutation, die zuvor mit platinbasierter CT und/oder Anti-PD-L1-Therapie behandelt wurden, wurden inkludiert. Sie erhielten Adagrasib p.o. zweimal täglich.
In Bezug auf die ORR brachte die KRYSTAL-1-Studie beeindruckende Ergebnisse. Bei der inkludierten Patient*innengruppe, die normalerweise schlechte klinische Resultate zeigt, wurden 43% erreicht. Die Krankheitskontrollrate (DCR) lag bei 80%. Das mediane PFS erreichte 6,5 Monate, das mediane OS 12,6 Monate. Die Ein-Jahres-OS-Rate beträgt 51%. Dass jedoch 45,7% der Patient*innen UAW vom Grad 3 und höher erfuhren, ist laut Dr. Hochmair ein nicht zu vernachlässigendes Problem. Die Autor*innen der Studie schätzen die UAW als handhabbar ein.
Im Vergleich zu einer ähnlich aufgebauten Studie mit Sotorasib muss angemerkt werden, dass Sotorasib teils identische Ergebnisse erzielt, aber mit weniger UAW einhergeht. In einem nächsten Schritt soll in der KRYSTAL-12-Studie Adagrasib gegen Docetaxel getestet werden.
CHRYSALIS-2-Studie: Amivantamab + Lazertinib
Auch zur laufenden „Open label“-Studie CHRYSALIS-2 gibt es ein Update.5 In dieser Studie wurde die Monotherapie mit Amivantamab und Lazertinib bei Patient*innen mit NSCLC und einer EGFR-Mutation bei Progression nach einer Therapie mit Osimertinib und platinbasierter CT getestet. Es handelt sich um eine von zwei Präsentationen auf der ASCO-Jahrestagung 2022, die sich mit Amivantamab befassen. Patient*innen, die in CHRYSALIS-2 aufgenommen wurden, wurden in vier Kohorten aufgeteilt.
Das Update bezog sich auf Kohorte A mit 162 Patient*innen, die nach der Gabe von Osimertinib und einer platinbasierten CT eine Progression zeigten. Es konnte eine verbesserte Anti-Tumor-Aktivität festgestellt werden. Bei 45 Patient*innen, die nur eine Therapie mit Osimertinib bekommen hatten, lag die ORR bei 36% und die mediane DOR ohne Biomarker-Selektion bei 9,6 Monaten. Es ist aber bereits erkennbar, dass in den Kohorten mit anderen Vortherapien bessere Werte erbracht werden. Die größten Erfolge waren bei Patient*innen zu sehen, die außerhalb etablierter Therapieschemata stark vorbehandelt wurden. Die Studie lässt vermuten, dass auch nach Osimertinib-Versagen mit Amivantamab und Lazertinib eine Therapieoption mit gutem UAW-Profil zur Verfügung steht.
Andere Studien, die zum Beispiel mit Necitumumab und Telisotuzumab Vedotin (Teliso-V) auf einer Osimertinib-Therapie aufbauen, sind ebenfalls vielversprechend. Die Teliso-V-Studie mit einer ORR von 58% inkludiert momentan nur 25 Patient*innen, soll aber bald auch nach Österreich kommen.6 „Ein Lichtblick“, meint Dr. Hochmair.
CLN-081 bei EGFR-Exon-20-Mutation
Eine Phase-I/IIa-Studie mit dem EGFR-Tyrosinkinase(TKI)-Inhibitor CLN-081 erbrachte eine gute Datenlage bei Patient*innen mit NSCLC und EGFR-Exon-20-Mutation, die zuvor mit einer platinbasierten Chemotherapie behandelt worden waren.7 Von den 73 Patient*innen wiesen 39% therapierte, stabile Metastasen im Gehirn auf. Neben einem zufriedenstellenden UAW-Profil zeichnete sich CLN-081 durch gute interzerebrale Wirksamkeit und hohe Ansprechraten aus. Diese Merkmale lassen zu, dass sich CLN-081 im klinischen Gebrauch neben Amivantanib einordnen können wird.
UAW traten bei ≥10% der Patient*innen auf, die meisten waren von Grad 1 bis 2. Bei Dosisreduktionen auf <150mg BID kam es nicht zu Grad-3-UAW. Die höchsten Ansprechraten wurden bei einer Dosis von 100mg BID erreicht, aber alle Dosislevel zeigten vergleichbar gute Wirkung.
CROWN-Studie: nachfolgende Therapien
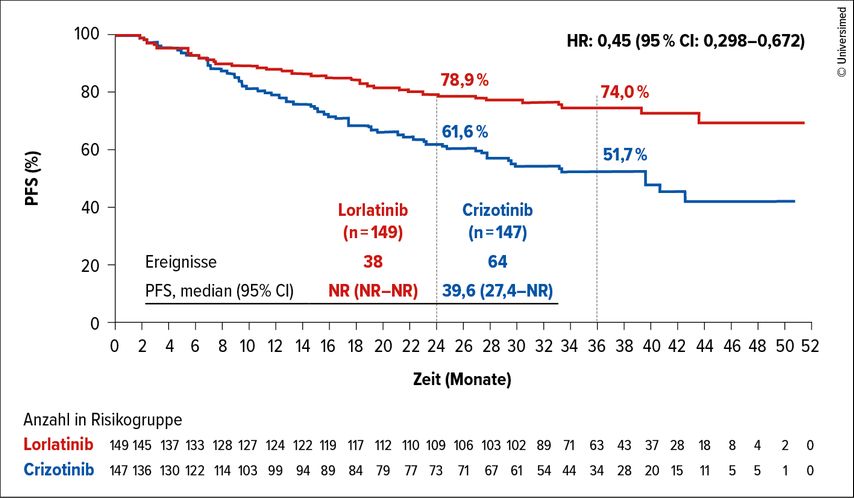
Die CROWN-Studie ist eine Phase-III-Studie, die eine Therapie mit dem ALK-TKI-Inhibitor Lorlatinib bei Patient*innen mit zuvor unbehandeltem ALK-positivem NSCLC mit einer Therapie mit Crizotinib vergleicht.8 Bei einer Interimsanalyse nach 18,3 Monaten zeigte sich ein statistisch signifikanter Vorteil im PFS für den Lorlatinib-Arm. Dieses Ergebnis führte bereits zu einer Zulassung des Wirkstoffs in mehreren Ländern. Auch nach weiteren 18 Monaten bliebt der PFS-Vorteil erhalten.
Obwohl nach insgesamt 38 Monaten immer noch 61,1% der Patient*innen erfolgreich mit Lorlatinib behandelt wurden (vs. 8,2% mit Crizotinib), wurden in einer weiteren Studie Therapien getestet, die auf ein Lorlatinib-Versagen folgen können. Auch beim PFS2 behauptete sich Lorlatinib gegenüber Crizotinib: Ein Interimswert nach 36 Monaten liegt bei einer PFS-Rate von 74% vs. 51,7% über alle nachfolgenden ALK-TKI- und Non-ALK-TKI-Therapien hinweg (Abb. 2).
ALTA-1L-Studie:Tumorgröße und PFS
In der randomisierten Phase-III-Studie ALTA-1L konnte eine Überlegenheit von Brigatinib gegenüber Crizotinib in Bezug auf Effizienz, Verträglichkeit und Lebensqualität nachgewiesen werden.9,10 Eine zusätzliche Analyse zeigte nun einen Zusammenhang zwischen der Intensität der Zielläsion in Form der Reduzierung der Tumorgröße und den klinischen Ergebnissen bei Patient*innen mit ALK-Inhibitor-naivem ALK-positivem NSCLC, die mit Brigatinib behandelt wurden.11
Eingeteilt nach RECIST v1.1 ergaben sich drei Gruppen für die Reduzierung der Tumorgröße: ≤50%, 51–75% und 76–100%. Die klinischen Ergebnisse der ersten Gruppe wurden mit denen der beiden letzten verglichen. Patient*innen mit einer Reduktion der Tumorgröße um >75% hatten eine signifikant geringere Wahrscheinlichkeit, ein PFS- oder OS-Ereignis zu erleben. Diese Beobachtung gilt sowohl für Brigatinib als auch für Crizotinib. Brigatinib führte jedoch zu signifkant mehr Reduzierungen der Tumorgröße um >75%.
Aus den Ergebnissen ist zu schlussfolgern, dass Patient*innen mit gutem Ansprechen auf Brigatinib auch auf einen längeren ereignisfreien Verlauf hoffen können und seltener klinisch kontrolliert werden müssen.
NSCLC Stadium IV und Immunchemotherapie
IO-CT vs. IO-Therapie bei NSCLC mit PD-L1>50%
In einer gepoolten Analyse der U.S. Food and Drug Administration (FDA) wurden die Ergebnisse von zwölf randomisierten Studien zur Anti-PD-(L)-1-IO-Therapie mit oder ohne Chemotherapie als Erstlinientherapie bei Patient*innen mit NSCLC verglichen.12 Inkludierte Patient*innen hatten einen PD-L1-Score von ≥50%. Das explorative primäre Endergebnis war das OS, weitere explorative Ergebnisse waren das PFS und die ORR. Subgruppen wurden aufgeteilt nach Alter (<65 Jahre vs. 65–75 Jahre vs. ≥75 Jahre), ECOG(„Eastern Cooperative Oncology Group“)-Status (0 vs. ≥1) und Nikotinkonsum (nie vs. ja).
Sowohl zur IO-Therapie (n=1298) als zur IO-CT (n=455) wurden je sechs Studien inkludiert. Die IO-Wirkstoffe umfassten Pembrolizumab, Azetolizumab, Nivolumab, Ipilimumab und Cemiplimab. Daten von 3189 Patient*innen wurden analysiert. Bei den explorativen Ergebnissen zu OS, PFS und ORR konnte ein Trend zu einer besseren Wirksamkeit der IO-CT über beinahe alle Subgruppen hinweg gesehen werden:
-
medianes OS: IO-CT 25 Monate vs. IO 20,9 Monate (HR 0,82; 95% CI: 0,62–1,08)
-
medianes PFS: IO-CT 9,6 Monate vs. IO 7,1 Monate (HR 0,69; 95% CI: 0,55–0,87)
-
ORR: IO-CT 61% vs. IO 43% (OR 1,2, 95% CI: 1,1–1,3)
Bei der Subgruppe von Patient*innen ≥75 Jahre liegt jedoch ein Trend zu einem Vorteil der reinen IO-Therapie vor. Diese macht 11% der Studienpopulation aus. Für alle Subgruppen gilt, dass eine höhere PD-L-1-Expression auch mit erhöhtem Ansprechen einhergeht.
IO vs. IO-CT beim KRAS-positiven NSCLC
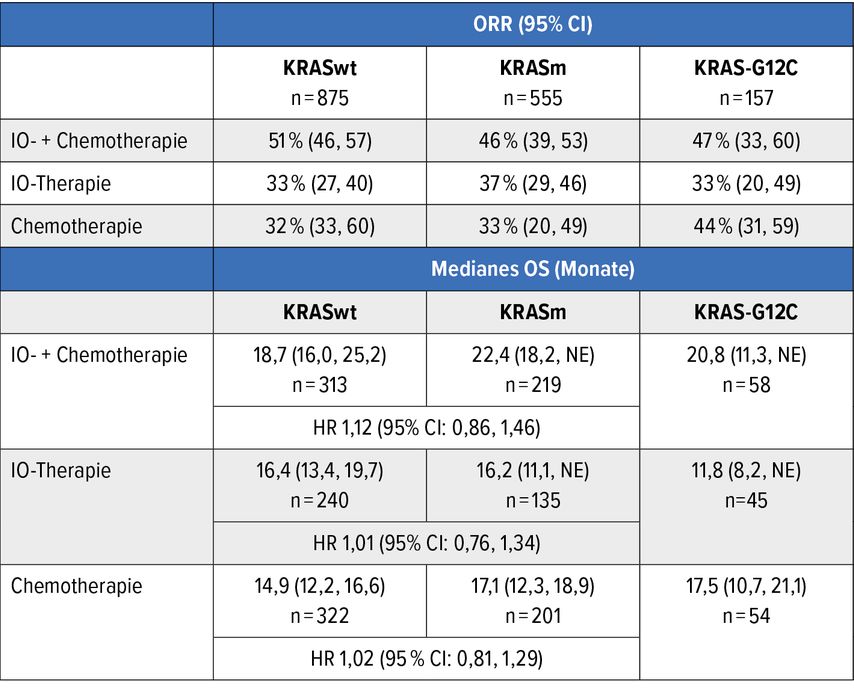
Eine weitere retrospektive gepoolte Analyse der FDA beschäftigt sich mit den Ergebnissen von verschiedenen Erstlinientherapien bei Patient*innen mit fortgeschrittenem NSCLC entsprechend dem Status der KRAS-Mutation und der PD-L1-Expression.13 Unter der Fragestellung, ob in Bezug auf ORR und OS bei einer KRAS-Mutation eine Therapie mit Immuncheckpoint-Inhibitoren einer IO-CT nicht doch vorzuziehen sein könnte, wurden aus zwölf Studien die Daten von Patient*innen mit KRASm- (n=555) und KRAS-G12C-Mutation (n=157) und KRAS-Wildtyp (n=875) unter IO-Therapie, IO-CT und CT miteinander verglichen. 60% waren männliche Patienten, 89% weiß, 60% PD-L1-positiv und 67% ehemalige oder derzeitige Raucher*innen.
Bei allen 1430 Patient*innen mit einer KRAS-Mutation zeigte sich die IO-CT den anderen beiden Therapien überlegen (Tab. 1), vergleichbar mit den Ergebnissen beim KRAS-Wildtyp. Die Limitationen der Studie lagen darin, dass nur für 16% der Patient*innen in den zwölf Studien der KRAS-Status vorlag, dass unter jenen mit KRAS-Mutation auch EGFR/ALK-Mutationen vorgekommen sein dürften, dass Patient*innen nicht nach Krankheitscharakteristika sortiert wurden und dass für andere Mutationen (KEAP1, TP53, STK11) kein Ko-Mutations-Status angegeben wurde.
Tab. 1: Gesamtansprechrate (ORR) und Gesamtüberleben (OS) fallen bei KRAS-Wildtyp und KRAS-Mutation bei IO-CT ähnlich aus
TACTI-002: „Two ACTive Immunotherapies“
Ohne Selektion enstprechend der PD-L1-Expression wurden in der multinationalen randomisierten Phase-II-Studie TACTI-002 bei NSCLC in der Erstlinientherapie das lösliche LAG-3-Protein Eftilagimod alpha und Pembrolizumab in Kombination getestet.14 Eftilagimod alpha bindet LAG-3 nicht unmittelbar, aber beeinflusst über den LAG-3-Pathway antigenpräsentierende Zellen.
Der primäre Endpunkt war ORR nach iRECIST, die sekundären Endpunkte waren ORR nach RECIST 1.1, DOR, Sicherheit, PFS, OS und Pharmakokinetik und -dynamik. Patient*innen hatten zuvor ein unbehandeltes, metastasiertes NSCLC. 88% waren bei Studieneintritt im Stadium IV. Patient*innen wurden nicht nach PD-L1-Expression selektiert. Dennoch waren alle möglichen PD-L1-Subgruppen repräsentiert.
Bei ausgewählten Patient*innen zeigte sich eine gute Verträglichkeit. Eine ORR von 38,6% nach iRECIST in der Interventionsgruppe und eine DCR von 81,5% nach iRECIST in der evaluierbaren Population geben einen ersten Hinweis darauf, dass die Kombinationstherapie effektiv sein könnte. Eine rückwirkende Analyse nach PD-L1-Expression ergab, dass ein negativer PD-L1-Status schlechtere Ergebnisse erbrachte. Zukünftige Studien ausschließlich mit PD-L1-positiven Patient*innen sind geplant.
Ramucirumab + Pembrolizumab: einHoffnungsschimmer
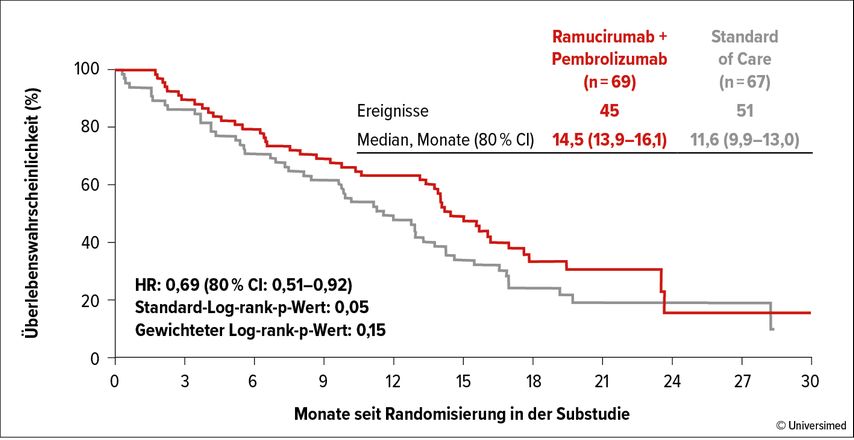
Die Substudie S1800A zur randomisierten Phase-II-Studie Lung-MAP befasste sich mit dem OS bei der Gabe von Ramucirumab und Pembrolizumab im Vergleich zum „Standard of Care“ beim fortgeschrittenen NSCLC.15 Die 166 inkludierten Patient*innen hatten zuvor bereits für mindestens 84 Tage eine IO-Therapie erhalten, während oder nach der es zu einer Progression der Erkrankung kam. 137 von ihnen konnten für die Auswertung herangezogen werden. Der primäre Endpunkt war das OS.
Nach einem IO-Versagen kann der synergistische Effekt von Ramucirumab und Pembrolizumab auf das VGF-Protein in der Nächstlinientherapie eine wichtige Rolle spielen. Bei therapienaiven Patient*innen mit NSCLC hatte die Kombination bereits erfolgsversprechende Daten erbracht. In der S1800A-Studie war das OS unabhängig von der PD-L1-Expression und von Ko-Mutationen gegenüber verschiedenen „Standards of Care“ so sehr überlegen (HR: 0,61 95% CI: 0,38–0,97, p=0.019; medianes OS [95% CI] von 15,0 (13,2–17) Monaten vs. 11,6 [8,5–13,8] Monate), dass Dr. Hochmair von einem „Hoffnungsschimmer für unsere Patient*innen“ spricht (Abb. 3). Er baut auf einen baldigen klinischen Einsatz.
Kleinzelliges Lungenkarzinom
Enttäuschung bei SKYSCRAPER-02
Ernüchternd waren hingegen die Ergebnisse der SKYSCRAPER-02-Studie.16 In der randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie wurde die Wirkung der Kombination von Atezolizumab, Carboplatin und Etoposid mit oder ohne dem Anti-TIGIT-Antikörper Tiragolumab bei Patient*innen mit unbehandeltem metastasiertem kleinzelligem Lungenkarzinom (ES-SCLC) getestet. Primäre Endpunkte waren OS und PFS.
490 Patient*innen wurden inkludiert. Das mediane Follow-up betrug 13,9 Monate. Das OS erfuhr eine Interimsanalyse, das PFS eine finale Analyse. Zwischen der Interventions- und der Kontrollgruppe konnte kein signifikanter Unterschied in diesen beiden Punkten festgestellt werden. Auch das UAW-Profil fiel in beiden Armen ähnlich aus. Tiragolumab wird also zunächst keinen Einzug in die SCLC-Therapie halten.
KOMMENTAR: Mein Eindruck vom ASCO-Jahrestreffen 2022
Die relevanteste Arbeit, die auch einen Trend ausmacht, ist die Studie NADIM II. Wie auch in der neoScore-Studie geht es hier um den Einsatz von Immuntherapie in frühen Erkrankungsstadien. NADIM II zeigt, dass Chemoimmuntherapie Patient*innen, die in Hinsicht auf eine Operation als sehr kritisch eingestuft werden, durch Remissionen und sogar pathologische Vollremissionen doch noch operabel machen kann. neoScore beantwortet zwar nicht die Frage nach der Anzahl der Therapiezyklen, gibt aber einen Hinweis auf den Vorteil von drei vs. zwei Zyklen. In der Klinik wird es jedoch immer noch eine individuelle Entscheidung sein, mit wie vielen Zyklen gearbeitet wird, z.B. je nach Verfügbarkeit der Präparate.
Eine wichtige Information beim Jahrestreffen war auch, dass der Einsatz einer Chemo-Strahlentherapie dem Einsatz einer neoadjuvanten Chemotherapie gleichwertig ist. Auf dem Weg zur Operation reicht also die Chemotherapie alleine aus.
Eine gepoolte Analyse der FDA zum NSCLC im Stadium IV mit >50% PD-L1-Expression bestätigt zwar den Klinikalltag, deckt in ihrer Fragestellung aber nicht die Entscheidungen ab, die zu einem «treatment changer» werden könnten. Bisher behandeln wir Patient*innen mit hoher PD-L1-Expression zu 90–100% mit Immuntherapie, bei hoher Tumorlast und niedriger PD-L1-Expression mit Chemoimmuntherapie – daran ändert die Analyse nichts.
Eine zweite gepoolte Analyse der FDA von KRAS-positiven Patient*innen zeigt, dass unabhängig vomKRAS-Status Chemoimmun- oder Immuntherapie in Erstlinieanhand vorliegender Daten eingesetzt werden sollten.
Die SKYSCRAPER-02-Studie zum SCLC hingegen ist enttäuschend. Von den Anti-TIGIT-Antikörpern in dieser Indikation haben wir uns viel erhofft. Nun spekulieren wir darauf, dass Anti-TIGIT-Antikörper in anderen Indikationen eine Rolle spielen werden.
Kommentar von
OA Dr. Maximilian J. Hochmair
Wien
Literatur:
1 Provencio-Pulla M et al.: Nivolumab + chemotherapy versus chemotherapy as neoadjuvant treatment for resectable stage IIIA NSCLC: Primary endpoint results of pathological complete response (pCR) from phase II NADIM II trial. J Clin Oncol 2022; 40(suppl 16): Abstr. #8501 2 Qiu F et al.: Two cycles versus three cycles of neoadjuvant sintilimab plus platinum-doublet chemotherapy in patients with resectable non-small-cell lung cancer (neoSCORE): Arandomized, single center, two-arm phase II trial. J Clin Oncol 2022; 40(suppl 16): Abstr. #8500 3 Heiden B et al.: Intraoperative quality metrics and association with survival following lung cancer resection. J Clin Oncol 2022; 40(suppl 16): Abstr. #8502 4 Spira A et al.: KRYSTAL-1: Activity and safety of adagrasib (MRTX849) in patients with advanced/metastatic non–small cell lung cancer (NSCLC) harboring a KRASG12C mutation. J Clin Oncol 2022; 40(suppl 16): Abstr. #9002 5 Shu C et al.: Amivantamab and lazertinib in patients with EGFR-mutant non–small cell lung (NSCLC) after progression on osimertinib and platinum-based chemotherapy: Updated results from CHRYSALIS-2. J Clin Oncol 2022; 40(suppl 16): Abstr. #9006 6 Camidge DR et al.: Telisotuzumab vedotin (Teliso-V) monotherapy in patients (pts) with previously treated c-Met–overexpressing (OE) advanced non-small cell lung cancer (NSCLC). J Clin Oncol 2022; 40(suppl 16): Abstr. #9016 7 Yu HA et al.: Phase (Ph) 1/2a study of CLN-081 in patients (pts) with NSCLC with EGFR exon 20 insertion mutations (Ins20). J Clin Oncol 2022; 40(suppl 16): Abstr. #9007 8 Solomon BJ et al.: Post hoc analysis of lorlatinib intracranial efficacy and safety in patients with ALK-positive advanced non–small-cell lung cancer from the phase III CROWN study. JClin Oncol 2022; 9 Camidge DR et al.: Brigatinib versus crizotinib in ALK inhibitor-naive advanced ALK-positive NSCLC: final results of phase 3 ALTA-1L trial. JThorac Oncol 2021; 16(12): 2091-108 10 Camidge DR et al.: Brigatinib versus crizotinib in advanced ALK inhibitor–naive ALK-positive non–small cell Lung Cancer: second interim analysis of the phase III ALTA-1L trial. J Clin Oncol 2022; 38(31): 3592-603 11 Camidge DR et al.: Association of depth of target lesion response to brigatinib with outcomes in patients with ALK inhibitor-naive ALK+ NSCLC in ALTA-1L. J Clin Oncol 2022; 40(suppl 16): Abstr. #9072 12 Akinboro O et al.: Outcomes of anti–PD-(L)1 therapy with or without chemotherapy (chemo) for first-line (1L) treatment of advanced non–small cell lung cancer (NSCLC) with PD-L1 score ≥ 50%: FDA pooled analysis. J Clin Oncol 2022; 40(suppl 16): Abstr. #9000 13 Nakajima EC et al.: Outcomes of first-line immune checkpoint inhibitors with or without chemotherapy according to KRAS mutational status and PD-L1 expression in patients with advanced NSCLC: FDA pooled analysis. J Clin Oncol 2022; 40(suppl 16): Abstr. #9001 14 Felip E et al.: Aphase II study (TACTI-002) in first-line metastatic non–small cell lung carcinoma investigating eftilagimod alpha (soluble LAG-3 protein) and pembrolizumab: Updated results from a PD-L1 unselected population. J Clin Oncol 2022; 40(suppl 16): Abstr. #9003 15 Reckamp KL et al.: Overall survival from a phase II randomized study of ramucirumab plus pembrolizumab versus standard of care for advanced non–small cell lung cancer previously treated with immunotherapy: Lung-MAP nonmatched substudy S1800A. J Clin Oncol 2022; 40(suppl 16): Abstr. #9004 16 Rudin CM et al.: SKYSCRAPER-02: Primary results of a phase III, randomized, double-blind, placebo-controlled study of atezolizumab (atezo) + carboplatin + etoposide (CE) with or without tiragolumab (tira) in patients (pts) with untreated extensive-stage small cell lung cancer (ES-SCLC). J Clin Oncol 2022; 40(suppl 17): Abstr. #LBA8507
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...