_imaginima.jpg)
Kombinationstherapien in der Behandlung urogenitaler Tumoren
Abteilung für Innere Medizin II<br>Universitätsklinikum Krems<br> Karl Landsteiner Privatuniversität für Gesundheitswissenschaften<br>Krems an der Donau<br> E-Mail: sonia.vallet@krems.lknoe.at
In den letzten Jahren ist es zu einem Paradigmenwechsel in der Behandlung von urogenitalen Tumoren gekommen. Für die längste Zeit war die Sequenzierung von Monotherapien die übliche Vorgehensweise, insbesondere beim Nierenzell- und Prostatakarzinom. Die Ergebnisse zahlreicher Phase-III-Studien haben mittlerweile gezeigt, dass therapienaive Patienten mit fortgeschrittenem Nierenzellkarzinom und Prostatakarzinom von einer Kombinationstherapie profitieren können.
Keypoints
Bei Patienten mit metastasiertem Nierenzellkarzinom in der Erstlinie gelten ICI-basierte Kombinationen als neue Standardbehandlung.
In der Upfront-Therapie des metastasierten, hormonsensitiven Prostatakarzinoms stehen vier Substanzen in Kombination mit ADT zur Verfügung: Docetaxel, Abirateron, Enzalutamid und Apalutamid.
Bei Platin-fitten Patienten mit metastasiertem Urothelkarzinom stellt eine Cisplatin-haltige Kombinationstherapie unverändert den Therapiestandard dar.
Lokal fortgeschrittenes und metastasiertes Nierenzellkarzinom
Durch den Einsatz von Immuncheckpoint-Inhibitoren (ICI) nach Versagen der Tyrosin-Kinase-Inhibitoren (TKI) wurde ein messbarer Fortschritt in der Behandlung des metastasierten Nierenzellkarzinoms erreicht. Inzwischen sind ICI in unterschiedlichen Kombinationen auch in der Erstlinientherapie in Europa zugelassen worden, und zwar Ipilimumab plus Nivolumab im Jänner 2019, Pembrolizumab plus Axitinib im September 2019 und Avelumab plus Axitinib im November 2019 (Tab. 1).
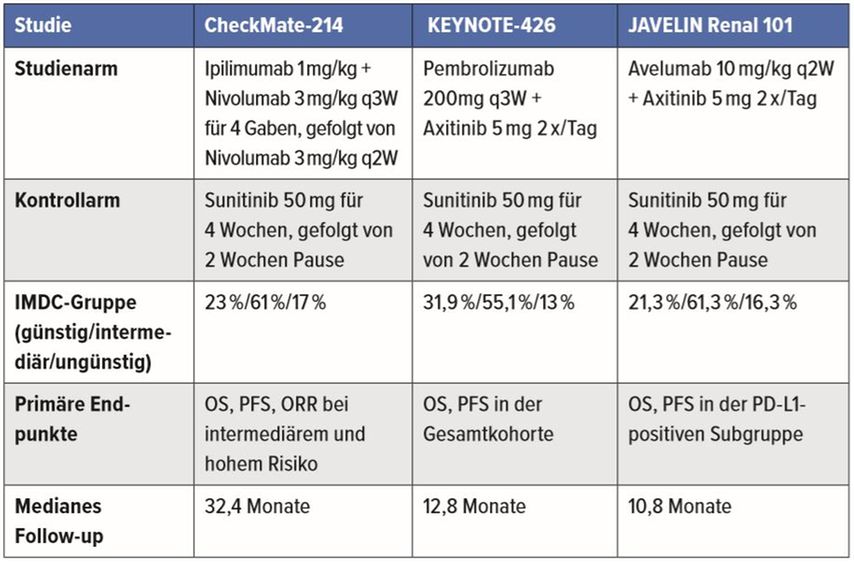
Tab. 1: ICI-basierte Kombinationstherapie bei unbehandeltem Nierenzellkarzinom
In der CheckMate-214-Studie wurden 1096 Patienten zu einer Kombinationstherapie mit dem „Cytotoxic T-lymphocyte-associated protein 4“(CTLA-4)-Inhibitor Ipilimumab plus dem „programmed cell death protein 1“(PD-1)-Inhibitor Nivolumab und einer Therapie mit Sunitinib randomisiert.1 Jeweils 17% der Patienten in beiden Studienarmen wiesen ein ungünstiges IMDC(International Metastastic RCC Database Consortium)-Risikoprofil auf. Nach 30 Monaten Follow-up zeigt sich eine deutliche Überlegenheit im Gesamtüberleben (OS; Median nicht erreicht vs. 26,6 Monate; Hazard-Ratio [HR]: 0,66, p<0,0001), im progressionsfreien Überleben (30-Monate PFS 28% vs. 12%, HR: 0,77, p=0,0014) und in der Ansprechrate (42% vs. 29%; p=0,0001) für die ICI-Kombination gegenüber Sunitinib bei Patienten mit intermediärem/ungünstigem Risikoprofil.2 Bei Patienten mit günstigem Risikoprofil konnten diese Ergebnisse nicht erreicht werden. Bemerkenswert in dieser Studie ist die hohe Rate an kompletten Remissionen (11% vs. 2% in der Gesamtkohorte), unabhängig vom Risikoprofil.
Die Effektivität des PD-1-Inhibitors Pembrolizumab in Kombination mit dem TKI Axitinib wurde bei 861 Therapie-naiven Patienten in der Phase-III-Studie Keynote-426 überprüft.3 Nach einem medianen Follow-up von 12,8 Monaten wurden beide primäre Endpunkte, OS (1-Jahres-Überleben-Rate 89,9% vs. 78,3%, HR: 0,53, p<0,0001) und PFS (Median 15,1 vs. 11,1 Monate, HR: 0,69, p<0,001), hochsignifikant erreicht, unabhängig vom Risikoprofil.
Im Rahmen der Phase-III-Studie JAVELIN Renal 101 erhielten 886 Patienten randomisiert entweder den PD-L1 Inhibitor Avelumab plus Axitinib oder Sunitinib.4 Bei insgesamt 63,2% der Patienten lag ein PD-L1-positiver Tumor vor. Nach einem medianen Follow-up von 10,8 Monaten zeigte die Kombination von Avelumab plus Axitinib eine statistisch signifikante Verlängerung des PFS von 7,2 auf 13,8 Monate (HR 0,61, p<0,001) in der PD-L1-positiven Subgruppe und von 8,4 auf 13,8 Monate in der gesamten Patientenkohorte. Die finale Analyse des OS, des zweiten primären Endpunkts, ist noch ausständig.
Zusammenfassend kann festgestellt werden, dass die Einführung der ICI-basierten Ansätze den Therapiealgorithmus beim fortgeschrittenen Nierenzellkarzinom dramatisch verändert hat. Die Kombinationen Pembrolizumab plus Axitinib und Avelumab plus Axitinib gelten als Standardbehandlung für Therapie-naive Patienten jedes Risikoprofils. Bei intermediärem oder ungünstigem Risikoprofil stellt Ipilimumab plus Nivolumab eine potente alternative Therapieoption dar. Inzwischen werden mehrere unterschiedliche Kombinationen aus ICI und TKI getestet. Die Resultate aus aktuell laufenden Studien, u.a. CLEAR (Pembrolizumab plus Lenvatinib) und CheckMate-9 ER (Nivolumab plus Cabozantinib), gilt es abzuwarten.
Metastasiertes hormonsensitives Prostatakarzinom
Zur Behandlung des metastasierten, hormonsensitiven Prostatakarzinoms (mHSPC) war bislang die alleinige hormonablative Therapie vorgesehen, und erst bei Kastrationsresistenz eine Chemotherapie oder eine moderne Antihormontherapie. Basierend auf mehreren Phase-III-Studien, die einen bedeutsamen Überlebensvorteil zeigten, wird nun eine Chemotherapie mit Docetaxel oder neuen gezielten antihormonellen Therapien (Abirateron, Enzalutamid oder Darolutamid) ab Beginn der Androgendeprivation (ADT) auch bei mHSPC empfohlen (Tab. 2).
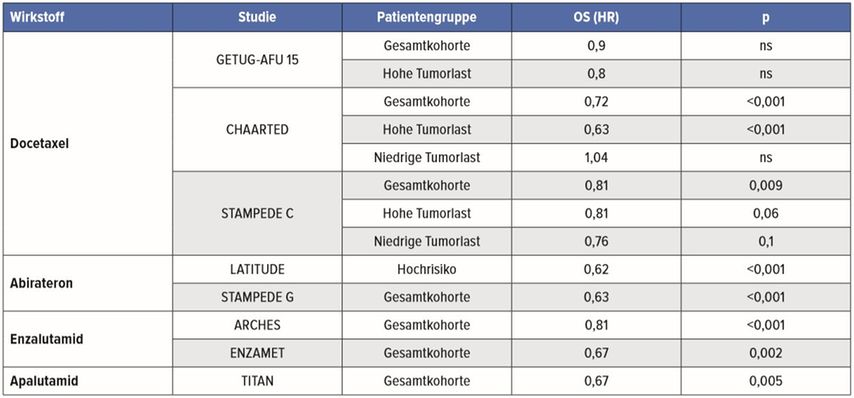
Tab. 2: Kombinationstherapie bei mHSPC; ns: nicht signifikant
Die Effektivität einer Kombinationstherapie von Docetaxel plus ADT bei Patienten mit mHSPC wurde in drei Phase-III-Studien untersucht: GETUG-AFU 15, CHAARTED und STAMPEDE C. In der GETUG-AFU 15 Studie erhielten 385 Patienten randomisiert ADT mit oder ohne Docetaxel (75mg/m2 q3W, bis zu 9 Zyklen).5 Obwohl die zusätzliche Gabe von Docetaxel zu ADT keinen statistisch signifikanten Nutzen in der Gesamtkohorte hatte, zeigte eine gepoolte Subgruppenanalyse von Patienten mit hoher Tumorlast aus der GETUG-AFU-15- und der CHAARTED-Studie eine signifikante Verlängerung des OS (HR: 0,68, p<0,001).6 In der CHAARTED-Studie wurden 790 Patienten einer Chemohormontherapie und einer ADT randomisiert.7 Jeweils 65% der Patienten in beiden Studienarmen wiesen eine hohe Tumorlast auf, definiert als viszerale Metastasen oder ≥4 Knochenläsionen mit ≥1 Läsion außerhalb des Beckens und des Wirbelkörpers. Nach 53,7 Monaten Follow-up zeigte die CHAARTED-Studie eine deutliche Überlegenheit der Chemohormontherapie gegenüber ADT im OS sowohl in der Gesamtkohorte (Median 57,6 vs. 47,2 Monate; p<0,001) als auch in der Subgruppe mit hoher Tumorlast (Median 51,2 vs. 34,4 Monate; p<0,001). Diese Ergebnisse konnten jedoch nicht bei Patienten mit geringer Tumorlast erzielt werden. Im Gegensatz dazu zeigte die STAMPEDE-C-Studie mit der größten untersuchten Population (1086 Patienten, 2:1 in Kontroll- und Studienarm randomisiert) eine signifikante Verlängerung des OS (Median 60 vs. 45 Monate, p=0,009) unabhängig von der Tumorlast.8
Die neuen gezielten Antihormontherapien stellen eine alternative Option zur Chemotherapie in der Behandlung des mHSPC dar. Die Überlegenheit von Abirateron (mit Prednison) plus ADT im Vergleich zur alleinigen ADT wurde in der LATITUDE- und der STAMPEDE-G-Studie bestätigt. In der LATITUDE-Studie wurden 1199 Patienten mit einem mHSPC und mindestens 2 von 3 Risikofaktoren (Gleason Score ≥8, ≥3 Knochenmetastasen oder viszerale Metastasen) eingeschlossen.9 Nach einem medianen Follow-up von 30,4 Monaten zeigte sich unter der Kombination eine statistisch signifikante Verbesserung der 3-Jahres- Überlebensrate von 49% auf 66% (p<0,001).
Im Gegensatz dazu wurden in der STAMPEDE-G-Studie 1917 Patienten mit einem mHSPC, unabhängig von Risikofaktoren oder Tumorlast, zu Abirateron plus ADT oder alleiniger ADT randomisiert. Nach 40 Monaten Follow-up lag die 3-Jahres-Überlebensrate bei 83% im Kombinationsarm vs. 76% im Kontrollarm (p<0,001). Relevante Grad-3-Toxizitäten waren Hypertonie (bis zu 20%) und Hepatotoxizität (7%).10
Die Effektivität von Enzalutamid plus ADT wurde in den Phase-III-Studien ARCHES und ENZAMET getestet. In der ARCHES-Studie wurde Enzalutamid plus ADT bei 1150 mHSPC-Patienten mit alleiniger ADT verglichen. Der primäre Endpunkt der ARCHES-Studie, das radiografische PFS, wurde mit einer HR von 0,39 (Median nicht erreicht vs. 19 Monate, p<0,001) hochsignifikant erreicht.11 Erstmals wurde in der ENZAMET-Studie in metastasierten hormonsensitiven Stadien eine neue Anti-Hormon-Behandlung gegen einen aktiven Vergleichsarm, mit nichtsteroidalen Antiandrogenen der ersten Generation (u.a. Bicalutamid, Flutamid, Nilatumid), verglichen. Eingeschlossen waren alle Patienten unabhängig von Risikofaktoren, Tumorlast oder Vorbehandlung mit Docetaxel. Nach einem medianen Follow-up von 34 Monaten lebten im Enzalutamid-Arm noch 82% der Patienten vs. 74% im Vergleichsarm (HR: 0,67, p=0,002). Bei der Subgruppe von Patienten, die gleichzeitig Docetaxel erhielten, war jedoch kein signifikanter Unterschied im OS zwischen der Enzalutamid-Gruppe und dem Kontrollarm. Die häufigsten Grad-3-Toxizitäten im Enzalutamid-Arm waren Hypertonie (11%), Fatigue (6%) und Synkopen (4%).12
In der Phase-III-Studie TITAN wurde der neue Androgenrezeptor(AR)-Inhibitor Apalutamid plus ADT bei 1052 Patienten untersucht.13 Diese Kombination hat auf Basis einer statistisch signifikanten Überlegenheit gegenüber ADT sowohl beim radiografischen PFS (HR: 0,48, p<0,001) als auch beim OS (HR: 0,67, p=0,05) im Februar 2020 die EMA-Zulassung erhalten. Eingeschlossen waren Patienten mit hohem und geringem Risiko sowie Patienten, die vor Apalutamid bereits bis zu 2 Zyklen Docetaxel erhalten hatten. Wiederum profitierte die mit Docetaxel vorbehandelte Subgruppe am wenigstens von Apalutamid plus ADT. Relevante Grad-3-Toxizitäten im Apalutamid-Arm waren Hautausschlag (6,3%) und Knochenbrüche (1,3%).
Zusammenfassend lässt sich sagen, dass der Einsatz von Docetaxel, Abirateron, Enzalutamid oder Apalutamid als neuer Therapiestandard für Patienten mit einem kastrationssensiblen metastasierten Prostatakarzinom angesehen werden kann. Demnächst wird die intensivierte Kombinationstherapie mit Docetaxel plus neuen gezielten Antihormontherapien beim mHSPC durch die laufende ARASENS-(Darolutamid + Docetaxel) und PEACE-Studie (Docetaxel + Abirateron) untersucht.
Metastasiertes Harnblasenkarzinom
Entscheidend für die Behandlung von Therapie-naiven Patienten mit fortgeschrittenem Urothelkarzinom ist weiterhin das Vorliegen von Risikofaktoren, die gegen eine Cisplatin-haltige Chemotherapie sprechen; und zwar eine eingeschränkte Nierenfunktion (GFR<60mL/min), ein schlechter Performance-Status (ECOG≥2) oder eine relevante Herzinsuffizienz. Bei Fehlen von Kontraindikationen bleibt unverändert die Cisplatin-basierte Kombinationsbehandlung die Erstlinientherapie der Wahl.14
Gegenstand mehrerer aktueller Studien ist der Einsatz von ICI plus Chemotherapie in der Erstlinienbehandlung bei fortgeschrittenem Urothelkarzinom. Die Ergebnisse laufender Phase-III-Studien, u.a. KEYNOTE-361 (Pembrolizumab), IMvigor-130 (Atezolizumab) und CheckMate-901 (Nivolumab), werden mit Spannung erwartet.
Literatur:
1 Motzer RJ et al.: Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma. N Engl J Med 2018; 378(14): 1277-90 2 Motzer RJ et al.: Nivolumab plus ipilimumab versus sunitinib in first-line treatment for advanced renal cell carcinoma: extended follow-up of efficacy and safety results from a randomised, controlled, phase 3 trial. Lancet Oncol 2019; 20(10): 1370-85 3 Rini BI et al.: Pembrolizumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 2019; 380 (12): 1116-27 4 Motzer RJ et al.: Avelumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 2019; 380 (12): 1103-15 5 Gravis G et al.: Androgen-deprivation therapy alone or with docetaxel in non-castrate metastatic prostate cancer (GETUG-AFU 15): a randomised, open-label, phase 3 trial. Lancet Oncol 2013; 14(2): 149-58 6 Gravis G et al.: Burden of metastatic castrate-naive prostate cancer patients, to identify men more likely to benefit from early docetaxel: further analyses of CHAARTED and GETUG-AFU15 studies. Eur Urol 2018; 73(6): 847-55 7 Kyriakopoulos CE et al.: Chemohormonal therapy in metastatic hormone-sensitive prostate cancer: long-term survival analysis of the randomized phase III e3805 CHAARTED trial. J Clin Oncol 2018; 36(11): 1080-7 8 Clarke NW et al.: Addition of docetaxel to hormonal therapy in low- and high-burden metastatic hormone sensitive prostate cancer: long-term survival results from the STAMPEDE trial. Ann Oncol 2019; 30(12): 1992-2003 9 Fizazi K et al.: Abiraterone plus prednisone in metastatic, castration-sensitive prostate cancer. N Engl J Med 2017; 377(4): 352-60 10 James ND et al.: Abiraterone for prostate cancer not previously treated with hormone therapy. N Engl J Med 2017; 377(4): 338-51 11 Armstrong AJ et al.: Arches: A randomized, phase III study of androgen deprivation therapy with enzalutamide or placebo in men with metastatic hormone-sensitive prostate cancer. J Clin Oncol 2019; 37(32): 2974-86 12 Davis ID et al.: Enzalutamide with standard first-line therapy in metastatic prostate cancer. N Engl J Med 2019; 381(2): 121-31 13 Chi KN et al.: Apalutamide for metastatic, castration-sensitive prostate cancer. N Engl J Med 2019; 381(1): 13-24 14 Witjes JA et al.: EAU-ESMO Consensus Statements on the management of advanced and variant bladder cancer—an international collaborative multistakeholder effort†: under the auspices of the EAU-ESMO Guidelines Committees. Eur Urol 2020; 77(2): 223-50
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...


